질량분석 시료 준비
Sample preparation in mass spectrometry질량분석용 시료제제는 질량분석계(MS)에서의 분석용 시료의 최적화에 이용되며, 각각의 이온화 방법은 분석물 용액의 부피, 농도, 시료 위상, 조성 등 그 방법이 성공하기 위해 고려해야 할 특정 요소를 가지고 있다.샘플 준비에서 가장 중요한 고려사항은 샘플이 어떤 단계에 있어야 분석이 성공하는지 아는 것입니다.이온원에 들어가기 전에 분석물 자체를 정제해야 하는 경우도 있다.다른 상황에서는 매트릭스 또는 분석물질을 둘러싼 솔루션 내의 모든 것이 고려 및 조정해야 하는 가장 중요한 요소입니다.종종 질량분석에 대한 샘플 준비 자체는 질량분석계에 들어가기 전에 질량분석법을 크로마토그래피 방법과 결합하거나 다른 형태의 분리에 의해 피할 수 있다.어떤 경우에는 분석물 자체가 분석이 가능하도록 조절되어야 한다. 예를 들어 단백질 질량 분석에서는 분석 전에 관심 단백질이 겔 내 소화 또는 용액 내 단백질 분해를 통해 펩타이드로 분해된다.
샘플 단계
| 샘플 단계 | 이온화법 |
|---|---|
| 단단한 | 필드 탈착 |
| 플라즈마 탈착 | |
| 고속 ATOM 폭격(FAB) | |
| 2차 이온(SIMS) | |
| 주변 이온화 | |
| 솔루션 | 매트릭스 지원 레이저 탈리 이온화(MALDI) |
| 일렉트로스프레이(ESI) | |
| 대기압 화학 이온화(APCI) | |
| 주변 이온화 | |
| 가스 | 전자 이온화 |
| 광이온화 | |
| 화학 이온화 |
질량분석에 대한 샘플 준비의 첫 번째이자 가장 중요한 단계는 샘플이 어떤 단계에 있어야 하는지를 결정하는 것입니다.이온화 방법에 따라 다른 샘플 위상이 필요합니다.고체상 샘플은 필드 탈착, 플라즈마 탈착, 고속 원자 충격 및 2차 이온화 등의 방법을 통해 이온화할 수 있습니다.분석 물질이 녹아 있는 액체 또는 용액은 매트릭스 보조 레이저 탈착, 일렉트로스프레이 이온화 및 대기압 화학 이온화 등의 방법을 통해 이온화할 수 있습니다.둘 다 고체와 액체 샘플 주변 이온화 기술에 이온화될 수 있다.
가스 샘플 또는 휘발성 샘플은 전자 이온화, 광이온화, 화학 이온화 등의 방법을 사용하여 이온화할 수 있습니다.
이러한 목록은 각 이온화 방법에 가장 일반적으로 사용되는 물질 상태이지만, 이온화 방법이 반드시 이러한 물질 상태에만 국한되는 것은 아닙니다.예를 들어, 고속 원자 충격 이온화는 일반적으로 고체 시료를 이온화하는 데 사용되지만, 이 방법은 일반적으로 용액에 용해된 고형물에 사용되며,[1][2][3] 기체상에 진입한 성분을 분석하는 데도 사용될 수 있습니다.
시료 준비 방법으로서의 크로마토그래피
많은 질량 분석 이온화 방법에서 이온화 방법이 작동하려면 샘플이 액체 또는 기체 상태여야 합니다.적절한 이온화를 보장하기 위한 샘플 준비는 어려울 수 있지만 질량 분석계를 일부 크로마토그래피 장비에 결합하면 더 쉽게 만들 수 있습니다.시료 제조 방법으로는 가스 크로마토그래피(GC) 또는 액체 크로마토그래피(LC)를 사용할 수 있다.
가스 크로마토그래피
GC는 혼합가스 시료 내에서 서로 다른 분석물질을 분리하는 방법이다.분리된 기체는 여러 가지 방법으로 검출할 수 있지만, 가스 크로마토그래피의 가장 강력한 검출 방법 중 하나는 질량 분석법이다.기체가 분리되면 질량분석계에 들어가 분석됩니다.이 조합은 분석물질을 분리할 뿐만 아니라 각 물질에 대한 구조 정보를 제공합니다.GC 시료는 휘발성이 있거나 가스상에 [4][5]진입할 수 있어야 하며 가열 시 분해되지 않도록 열적으로 안정적이어야 한다.샘플이 기체 단계에 있어야 하는 질량 분석 이온화 기술도 비슷한 문제를 안고 있다.
질량 분석에서 전자 이온화(EI)는 가스 크로마토그래피와 유사하게 작은 분자로 휘발성이 있고 열적으로 안정적인 샘플을 필요로 합니다.따라서 질량 분석계에 들어가기 전에 샘플에 GC가 수행되는 한 EI에 [6][7]의한 이온화를 위해 샘플이 준비됩니다.
화학 이온화(CI)는 샘플이 기체상에 있어야 하는 또 다른 방법입니다.이는 시료가 시약가스와 반응하여 질량분석기로 분석할 수 있는 이온을 형성할 수 있도록 하기 위함이다.CI에는 표본의 휘발성 및 열 안정성 등 표본 준비 시 EI와 동일한 요구 사항이 많습니다.GC는 [8]이 기법을 위한 샘플 준비에도 유용합니다.CI의 장점 중 하나는 GC로 분리된 더 큰 분자를 이 이온화 방법으로 분석할 수 있다는 것이다.CI는 EI의 질량 범위보다 더 크고 EI가 할 수 없는 분자를 분석할 수 있습니다.CI는 또한 샘플 분자에 대한 손상이 적다는 장점이 있기 때문에 파편화가 적고 원래 분석물질에 대한 더 많은 정보를 [6][9]확인할 수 있습니다.
광이온화(PI)는 [10]GC로 분리된 기체를 검출하기 위해 이온화 방식으로 처음 적용된 방법이다.몇 년 후, LC의 검출기로도 적용되었지만, 시료를 광이온화 검출기로 검출하려면 먼저 기화시켜야 한다.결국 PI는 질량분석,[11] 특히 가스 크로마토그래피-질량분석의 이온화 방법으로 적용되었다.PI를 위한 샘플 준비에는 먼저 샘플이 기체상에 있는지 확인하는 작업이 포함됩니다.PI는 빛의 광자로 샘플 분자를 들뜨게 함으로써 분자를 이온화시킨다.이 방법은 시료 및 기체상의 다른 성분이 다른 파장의 빛에 의해 들뜨는 경우에만 작동합니다.시료 또는 광자원을 준비할 때, 이온화의 파장을 조절하여 시료 분석물을 자극하는 것이 중요합니다.[6]
액체 크로마토그래피
액체 크로마토그래피(LC)는 어떤 면에서 GC보다 강력하지만 질량 분석과 쉽게 결합할 수 있는 방법입니다.LC에서는 샘플 준비에 대한 우려를 최소화할 수 있습니다.LC에서는 정지위상과 이동위상이 모두 분리에 영향을 미칠 수 있지만 GC에서는 정지위상만이 영향을 미칠 수 있습니다.따라서 검체를 실행하기 전에 정지 위상 또는 이동 위상을 조정하려는 경우 검체 준비를 최소화할 수 있습니다.주요 관심사는 분석 물질의 농도이다.농도가 너무 높으면 분리에 실패할 수 있지만 검출 방법인 질량 분석법은 완전한 분리가 필요하지 않아 LC를 질량 [12]분석계에 결합하는 또 다른 장점이 있다.
LC는 액체 샘플이 질량분석계에 들어갈 때 기화를 통해 질량분석과 결합될 수 있다.이 방법은 CI 또는 PI와 같이 가스 샘플을 사용해야 하는 이온화 방법, 특히 대기압 화학 이온화 또는 대기압 광이온화를 통해 더 많은 상호작용과 이온화를 [6][13]가능하게 한다.다른 이온화 방법은 액체 시료를 증발시킬 필요가 없으며 액체 시료 자체를 분석할 수 있다.예를 들어 LC에 의해 분리된 액체 샘플이 이온화 챔버로 흘러들어 쉽게 [1]이온화될 수 있는 고속 원자 충격 이온화가 있습니다.LC와 결합되는 가장 일반적인 이온화 방법은 일종의 스프레이 이온화이며, 여기에는 열경사 이온화 및 더 일반적으로 일렉트로스프레이(ESI) 이온화가 포함됩니다.
서모스프레이는 용매를 효과적으로 제거하고 샘플을 더 쉽게 증발시키는 방법으로 처음 개발되었습니다.이 방법에서는 LC에서 나오는 액체 시료가 단순히 시료를 가열하는 전기 가열 기화기를 통해 흐르면서 용제를 제거하고 시료를 기체 [14]상태로 만드는 방법을 사용합니다.ESI(Electrospray Ionization)는 시료에서 가능한 한 액체 용제를 제거하여 작은 물방울 또는 기체 형태로 하전된 시료 분자를 생성하는 원리에서 열경화(thermospray와 유사합니다.연구에 따르면 ESI는 [12]LC에 결합된 다른 이온화 방법보다 10배 이상 민감할 수 있습니다.이 방법은 시료 자체가 기체로 변하는 것이 아니기 때문에 비휘발성 [14]시료를 쉽게 분석할 수 있다는 점에서 특히 유용하다.
액체 크로마토그래피 질량 분석의 샘플 준비 문제 중 하나는 배경 분자의 존재로 인한 매트릭스 효과이다.이러한 매트릭스 효과는 분석 중인 샘플에 따라 PI 및 ESI와 같은 방법에서 신호를 최대 60% 감소시키는 것으로 나타났습니다.매트릭스 효과로 인해 신호가 증가하여 잘못된 양성 결과가 발생할 수도 있습니다.이는 LC를 수행하기 전에 최대한 시료를 정제하여 수정할 수 있으나, 시료 내의 모든 것이 우려되는 환경 시료를 분석하는 경우에는 시료 준비가 문제를 해결하기 위한 이상적인 해결책이 아닐 수 있다.이 문제를 해결하기 위해 적용할 수 있는 또 다른 방법은 표준 추가 [12][15]방법을 사용하는 것입니다.
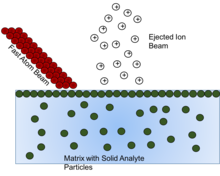
고속 원자 폭격
고속원자폭격(FAB)은 고에너지 원자의 빔을 사용하여 표면을 타격하고 이온을 발생시키는 방법입니다.이러한 고체 분석물 입자는 고체 분석물의 이온화를 보호하고 지원하기 위해 어떤 형태의 매트릭스 또는 비휘발성 액체로 용해되어야 합니다.매트릭스가 고갈되면 이온 형성이 감소하므로 올바른 매트릭스 화합물을 선택하는 것이 중요합니다.[16]
매트릭스 화합물의 전체적인 목표는 높은 이동 표면 농도로 샘플을 원자 빔에 제공하는 것입니다.최대 감도를 위해 샘플은 휘발성이 [17]낮은 기판 표면에 완벽한 단층층을 형성해야 한다.이 단층 효과는 매트릭스 내 분석물질의 일정 농도에 도달하면 그 이상의 농도는 영향을 주지 않는 것으로 보인다. 왜냐하면 일단 단층이 형성되면 추가적인 분석물질은 단층층 아래에 있기 때문에 원자빔의 영향을 받지 않기 때문이다.이 효과를 일으키는 데 필요한 농도는 비휘발성 매트릭스의 양이 변화함에 따라 변화합니다.따라서 "숨겨진" 분석물질의 신호가 [17]누락되지 않도록 분석용액을 준비할 때 고체 분석물질의 농도를 고려할 필요가 있다.
각 고체 분석물질에 대한 매트릭스를 선택하려면 세 가지 기준을 고려해야 합니다.첫째, 분석 대상 고체 화합물을 (코졸벤트 또는 첨가제의 사용 여부와 관계없이) 용해시켜야 하며, 따라서 해당 화합물의 분자가 표면층으로 확산되어 고속 원자 빔과의 상호작용에 의해 이온화되거나 파괴된 샘플 분자를 보충해야 한다.FAB의 이온 형성을 설명하는 또 다른 메커니즘은 표면이 아닌 벌크에서 스패터링이 발생한다는 생각을 포함하지만, 이 경우 벌크 [16][17]용액에서 고체 분석 물질의 균질성을 보장하기 위해서는 용해성이 여전히 매우 중요하다.둘째, 매트릭스는 질량 분석계 조건에서 낮은 휘발성을 가져야 합니다.이상과 같이 매트릭스가 고갈됨에 따라 이온화도 감소하기 때문에 매트릭스를 유지하는 것이 중요하다.셋째, 매트릭스는 해당 고체 분석물질과 반응하지 않아야 하며, 만약 반응한다면 이해되고 재현될 [16]수 있어야 한다.이를 통해 분석물질의 유도체가 아닌 실제 분석물질의 분석과 식별의 재현성을 확보할 수 있다.
매트릭스로서 가장 일반적으로 사용되는 화합물은 글리세롤, 데우테로글리세롤, 티오글리세롤, 아미노글리세롤과 같은 글리세롤의 변종이다.시료가 예를 들어 글리세롤과 같이 선택된 매트릭스에서 용해되지 않을 경우, 코졸벤트 또는 첨가제를 매트릭스와 혼합하여 고체 분석물의 용해를 용이하게 할 수 있다.예를 들어 클로로필 A는 글리세롤에 완전히 용해되지 않지만 소량의 폴리에틸렌 글리콜 유도체인 트리톤 X-100에 혼합됨으로써 [17][18]클로로필은 매트릭스 내에서 고도로 용해된다.첨가제를 사용하여 글리세롤 또는 글리세롤을 통해 좋은 신호를 얻을 수 있지만, 더 나은 신호를 제공할 수 있는 다른 매트릭스 화합물이 있을 수 있습니다.매트릭스 화합물의 최적화와 고체 분석물의 농도는 FAB 측정에 필수적입니다.
이차 이온 질량 분석
2차 이온 질량 분석법(SIMS)은 시료의 분자가 이온화되어 표면을 이탈하는 스패터링을 일으키기 위해 입자 빔을 시료의 표면에 발사함으로써 이온 또는 시료를 분석할 수 있는 FAB와 매우 유사한 방법이다.주요 차이점은 SIMS에서는 이온빔이 표면에 대해 발사되지만 FAB에서는 원자빔이 표면에 대해 발사된다는 것입니다.이 페이지의 또 다른 주요 차이점은 FAB와 달리 SIMS는 일반적으로 샘플 준비가 거의 [19]필요 없이 솔리드 샘플에서 수행된다는 것입니다.
SIMS의 주요 고려사항은 샘플이 초고진공, 즉 10torr 미만의−8 압력에서 안정적인지 확인하는 것입니다.초고진공의 특성은 분석 중에 시료가 일정하게 유지되고 고에너지 이온 빔이 시료에 부딪히도록 하는 것입니다.초고진공은 샘플 준비 [20]시 고려해야 할 많은 문제를 해결합니다.분석을 위해 샘플을 준비할 때 고려해야 할 또 다른 사항은 필름 두께입니다.일반적으로 귀금속 표면에 얇은 단분자가 퇴적될 수 있다면 분석에 [21]성공해야 한다.실제 분석에서 흔히 볼 수 있는 막 두께가 너무 크면 니켈 그리드 위에 구멍이 뚫린 은박을 막 표면에 퇴적시키는 방법으로 문제를 해결할 수 있습니다.이는 귀금속에 [19]직접 퇴적된 박막과 유사한 결과를 낳습니다.
매트릭스 지원 레이저 탈리/이온화
매트릭스 지원 레이저 탈리 이온화(MALDI) 질량 분석의 경우, 고체 또는 액체 샘플을 매트릭스 용액과 혼합하여 샘플이 응집 또는 침전 등의 프로세스를 회피하는 동시에 샘플이 이온화 과정 [22][23]동안 안정적인 상태를 유지할 수 있도록 한다.매트릭스는 샘플로 결정화되어 불활성 금속에서 불활성 폴리머에 이르는 다양한 재료로 만들어질 수 있는 샘플 플레이트에 부착됩니다.샘플 분자를 포함한 매트릭스는 펄스 레이저 조사에 의해 기체상으로 이행됩니다.매트릭스의 구성, 샘플과 매트릭스 간의 상호 작용 및 샘플이 축적되는 방법은 샘플 준비 중에 최상의 결과를 보장하기 위해 매우 중요합니다.
MALDI 분석을 위해 시료를 준비할 때 매트릭스 선택이 첫 번째 단계이다.매트릭스의 주요 목표는 레이저로부터 에너지를 흡수하여 분석물 분자로 전달하고 분석물 분자를 서로 [24]분리하는 것입니다.매트릭스를 선택할 때 고려해야 할 사항은 어떤 유형의 분석 물질이온을 예상하거나 원하는가이다.예를 들어 매트릭스의 산도나 염기성과 비교한 분석물 분자의 산도나 염기성을 아는 것은 매트릭스를 선택할 때 중요한 지식이다.매트릭스는 분석물 분자와 경쟁해서는 안 되며, 따라서 매트릭스는 분석물과 동일한 유형의 이온을 형성해서는 안 됩니다.예를 들어 원하는 분석물질의 산도가 높을 경우, 경쟁을 피하고 [25]이온의 형성을 용이하게 하기 위해 염기성이 높은 매트릭스를 선택하는 것이 논리적이다.또한 행렬의 pH를 사용하여 스펙트럼을 얻을 표본을 선택할 수 있습니다.예를 들어, 단백질의 경우, 매우 산성인 pH는 펩타이드 성분의 매우 적은 양을 보여줄 수 있지만, 더 큰 성분에 대해서는 매우 좋은 신호를 보여줄 수 있다.pH가 보다 기본적인 pH로 증가하면 더 작은 컴포넌트를 쉽게 [26]볼 수 있습니다.
시료 중 염분 농도는 MALDI 시료를 조제할 때도 고려해야 할 요소이다.소금은 시료를 안정화시키면서 응집이나 침전을 방지함으로써 MALDI 스펙트럼에 도움을 줄 수 있다.그러나 매트릭스가 알칼리 금속이온과 상호작용하는 경우 등 매트릭스와 시료의 부작용으로 인해 간섭신호가 관찰될 수 있다.일반적으로 매트릭스 내 염분의 양은 [23]1몰과 같이 매우 높은 농도에서만 문제가 됩니다.시료 중 염분 농도가 너무 높은 문제는 먼저 액체 크로마토그래피를 통해 시료 정화에 도움을 주는 방법으로 해결할 수 있지만, 이 방법은 시간이 오래 걸리고 분석 대상 시료 중 일부가 손실되는 결과를 초래한다.또 다른 방법은 시료용액이 시료프로브에 퇴적된 후 정화에 초점을 맞춘다.대부분의 샘플 프로브는 표면에 해당 샘플을 프로브 표면에 선택적으로 결합할 수 있는 막을 갖도록 설계할 수 있습니다.그런 다음 표면을 헹구어 불필요한 소금이나 배경 분자를 제거할 수 있습니다.그런 다음 적절한 염분 농도의 매트릭스를 프로브 표면의 시료에 직접 퇴적하여 [23]결정화할 수 있습니다.염분 농도의 이러한 부정적인 영향에도 불구하고, 적절한 완충 소금의 선택이 [27]이 문제의 발생을 막기 때문에 단백질의 경우 별도의 담수화 단계가 필요하지 않습니다.
시료 프로브 표면에 시료와 매트릭스를 부착하는 방법도 시료 준비 시 고려해야 합니다.건조 적하법은 퇴적법 중 가장 간단한 방법이다.매트릭스와 샘플 용액을 함께 혼합한 다음 혼합물의 작은 방울을 샘플 프로브 표면에 놓고 건조시킨 후 결정화한다.샌드위치 방법은 탐촉자 표면에 매트릭스 층을 쌓은 후 건조시키는 것입니다.시료의 한 방울에 이어 추가적인 매트릭스 한 방울을 건조 매트릭스 층에 도포하여 [28]건조시킨다.샌드위치 기법의 변형에는 매트릭스를 표면에 퇴적시킨 다음 매트릭스 위에 샘플을 직접 퇴적시키는 것이 포함됩니다.특히 유용한 방법은 매우 빠르게 증발하는 용매에 매트릭스 용액을 샘플 프로브 표면에 퇴적시켜 매트릭스의 매우 얇은 미세층을 형성하는 것입니다.그런 다음 샘플 용액을 매트릭스 층 위에 올려놓고 천천히 증발시켜 샘플 용액이 [29]증발함에 따라 샘플을 매트릭스의 상단 층에 통합합니다.시료를 프로브 표면에 부착할 때 추가적인 문제는 매트릭스 내 시료의 용해성입니다.시료가 매트릭스에서 용해되지 않을 경우 추가 방법을 사용해야 한다.이 경우 사용되는 방법은 기계적 연삭과 고체 시료 및 고체 매트릭스 결정의 혼합을 포함한다.잘 혼합되면 이 가루는 시료 프로브 표면에 자유 분말 형태 또는 알약 형태로 퇴적될 수 있습니다.또 다른 가능한 방법은 시료를 프로브 표면에 놓고 기화 매트릭스를 [30]시료 프로브에 적용하여 매트릭스가 시료 주위에 응축되도록 하는 것입니다.
일렉트로스프레이 이온화
일렉트로스프레이 이온화(ESI)는 고전압을 사용하여 일렉트로스프레이 또는 고전압에 의해 [31]생성되는 미세한 에어로졸을 생성하는 기술입니다.ESI 검체 준비는 매우 중요할 수 있으며 [32]검체의 특성에 따라 결과의 품질이 크게 결정될 수 있습니다.ESI 실험은 온라인 또는 오프라인으로 실행할 수 있습니다.온라인 측정에서 질량 분석계는 액체 크로마토그래프에 연결되고 샘플이 분리되면 ESI 시스템에 의해 질량 분석계로 이온화됩니다. 샘플 준비는 실제로 LC [33]분리 전에 수행됩니다.오프라인 측정에서 분석물질 용액은 스프레이 캐피럴리에 의해 질량분석계에 직접 도포되며, 오프라인 시료 준비는 나노리터 범위에서 부피를 적용할 수 있는 등 여러 가지 고려사항이 있으며, 이는 많은 화합물 분석에 너무 작은 농도를 포함할 수 있다.단백질로 반응합니다.또한 분석물 샘플과 백그라운드 구성요소 간의 간섭으로 인해 ESI 신호가 손실될 수 있습니다.불행히도 샘플 준비 자체는 이 문제를 약간만 완화시킬 수 있는 것으로 나타났는데,[34] 이는 준비보다는 분석물 자체의 특성 때문이다.ESI에서 주된 문제는 기체상의 반응에서 오는 것이 아니라 액체 자체의 용액상을 수반하는 문제에서 온다.이 문제는 액체 중에 남아 있는 비휘발성 물질 때문에 발생할 수 있으며, 액체 형성 또는 액체 증발의 효율이 변화하여 최종적으로 질량 분석계에 도달하는 기체상의 하전 이온 양에 영향을 미칠 수 있습니다.이러한 문제는 시료 용액 내 매트릭스보다 분석 물질의 농도를 증가시키거나 분석 [35][36]전에 보다 광범위한 크로마토그래피 기법을 통해 시료를 실행하는 등 여러 가지 방법으로 해결할 수 있습니다.ESI에서 신호를 지원할 수 있는 크로마토그래피 기술의 예로는 2-D 액체 크로마토그래피를 사용하거나 두 개의 개별 크로마토그래피 컬럼을 통해 샘플을 실행하여 [37][38]분석 물질을 매트릭스에서 더 잘 분리하는 방법이 있습니다.
ESI의 종류
샘플 준비가 거의 필요 없거나 전혀 필요 없는 ESI 방법이 있습니다.그러한 방법 중 하나가 추출 일렉트로스프레이 이온화(EESI)라고 불리는 방법이다.이 방법에는 별도의 분무기에 의해 생성된 샘플 용액의 다른 분무에 대한 각도로 용제의 일렉트로스프레이가 사용됩니다.이 방법은 용제의 일렉트로스프레이가 복합 혼합물에서 샘플을 추출하여 백그라운드 오염 물질을 [39]효과적으로 제거하는 점에서 샘플 준비가 필요하지 않습니다.ESI의 또 다른 강력한 변이는 탈착 일렉트로스프레이 이온화(DESI)입니다.이것은 샘플이 그 위에 퇴적된 표면에서 일렉트로스프레이를 유도하는 것을 수반합니다.샘플은 표면에서 튀어 나온 후 질량 분석계로 이동하면서 일렉트로스프레이에서 이온화됩니다.이 방법에는 샘플 준비가 필요하지 않으므로 이 방법은 중요합니다.샘플은 [40]종이와 같은 표면에 쌓기만 하면 된다.대기압 화학 이온화(APCI)는 ESI와 유사하며 샘플이 액체에서 분무되어 증발하고 하전된 이온을 분석해야 합니다.APCI는 ESI와 같이 액체 방울이 아닌 기체 단계에서 이온화가 발생한다는 사실과 APCI에서 반응 [41][42]가스의 과잉이 존재하기 때문에 ESI가 경험하는 부정적인 매트릭스 효과는 거의 없다.
단백질 ESI
ESI의 주요 적용 분야는 단백질 질량 분석 분야이다.여기서 MS는 단백질의 동정과 사이징에 사용된다.단백질 샘플의 식별은 ESI-MS에서 de novo 펩타이드 배열 분석(탠덤 질량 분석법 사용) 또는 펩타이드 질량 지문을 통해 수행될 수 있다.두 방법 모두 단백질의 이전 소화를 펩타이드에 요구하며, 대부분 단백질 분해효소를 사용하여 효소적으로 달성된다.ESI-MS 측정을 성공시키기 위해서는 인겔 소화 완충액과 마찬가지로 염분 함량이 너무 높고 분석물질 함량이 너무 낮은 용액이 필요하다.따라서 담수화 및 농축공정을 병행한다.일반적으로 역상 액체 크로마토그래피가 사용되며, 펩타이드는 크로마토그래피 매트릭스에 결합되어 있는 반면 염분은 세척으로 제거된다.펩타이드는 유기용매의 많은 부분을 포함하는 소량의 용액을 사용함으로써 매트릭스에서 용출될 수 있으며, 그 결과 분석물질의 최종 부피가 감소한다.LC-MS에서는 담수화/농도를 프리 컬럼으로 실현하고 오프라인 측정에서는 마이크로 리터 피펫과 직접 사용할 수 있는 역상 마이크로 컬럼을 사용한다.여기서 펩타이드는 유기용매의 적절한 부분을 포함한 스프레이 용액에 용출된다.생성된 용액(일반적으로 몇 마이크로리터)은 분석 물질로 농축되며 스프레이 모세관으로 옮겨진 후 MS에서 직접 사용할 수 있습니다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Caprioli, Richard M. (1990-04-15). "Continuous-Flow Fast Atom Bombardment Mass Spectrometry". Analytical Chemistry. 62 (8): 477A–485A. doi:10.1021/ac00207a715. PMID 2190496.
- ^ Takayama, Mitsuo (1995-07-21). "Gas-phase fast-atom bombardment mass spectrometry". International Journal of Mass Spectrometry and Ion Processes. 152 (1): 1–20. Bibcode:1996IJMSI.152....1T. doi:10.1016/0168-1176(95)04298-9.
- ^ Kralj, B.; Kramer, V.; Vrscaj, V. (1983). "Fast Atom Bombardment of Molecules in the Gaseous State". International Journal of Mass Spectrometry and Ion Physics. 46: 399–402. Bibcode:1983IJMSI..46..399K. doi:10.1016/0020-7381(83)80136-3.
- ^ James M. Miller (16 December 2005). Chromatography: Concepts and Contrasts. John Wiley & Sons. ISBN 978-0-471-98059-9.
- ^ Mondello, Luigi; Tranchida, Peter Quinto; Dugo, Paola; Dugo, Giovanni (2008). "Comprehensive two-dimensional gas chromatography-mass spectrometry: A review". Mass Spectrometry Reviews. 27 (2): 101–124. Bibcode:2008MSRv...27..101M. doi:10.1002/mas.20158. ISSN 0277-7037. PMID 18240151.
- ^ a b c d Chhabil Dass (11 May 2007). Fundamentals of Contemporary Mass Spectrometry. John Wiley & Sons. ISBN 978-0-470-11848-1.
- ^ Aiken, Allison C.; DeCarlo, Peter F.; Jimenez, Jose L. (2007). "Elemental Analysis of Organic Species with Electron Ionization High-Resolution Mass Spectrometry". Analytical Chemistry. 79 (21): 8350–8358. doi:10.1021/ac071150w. ISSN 0003-2700. PMID 17914892.
- ^ Angerosa, Franca; d'Alessandro, Nicola; Corana, Federica; Mellerio, Giorgio (1996). "Characterization of phenolic and secoiridoid aglycons present in virgin olive oil by gas chromatography-chemical ionization mass spectrometry". Journal of Chromatography A. 736 (1–2): 195–203. doi:10.1016/0021-9673(95)01375-X. ISSN 0021-9673.
- ^ Field, Frank H. (1968). "Chemical ionization mass spectrometry". Accounts of Chemical Research. 1 (2): 42–49. doi:10.1021/ar50002a002. ISSN 0001-4842.
- ^ Driscoll, John N. (1977). "Evaluation of a new photoionization detector for organic compounds". Journal of Chromatography A. 134 (1): 49–55. doi:10.1016/S0021-9673(00)82568-6. ISSN 0021-9673.
- ^ Raffaelli, Andrea; Saba, Alessandro (2003). "Atmospheric pressure photoionization mass spectrometry". Mass Spectrometry Reviews. 22 (5): 318–331. Bibcode:2003MSRv...22..318R. doi:10.1002/mas.10060. ISSN 0277-7037. PMID 12949917.
- ^ a b c Petrović, Mira; Hernando, Maria Dolores; Díaz-Cruz, M. Silvia; Barceló, Damià (2005). "Liquid chromatography–tandem mass spectrometry for the analysis of pharmaceutical residues in environmental samples: a review". Journal of Chromatography A. 1067 (1–2): 1–14. doi:10.1016/j.chroma.2004.10.110. ISSN 0021-9673. PMID 15844508.
- ^ Robb, Damon B.; Covey, Thomas R.; Bruins, Andries P. (2000). "Atmospheric Pressure Photoionization: An Ionization Method for Liquid Chromatography−Mass Spectrometry". Analytical Chemistry. 72 (15): 3653–3659. doi:10.1021/ac0001636. ISSN 0003-2700. PMID 10952556.
- ^ a b Blakley, C. R.; Vestal, M. L. (1983). "Thermospray interface for liquid chromatography/mass spectrometry". Analytical Chemistry. 55 (4): 750–754. doi:10.1021/ac00255a036. ISSN 0003-2700.
- ^ Benijts, Tom; Dams, Riet; Lambert, Willy; De Leenheer, André (2004). "Countering matrix effects in environmental liquid chromatography–electrospray ionization tandem mass spectrometry water analysis for endocrine disrupting chemicals". Journal of Chromatography A. 1029 (1–2): 153–159. doi:10.1016/j.chroma.2003.12.022. ISSN 0021-9673.
- ^ a b c Gower, John Leveson (1985). "Matrix compounds for fast atom bombardment mass spectrometry". Biological Mass Spectrometry. 12 (5): 191–196. doi:10.1002/bms.1200120502. ISSN 1052-9306.
- ^ a b c d Barber, Michael; Bordoli, Robert S.; Elliott, Gerald J.; Sedgwick, R. Donald; Tyler, Andrew N. (1982). "Fast Atom Bombardment Mass Spectrometry". Analytical Chemistry. 54 (4): 645A–657A. doi:10.1021/ac00241a817.
- ^ 순자 제품 페이지
- ^ a b Van Vaeck, Luc; Adriaens, Annemie; Gijbels, Renaat (1999-04-28). "Static Secondary Ion Mass Spectrometry: (S-SIMS) Part 1. Methodology and Structural Interpretation". Mass Spectrometry Reviews. 18 (1): 1–47. Bibcode:1999MSRv...18....1V. doi:10.1002/(sici)1098-2787(1999)18:1<1::aid-mas1>3.3.co;2-n.
- ^ Belu, Anna M.; Graham, Daniel J.; Castner, David G. (2003). "Time-of-flight secondary ion mass spectrometry: techniques and applications for the characterization of biomaterial surfaces". Biomaterials. 24 (21): 3635–3653. doi:10.1016/S0142-9612(03)00159-5. ISSN 0142-9612.
- ^ Benninghoven, Alfred; Hagenhoff, Birgit; Niehuis, Ewald (1993-07-15). "Surface MS: Probing Real World Samples". Analytical Chemistry. 65 (14): 630A–640A. doi:10.1021/ac00062a002.
- ^ Fenyo D; Wang Q; DeGrasse JA; Padovan JC; Cadene M; Chait BT (2007). "MALDI sample preparation: the ultra thin layer method". J Vis Exp (3): 192. doi:10.3791/192. PMC 2535834. PMID 18978997.
- ^ a b c Xu, Yingda; Bruening, Merlin L.; Watson, J. Throck (2003). "Non-specific, on-probe cleanup methods for MALDI-MS samples". Mass Spectrometry Reviews. 22 (6): 429–440. Bibcode:2003MSRv...22..429X. doi:10.1002/mas.10064. ISSN 0277-7037. PMID 14528495.
- ^ Hillenkamp, Franz; Karas, Michael; Beavis, Ronald C.; Chait, Brian T. (1991). "Matrix-Assisted Laser Desorption/Ionization Mass Spectrometry of Biopolymers". Analytical Chemistry. 63 (24): 1193A–1203A. doi:10.1021/ac00024a716. ISSN 0003-2700. PMID 1789447.
- ^ Zenobi, Renato; Knochenmuss, Richard (1998). "Ion formation in MALDI mass spectrometry". Mass Spectrometry Reviews. 17 (5): 337–366. Bibcode:1998MSRv...17..337Z. doi:10.1002/(SICI)1098-2787(1998)17:5<337::AID-MAS2>3.0.CO;2-S. ISSN 0277-7037.
- ^ Cohen, Steven L.; Chait, Brian T. (1996). "Influence of Matrix Solution Conditions on the MALDI-MS Analysis of Peptides and Proteins". Analytical Chemistry. 68 (1): 31–37. doi:10.1021/ac9507956. ISSN 0003-2700. PMID 8779435.
- ^ Smirnov et al., Anal.화학, 76 (10), S. 2958-2965, 2004
- ^ Kussmann, Martin; Nordhoff, Eckhard; Rahbek-Nielsen, Henrik; Haebel, Sophie; Rossel-Larsen, Martin; Jakobsen, Lene; Gobom, Johan; Mirgorodskaya, Ekatarina; Kroll-Kristensen, Anne; Palm‖, Lisbeth; Roepstorff, Peter (1997). "Matrix-assisted Laser Desorption/Ionization Mass Spectrometry Sample Preparation Techniques Designed for Various Peptide and Protein Analytes". Journal of Mass Spectrometry. 32 (6): 593–601. Bibcode:1997JMSp...32..593K. doi:10.1002/(SICI)1096-9888(199706)32:6<593::AID-JMS511>3.0.CO;2-D. ISSN 1076-5174.
- ^ Vorm, Ole.; Roepstorff, Peter.; Mann, Matthias. (1994). "Improved Resolution and Very High Sensitivity in MALDI TOF of Matrix Surfaces Made by Fast Evaporation". Analytical Chemistry. 66 (19): 3281–3287. doi:10.1021/ac00091a044. ISSN 0003-2700.
- ^ Trimpin, S.; Keune, S.; Räder, H. J.; Müllen, K. (2006). "Solvent-free MALDI-MS: Developmental improvements in the reliability and the potential of MALDI in the analysis of synthetic polymers and giant organic molecules". Journal of the American Society for Mass Spectrometry. 17 (5): 661–671. doi:10.1016/j.jasms.2006.01.007. ISSN 1044-0305. PMID 16540340.
- ^ Ho, CS; Chan MHM; Cheung RCK; Law LK; Lit LCW; Ng KF; Suen MWM; Tai HL (February 2003). "Electrospray Ionisation Mass Spectrometry: Principles and Clinical Applications". Clin Biochem Rev. 24 (1): 3–12. PMC 1853331. PMID 18568044.
- ^ Du L; White RL (November 2008). "Improved partition equilibrium model for predicting analyte response in electrospray ionization mass spectrometry". J Mass Spectrom. 44 (2): 222–9. Bibcode:2009JMSp...44..222D. doi:10.1002/jms.1501. PMID 19003789.
- ^ Pitt, James J (February 2009). "Principles and Applications of Liquid Chromatography-Mass Spectrometry in Clinical Biochemistry". Clin Biochem Rev. 30 (1): 19–34. PMC 2643089. PMID 19224008.
- ^ Bonfiglio, Ryan; King, Richard C.; Olah, Timothy V.; Merkle, Kara (1999). "The effects of sample preparation methods on the variability of the electrospray ionization response for model drug compounds". Rapid Communications in Mass Spectrometry. 13 (12): 1175–1185. doi:10.1002/(SICI)1097-0231(19990630)13:12<1175::AID-RCM639>3.0.CO;2-0. ISSN 0951-4198.
- ^ King, Richard; Bonfiglio, Ryan; Fernandez-Metzler, Carmen; Miller-Stein, Cynthia; Olah, Timothy (2000). "Mechanistic investigation of ionization suppression in electrospray ionization". Journal of the American Society for Mass Spectrometry. 11 (11): 942–950. doi:10.1016/S1044-0305(00)00163-X. ISSN 1044-0305. PMID 11073257.
- ^ Annesley, T. M. (2003). "Ion Suppression in Mass Spectrometry". Clinical Chemistry. 49 (7): 1041–1044. doi:10.1373/49.7.1041. ISSN 0009-9147. PMID 12816898.
- ^ Pascoe, Rob; Foley, Joe P.; Gusev, Arkady I. (2001). "Reduction in Matrix-Related Signal Suppression Effects in Electrospray Ionization Mass Spectrometry Using On-Line Two-Dimensional Liquid Chromatography". Analytical Chemistry. 73 (24): 6014–6023. doi:10.1021/ac0106694. ISSN 0003-2700. PMID 11791574.
- ^ Taylor, Paul J. (2005). "Matrix effects: the Achilles heel of quantitative high-performance liquid chromatography–electrospray–tandem mass spectrometry". Clinical Biochemistry. 38 (4): 328–334. doi:10.1016/j.clinbiochem.2004.11.007. ISSN 0009-9120. PMID 15766734.
- ^ Chen, Huanwen; Venter, Andre; Cooks, R. Graham (2006). "Extractive electrospray ionization for direct analysis of undiluted urine, milk and other complex mixtures without sample preparation". Chemical Communications (19): 2042–4. doi:10.1039/b602614a. ISSN 1359-7345. PMID 16767269.
- ^ Chen, Huanwen; Pan, Zhengzheng; Talaty, Nari; Raftery, Daniel; Cooks, R. Graham (2006). "Combining desorption electrospray ionization mass spectrometry and nuclear magnetic resonance for differential metabolomics without sample preparation". Rapid Communications in Mass Spectrometry. 20 (10): 1577–1584. doi:10.1002/rcm.2474. ISSN 0951-4198. PMID 16628593.
- ^ Souverain, Sandrine; Rudaz, Serge; Veuthey, Jean-Luc (2004). "Matrix effect in LC-ESI-MS and LC-APCI-MS with off-line and on-line extraction procedures". Journal of Chromatography A. 1058 (1–2): 61–66. doi:10.1016/S0021-9673(04)01477-3. ISSN 0021-9673.
- ^ Matuszewski, B. K.; Constanzer, M. L.; Chavez-Eng, C. M. (2003). "Strategies for the Assessment of Matrix Effect in Quantitative Bioanalytical Methods Based on HPLC−MS/MS". Analytical Chemistry. 75 (13): 3019–3030. doi:10.1021/ac020361s. ISSN 0003-2700. PMID 12964746.