RAB7A
RAB7A| RAB7A | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||
| 별칭 | RAB7A, PRO2706, RAB7, 멤버 RAS 종양유족, CMT2B | ||||||||||||||||||||||||
| 외부 ID | OMIM: 602298 MGI: 105068 HomoloGene: 3408 GeneCard: RAB7A | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 직교체 | |||||||||||||||||||||||||
| 종 | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레스 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 위치(UCSC) | Chr 3: 128.69 – 128.83Mb | Chr 6: 87.98 – 88.02Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키다타 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
라스 관련 단백질인 Rab-7a는 인간에서 Rab7A 유전자에 의해 암호화된 단백질이다.[5][6]
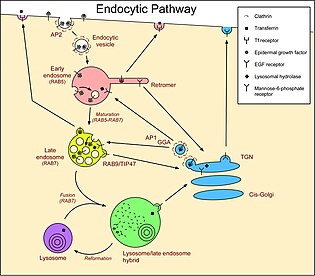
ras 관련 단백질인 rab-7a는 세포 안으로 물질을 가져오는 과정인 내분포증에 관여한다.내분포증의 과정은 세포 바깥의 물질(예를 들어 단백질) 주위의 세포막을 접고 나서 방광막을 형성하는 방식으로 작용한다.그리고 나서 방광은 세포 안으로 가져와 세포막에서 갈라진다.RAB7A는 Vesicle이 세포로 이동하는 데 중요한 역할을 하며 Vesicle 밀매와 함께 중요한 역할을 한다.[7]
RAB7A의 다양한 돌연변이는 Charcot-Marie-Tooth 증후군 타입 2B(CMT2B)로도 알려진 유전 감각 신경증 타입 1C(HSN IC)와 연관되어 있다.[8]
함수
RAS 관련 GTP 결합 단백질의 RAB 제품군 구성원은 Vesicular 수송의 중요한 규제 기관이며 특정 세포 내 구획에 위치한다.RAB7은 후기 내분자들로 국부화되었고 후기 내분비 경로에서 중요한 것으로 나타났다.또한 헬리코박터균의 세포독소 VacA에 의해 유도되는 세포 vacuolation에 근본적인 역할을 하는 것으로 나타났다.[9]
RAB7A는 내단백질 밀거래의 주요 규제기관으로서 기능하며, 초기에서 후반까지의 내단백질 성숙, 미세관절 마이너스-엔드 뿐만 아니라 더하기엔드 유도 내단백질 이동 및 위치, 서로 다른 단백질-단백질 상호작용 캐스케이드를 통한 내단백질-리소솜 수송을 관리한다.
또한 RAB7A는 SOX10의 변조를 통한 멜라노솜의 성숙과 종양 MYC와 같은 일부 특화된 내막 거래의 규제에도 관여하고 있다. 라이소솜 경로의 돌연변이는 흑색종 세포의 종양 진행을 초래한다.
조직 분포
RAB7은 널리 표현되어 있는데, 액손에서 신호 전달 내소체의 장기 역행 수송에 역할을 하기 때문에 골격근에서[10] 높은 표현이 발견된다.
유전자
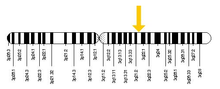
RAB7A 유전자는 인간의 3번 염색체에 위치하며, 특히 염기쌍 128,726,135부터 128,814,797까지의 긴 q팔에 위치한다.위치는 1997년 데이비스 등이 PCR 분석을 통해 RAB7A 유전자를 3번 염색체에 매핑하기 위해 처음 한 매핑을 이용해 발견됐다.[5]1995년에 바보사 외 연구진에 의해 생쥐의 9번 염색체에 매핑되었다.마지막으로, 상황혼합화(FISH)에서 형광을 이용하여 카슈바 등은 1997년에 RAB7A 유전자를 3분기21에 매핑할 수 있었다.[6]
랍7a는 인간의 태반 cDNA 라이브러리를 쥐, 쥐, 랫드, 개 Rab7a와 순서가 99%, 효모 Rab7a와 61% 동일한 207-아미노산 단백질을 암호화하는 것을 보여주기 위해 쥐 Rab7a와 함께 선별하여 복제되었다.비텔리 외 연구진(1996)은 Northern Block Analysis를 사용하여 검사한 모든 세포 라인에서 RAB7a가 1.7-kb, 2.5kb의 대본으로 표현되었지만, 세포 라인 중 RAB7a mRNA 총량에서 큰 차이가 있음을 발견했다.[11]
규정

RAB7a 수준과 기능이 멜라노사이트 계통특화전사인자(MITF)와는 무관한 것으로 연결돼 있지만 최근 연구결과 SOX10(신경계피 마스터모듈레이터)과 MYC(종양 유전체)가 주요 규제기관으로 나타났다.Rab7a는 각각 SOX10과 MYC가 계통별 배선에서 규제하고 있다.연구는 특히 흑색종에서[14] 종양 증식에 영향을 주기 위해 SOX10이나 MYC의 수준을 변경하는 것과 같은 MITF 독립적인 매너를 통해 RAB7a가 특별히 규제될 수 있다는 것을 보여준다.
항이센스 RNA를 이용한 연구에서 항이센스 RNA를 이용한 Hela 세포의 RAB7 유전자 발현 하한 조절은 체디아크 환자들의 섬유질에서 보이는 표현형과 유사한 심각한 세포 vacuolation을 유도한다.히가시증후군.[12]
성장인자가 존재하는 상황에서 포유류 Rab7의 성장인자 억제는 생쥐 친B-림프세포의 영양분 전달체 발현에 아무런 영향을 주지 않았다.그러나 성장인자 저하 세포에서는 Rab7 기능을 차단하여 포도당과 아미노산 전달 단백질의 세포 표면 간극을 막았다.Rab7이 억제되었을 때, 성장 인자하락 세포는 미토콘드리아 막 전위를 유지했고 성장 인자 독립적이고 영양에 의존하는 장기적 세포 생존을 보였다.저자들은 RAB7이 세포자율 영양소 섭취를 제한함으로써 단백질의 기능을 한다고 결론지었다.[13]
상호작용
RAB7A는 RILP[14][15] 및 CHM과 상호작용하는 것으로 나타났다.[16][17]RILP는 Rab7과 함께 분해 구획으로의 수송 제어에 핵심적인 역할을 하고 있으며 Rab7 기능을 Cytoskeleton에 연결할 수 있다.RILP는 Rab7을 위한 다운스트림 이펙터의 역할을 하며, 이 두 단백질은 함께 후기 내세포 트래픽을 조절하는 작용을 한다.[18]
Other key interactions include RAC1 (By similarity), NTRK1/TRKA (By similarity), C9orf72 (By similarity), CHM (the substrate-binding subunit of the Rab geranylgeranyltransferase complex), and RILP,[19] as well as PSMA7, RNF115 and FYCO1.PIK3C3/VPS34-PIK3R4 복합체와 상호 작용GTP 바인딩된 형태는 OSBPL1A 및 CLN3과 상호 작용한다.[20] Rab7A는 또한 Vps35 서브 유닛을 통해 가장 가능성이 높은 레트로머 콤플렉스와 상호작용하는 것으로 나타났다.[21]
임상적 유의성
RAB7은 35종류 이상의 종양에서 악성종양을 유발할 수 있는 작은 GTPase이다.RAB7은 초기에 유도된 흑색종 드라이버로 전이 위험을 정의할 수 있다.RAB7A 유전자는 RAS 종양 유전자의 RAB 계열에 속하며, RAS 종양 유전자의 일원이다.RAB과에 속하는 이 유전자들은 복실 밀매를 위한 단백질을 만드는 데 필요한 지시를 제공한다.이 단백질들은 GTPases이고 GTP와 GDP 분자에 의해 켜지고 꺼지는 스위치와 같은 역할을 한다.[7]
흑색종
흑색종 세포는 염전 밀매 경로의 독특한 배선을 반영하는 발달된 기억력을 가지고 있다.랍7은 흑색종 농축 종양 유전자 군집을 확인했을 때 이러한 공격적인 종양의 증식과 침습적 잠재력을 통제하는 것으로 보인다.진핵 세포의 보편적 특징인 리소솜 관련 분해는 종양 유형과 단계에 따라 납치될 수 있다.RAB7이 SOX10과 MYC에 의해 MITF에 독립적인 방식으로 제어된다는 것을 발견하는 것은 중요한 기본적이고 번역적인 의미를 갖는다.[22]삭스10은 BRAF 돌연변이를 포함한 일부 MITF를 하향 조정하는 메커니즘에 의해 억제되지 않으며, 악성 흑색종에서 비교적 빈번하게 발생한다.이것은 RAB7의 표현에서 발전적 기억력을 보장할 수 있다.공격적인 멜라노마 침습전선에서 RAB7의 하향 조절은 최근 진피성 표현형과 연관된 전사 스위치의 기초가 되는 것과 같은 상피 대 메스엔피 유사 메커니즘에 의해 조절되는 것으로 추측된다.다른 말로 하자면, 이 악성 종양과 35종 이상의 종양을 구별하는 라이소솜 유전자 군집 내에서 확인된 작은 GTPase RAB7에 흑색종 세포의 내재적 의존성이 있다.인간 세포, 임상 검체 및 마우스 모델을 분석한 결과, RAB7은 초기 유도 흑색종 드라이버로, 종양 침투를 선호하도록 수준을 조정할 수 있으며, 궁극적으로 전이 위험을 정의한다.중요한 것은, RAB7 수준과 기능이 MITF와는 독립적이었으며, 대신 신경계피 마스터 모듈레이터 SOX10과 종양종 MYC는 핵심 RAB7a 규제 기관이다.[22]
샤르코 마리 투트 2B
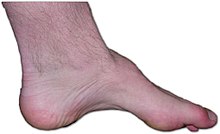
샤르코-마리-로도 알려져 있다.치아 신경증, 유전적 운동 및 감각 신경증(HMSN), 과립 근위축증(PMA)이다.이는 유전적으로나 임상적으로 이질적인 유전적 질환 집단으로 발가락이나 발의 심한 궤양성 교란과 가변적 운동 개입으로 인해 종종 복잡하고 두드러진 감각 손실로 특징지어진다.[23][24]작은 GTPase Rab7을 인코딩하는 유전자인 Rab7A에서의 Missense 돌연변이는 CMT2B를 유발하고 Rab7의 활동을 증가시킨다.Rab7은 보편적으로 표현되며 라이소솜 경로를 통한 열화에 관여한다.현재 불치병인 이 병은 2500명 중 1명꼴로 영국에서 약 23,000명, 미국에서 125,000명에 이르는 사람들에게 영향을 미치는 가장 흔한 유전적 신경 질환 중 하나이다.CMT는 이전에 근위축증의 하위 유형으로 분류되었다.[25]
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG000075785 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000079477 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b Davies JP, Cotter PD, Ioannou YA (Apr 1997). "Cloning and mapping of human Rab7 and Rab9 cDNA sequences and identification of a Rab9 pseudogene". Genomics. 41 (1): 131–4. doi:10.1006/geno.1997.4644. PMID 9126495.
- ^ a b Kashuba VI, Gizatullin RZ, Protopopov AI, Allikmets R, Korolev S, Li J, Boldog F, Tory K, Zabarovska V, Marcsek Z, Sumegi J, Klein G, Zabarovsky ER, Kisselev L (Dec 1997). "NotI linking/jumping clones of human chromosome 3: mapping of the TFRC, RAB7 and HAUSP genes to regions rearranged in leukemia and deleted in solid tumors". FEBS Letters. 419 (2–3): 181–5. doi:10.1016/S0014-5793(97)01449-X. PMID 9428630. S2CID 10164824.
- ^ a b "RAB7A Genetics Home Reference". U.S. National Library of Medicine. Retrieved 21 October 2014.
- ^ Auer-Grumbach M (March 2008). "Hereditary sensory neuropathy type I". Orphanet Journal of Rare Diseases. 3 (7): 7. doi:10.1186/1750-1172-3-7. PMC 2311280. PMID 18348718.
- ^ "Entrez Gene: RAB7A RAB7A, member RAS oncogene family".
- ^ Verhoeven K, De Jonghe P, Coen K, Verpoorten N, Auer-Grumbach M, Kwon JM, FitzPatrick D, Schmedding E, De Vriendt E, Jacobs A, Van Gerwen V, Wagner K, Hartung HP, Timmerman V (Mar 2003). "Mutations in the small GTP-ase late endosomal protein RAB7 cause Charcot-Marie-Tooth type 2B neuropathy". American Journal of Human Genetics. 72 (3): 722–727. doi:10.1086/367847. PMC 1180247. PMID 12545426.
- ^ Vitelli R, Chiariello M, Lattero D, Bruni CB, Bucci C (Dec 1996). "Molecular cloning and expression analysis of the human Rab7 GTP-ase complementary deoxyribonucleic acid". Biochemical and Biophysical Research Communications. 229 (3): 887–890. doi:10.1006/bbrc.1996.1897. PMID 8954989.
- ^ Davies JP, Cotter PD, Ioannou YA (Apr 1997). "Cloning and mapping of human Rab7 and Rab9 cDNA sequences and identification of a Rab9 pseudogene". Genomics. 41 (1): 131–134. doi:10.1006/geno.1997.4644. PMID 9126495.
- ^ Edinger AL, Cinalli RM, Thompson CB (Oct 2003). "Rab7 prevents growth factor-independent survival by inhibiting cell-autonomous nutrient transporter expression". Developmental Cell. 5 (4): 571–82. doi:10.1016/s1534-5807(03)00291-0. PMID 14536059.
- ^ Cantalupo G, Alifano P, Roberti V, Bruni CB, Bucci C (Feb 2001). "Rab-interacting lysosomal protein (RILP): the Rab7 effector required for transport to lysosomes". The EMBO Journal. 20 (4): 683–93. doi:10.1093/emboj/20.4.683. PMC 145419. PMID 11179213.
- ^ Caplan S, Hartnell LM, Aguilar RC, Naslavsky N, Bonifacino JS (Jul 2001). "Human Vam6p promotes lysosome clustering and fusion in vivo". The Journal of Cell Biology. 154 (1): 109–22. doi:10.1083/jcb.200102142. PMC 2196876. PMID 11448994.
- ^ Rak A, Pylypenko O, Niculae A, Goody RS, Alexandrov K (Jan 2003). "Crystallization and preliminary X-ray diffraction analysis of monoprenylated Rab7 GTPase in complex with Rab escort protein 1". Journal of Structural Biology. 141 (1): 93–5. doi:10.1016/S1047-8477(02)00634-2. PMID 12576024.
- ^ Alexandrov K, Simon I, Iakovenko A, Holz B, Goody RS, Scheidig AJ (Apr 1998). "Moderate discrimination of REP-1 between Rab7 x GDP and Rab7 x GTP arises from a difference of an order of magnitude in dissociation rates". FEBS Letters. 425 (3): 460–4. doi:10.1016/S0014-5793(98)00290-7. PMID 9563513. S2CID 39125409.
- ^ Wu M, Wang T, Loh E, Hong W, Song H (Apr 2005). "Structural basis for recruitment of RILP by small GTPase Rab7". The EMBO Journal. 24 (8): 1491–1501. doi:10.1038/sj.emboj.7600643. PMC 1142575. PMID 15933719.
- ^ Wang T, Wong KK, Hong W (Feb 2004). "A unique region of RILP distinguishes it from its related proteins in its regulation of lysosomal morphology and interaction with Rab7 and Rab34". Molecular Biology of the Cell. 15 (2): 815–826. doi:10.1091/mbc.E03-06-0413. PMC 329395. PMID 14668488.
- ^ Uusi-Rauva K, Kyttälä A, van der Kant R, Vesa J, Tanhuanpää K, Neefjes J, Olkkonen VM, Jalanko A (Jun 2012). "Neuronal ceroid lipofuscinosis protein CLN3 interacts with motor proteins and modifies location of late endosomal compartments". Cellular and Molecular Life Sciences. 69 (12): 2075–2089. doi:10.1007/s00018-011-0913-1. PMID 22261744. S2CID 5733226.
- ^ Rojas R, van Vlijmen T, Mardones GA, Prabhu Y, Rojas AL, Mohammed S, Heck AJ, Raposo G, van der Sluijs P, Bonifacino JS (Nov 2008). "Regulation of retromer recruitment to endosomes by sequential action of Rab5 and Rab7". The Journal of Cell Biology. 183 (3): 513–26. doi:10.1083/jcb.200804048. PMC 2575791. PMID 18981234.
- ^ a b Alonso-Curbelo D, Riveiro-Falkenbach E, Pérez-Guijarro E, Cifdaloz M, Karras P, Osterloh L, Megías D, Cañón E, Calvo TG, Olmeda D, Gómez-López G, Graña O, Sánchez-Arévalo Lobo VJ, Pisano DG, Wang HW, Ortiz-Romero P, Tormo D, Hoek K, Rodríguez-Peralto JL, Joyce JA, Soengas MS (Jul 2014). "RAB7 controls melanoma progression by exploiting a lineage-specific wiring of the endolysosomal pathway". Cancer Cell. 26 (1): 61–76. doi:10.1016/j.ccr.2014.04.030. PMID 24981740.
- ^ "Physical Medicine and Rehabilitation for Charcot-Marie-Tooth Disease". Medscape. Retrieved 4 November 2014.
- ^ Krajewski KM, Lewis RA, Fuerst DR, Turansky C, Hinderer SR, Garbern J, Kamholz J, Shy ME (Jul 2000). "Neurological dysfunction and axonal degeneration in Charcot-Marie-Tooth disease type 1A". Brain. 123 (7): 1516–27. doi:10.1093/brain/123.7.1516. PMID 10869062.
- ^ Janssens K, Goethals S, Atkinson D, Ermanoska B, Fransen E, Jordanova A, Auer-Grumbach M, Asselbergh B, Timmerman V (May 2014). "Human Rab7 mutation mimics features of Charcot-Marie-Tooth neuropathy type 2B in Drosophila". Neurobiology of Disease. 65: 211–9. doi:10.1016/j.nbd.2014.01.021. PMID 24521780. S2CID 140204654.