리튬공기전지
Lithium–air battery| 비중에너지 | 40.104 MJ/kg (11,140 Wh/kg) 이론 |
|---|---|
| 에너지 밀도 | ? J/m |
| 비전력 | 11,400W/kg |
| 공칭 셀 전압 | 2.91V |
리튬-공기 전지(Li-air)는 금속-공기 전기화학 전지 또는 배터리 화학 물질로 양극에서 리튬의 산화 및 음극에서 산소의 환원을 사용하여 전류 흐름을 유도합니다.[1]
리튬과 주변 산소를 쌍으로 만들면 이론적으로 가능한 최고의 특정 에너지를 가진 전기화학 전지로 이어질 수 있습니다. 실제로, LiO 제품으로 충전된 상태에서 산소 질량을 제외한 비수계 Li-공기 전지의 이론적 비에너지는 ~40.1 MJ/kg = 11.14 kWh/kg의 리튬입니다. 이는 휘발유의 이론적 비중 에너지인 ~46.8 MJ/kg과 유사합니다. 실제로 셀 레벨에서 ~6.12 MJ/kg = 1.7 kWh/kg의 리튬의 특정 에너지를 갖는 Li-air 배터리가 시연되었습니다. 이는 상용 리튬 이온 배터리의 약 5배에 달하며, 리튬 60 kg(즉, 20.4 kWh/100 km)을 사용하여 1회 충전으로 2,000 kg 전기 자동차를 ~500 km(310 마일) 주행할 수 있는 양입니다. 그러나 Li-공기 배터리의 실용적인 전력과 사이클 수명은 시장의 틈새 시장을 찾기 위해서는 상당한 개선이 필요합니다.
상업적 구현을 개발하기 위해서는 상당한 전해질 발전이 필요합니다.[2] 비양성자성,[3][4][5] 수성,[6] 고체[7] 상태 및 혼합 수성-비양성자성의 네 가지 접근법이 고려되고 있습니다.[8]
배터리의 주요 시장 동인은 자동차 부문입니다. 가솔린의 에너지 밀도는 약 13kW·h/kg으로 손실 후 휠에 제공되는 에너지 1.7kW·h/kg에 해당합니다. 이론적으로 리튬-공기는 산소 질량을 제외한 12kW·h/kg(43.2 MJ/kg)을 달성할 수 있습니다. 전체 배터리 팩(케이스, 공기 채널, 리튬 기판)의 무게를 고려할 때, 리튬 단독은 매우 가볍지만 에너지 밀도는 상당히 낮습니다.[9]
역사
1970년대에 배터리 전기 자동차와 하이브리드 전기 자동차의 가능한 전력원으로 처음 제안된 Li-air 배터리는 재료 과학의 발전으로 인해 2000년대의 첫 10년 후반에 과학적 관심을 다시 얻었습니다.
리튬-공기 배터리에 대한 아이디어는 1996년 훨씬 이전부터 있었지만,[10][11][12][13] 위험 대비 이익 비율은 추구하기에 너무 높은 것으로 인식되었습니다. 실제로, 각각 음극(리튬 금속)과 양극(공기 또는 산소) 전극이 1970년대에 재충전 가능한 리튬-금속 배터리가 시장에 출시되지 못한 이유입니다(모바일 기기의 리튬-이온 배터리는 리튬 금속이 아닌 음극에 LiC-흑연6 화합물을 사용합니다). 그럼에도 불구하고, 고에너지 충전 배터리에 대한 다른 대안이 부족하다는 인식과 학술 실험실의 초기 유망한 결과로 [10][11]인해 2006년부터 리튬-산소(Li-air 포함) 배터리와 관련된 특허 수와 자유 영역 출판물 수가 기하급수적으로 증가하기 시작했습니다.[14][11] 그러나 이러한 배터리, 특히 재충전 시간, 질소 및 물 민감도, 충전된22 LiO 종의 본질적인 불량한 전도도 등이 주요 과제입니다.[16]
설계 및 운영

일반적으로 리튬 이온은 전해질을 가로질러 양극과 음극 사이를 이동합니다. 방전 시 전자는 외부 회로를 따라 전기 작업을 수행하고 리튬 이온은 음극으로 이동합니다. 리튬 금속판을 양극에 충전하는 동안 음극에서 O를
2 분리합니다.[17] 비수성[18](LiO22 또는 LiO를2 방전 생성물로 사용) 및 수성(LiOH를 방전 생성물로 사용) Li-O2 전지가 모두 고려되었습니다.[19][20] 수성 배터리는 Li 금속이 물과 반응하지 않도록 음극에 보호층이 필요합니다.
양극

리튬 금속은 전형적인 양극 선택입니다. 양극에서 전기화학적 전위는 리튬 금속이 산화를 통해 전자를 방출하도록 합니다(음극 산소를 포함하지 않음). 반작용은 다음과 같습니다.[21]
- 리 ⇌ 리 + e
리튬은 다른 금속-공기 전지 재료(아연의 경우 820 mAh/g, 알루미늄의 경우 2,965 mAh/g)에 비해 높은 비용량(3,840 mAh/g)을 가지고 있습니다.[22] 몇 가지 문제가 이러한 세포에 영향을 미칩니다. 양극 개발의 주요 과제는 양극이 전해질과 반응하는 것을 방지하는 것입니다. 대안으로는 새로운 전해질 재료를 사용하거나 전해질과 음극 사이의 계면을 재설계하는 것이 있습니다. 리튬 양극은 수지상 리튬 침전물이 발생하여 에너지 용량이 감소하거나 단락을 유발할 위험이 있습니다.[23] 기공 크기와 기공 크기 분포의 효과는 잘 알려져 있지 않습니다.[22]
비양성자성 전지에서 충방전 시, 리튬 염의 층들이 양극 상으로 침전되고, 결국 이를 덮고 리튬과 전해질 사이에 장벽을 형성합니다. 이 장벽은 처음에는 부식을 방지하지만 결국 양극과 전해질 사이의 반응 역학을 억제합니다.[24] 고체-전해질 계면(SEI)의 이러한 화학적 변화는 표면 전체의 화학적 조성을 변화시켜 전류를 그에 따라 변화시킵니다. 불균일한 전류 분포는 덴드라이트 성장을 분기시키고 일반적으로 양극과 음극 사이의 단락으로 이어집니다.[25]
SEI에서 수성 셀 문제는 리튬 금속과 물의 높은 반응성에서 비롯됩니다.[26]
다음과 같은 문제를 극복하기 위한 몇 가지 접근 방식이 있습니다.
- 디- 및 트리블록 공중합체 전해질을 이용한 Li-이온 보호층 형성 [27]방법 Seeo, Inc.[27]에 따르면, 이러한 전해질(예를 들어, 폴리(에틸렌 옥사이드(PEO) 및 Li-염 혼합물)과 같은 연질 폴리머 세그먼트의 높은 Li-이온 전도도를 갖는 폴리스티렌)은 연질 폴리머-리튬-염 혼합물의 높은 이온 전도도와 경질 폴리머 세그먼트의 기계적 안정성을 결합합니다. 경도는 기계적 차단을 통해 덴드라이트 쇼트를 억제합니다.
- 리튬 금속에 의해 Li-이온 전도성 유리 또는 유리-세라믹 재료는[7][28][29] (일반적으로) 쉽게 환원되므로, LiP 또는 LiN과 같은
3 안정적인
3 리튬 전도성 재료의 박막이 세라믹과 금속 사이에 삽입될 수 있습니다. 세라믹 기반의 이 SEI는 덴드라이트의 형성을 억제하고 대기 오염으로부터 리튬 금속을 보호합니다.
음극
충전 중 음극에서 산소는 환원을 통해 리튬에 전자를 기증합니다. 메조다공성 탄소는 환원 역학을 향상시키고 음극의 비용량을 증가시키는 금속 촉매를[30] 갖는 음극 기판으로 사용되어 왔습니다.[31] 망간, 코발트, 루테늄, 백금, 은 또는 코발트와 망간의 혼합물이 잠재적인 금속 촉매입니다. 어떤 환경에서는 망간 촉매 음극이 가장 잘 수행되었으며, 비용량이 3,137 mA·H/g인 탄소와 코발트 촉매 음극이 2414 mA·H/g 탄소로 두 번째로 잘 수행되었습니다.[32] 리튬-공기 전지의 첫 번째 기공-스케일 모델링을 기반으로, 음극의 미세 구조는 비기공-차단 및 기공-차단 체제 모두에서 배터리 용량에 상당한 영향을 미칩니다.[33]
대부분의 Li-공기 배터리 한계는 음극에 있으며, 이는 잠재적인 이점의 원천이기도 합니다. 공기극에는 대기 산소가 존재해야 하지만 수증기 등 오염물질이 손상될 수 있습니다.[4] (비양성자 설계로) 리튬 과산화물과 같은 방전 생성물로 다공성 탄소 음극이 막혀서 불완전 방전이 가장 심각합니다.
촉매는 리튬과 관련하여 비가역적인 LiO보다
2 LiO의
2
2 우선적인 핵 생성을 가능성을 보여주었습니다.[34]
Li-공기 성능은 대부분의 전압 강하가 음극에서 일어나기 때문에 음극에서의 반응 효율에 의해 제한됩니다.[22] 전해질로 구별되는 여러 화학 물질이 평가되었습니다. 이 논의는 고체 전기화학에 대한 이해가 부족하기 때문에 비양성자성 및 수성 전해질에 초점을 맞추고 있습니다.
비양성자성 전해질이 있는 셀에서는 음극에서 환원을 통해 리튬 산화물이 생성됩니다.
- Li+ + e− +O
2 + * → LiO
2* - Li+ + e− +LiO
2* →Li
2O
2*
여기서 "*"는 성장이 진행되는 LiO의
2
2 표면 부위를 의미하며, 이는 본질적으로 LiO
2
2 표면의 중성 Li 빈 공간입니다.
리튬 산화물은 비양성자성 전해질에 불용성이며, 이는 음극 막힘으로 이어집니다.[35]
유전자 변형 M13 박테리오파지 바이러스에 의해 증강된 MnO
2 나노와이어 어레이 캐소드는 2015년형 리튬이온 배터리의 2~3배의 에너지 밀도를 제공합니다. 바이러스는 가로 약 80nm인 나노와이어 배열의 크기를 키웠습니다. 결과로 나온 와이어는 스파이크 표면을 가지고 있었습니다. 스파이크는 반응 부위를 숙주하기 위해 더 많은 표면적을 만듭니다. 바이러스 프로세스는 고립된 와이어가 아닌 교차 연결된 3D 구조를 만들어 전극을 안정화시킵니다. 바이러스 과정은 수성이며 실온에서 이루어집니다.[36][37]
전해질
Li-공기 전지에서의 노력은 수성 산성, 수성 알칼리성, 비수성 양성 및 비양성자성의 네 가지 전해질에 초점을 맞추었습니다.
수성 전해질이 있는 전지에서는 음극에서 환원이 수산화리튬을 생성할 수도 있습니다.
수성
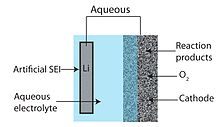
수성 Li-공기 전지는 리튬 금속 양극, 수성 전해질 및 다공성 탄소 음극으로 구성됩니다. 수성 전해질은 물에 용해된 리튬염을 결합합니다. 반응 생성물이 수용성이기 때문에 음극 막힘 문제를 방지합니다.[6] 수성 설계는 비양성자성 설계보다 더 높은 실용적인 방전 전위를 가지고 있습니다. 그러나 리튬 금속은 물과 격렬하게 반응하므로 수성 설계에는 리튬과 전해질 사이의 고체 전해질 계면이 필요합니다. 일반적으로 리튬 전도성 세라믹 또는 유리를 사용하지만 전도성은 일반적으로 낮습니다(주변 온도에서 10−3 S/cm 정도).[26]
산성 전해질
- 2Li + ½ O
2 + 2H+ → 2Li++ H
2O
결합염기가 반응에 관여합니다. 이론적으로 최대 Li-공기전지 비에너지 및 에너지 밀도는 각각 1,400 W·h/kg 및 1,680 W·h/L입니다.[9]
알칼리성 수성 전해질
- 2Li + ½ O
2 + H
2O → 2LiOH
공기 음극에서 물 분자는 산화 환원 반응에 관여합니다. 이론적으로 최대 Li-공기전지 비에너지 및 에너지 밀도는 각각 1,300 W·h/kg 및 1,520 W·h/L입니다.[9]
새로운 양극 재료는 음극 기공을 차단하고 적절한 촉매를 사용하여 전기 화학 반응을 에너지적으로 실용적으로 만드는 일 없이 상당한 양의
2 LiO
2
2, LiO 및/또는 LiOH를 수용하는 것을 고려해야 합니다.
- 이중 기공 시스템 소재는 가장 유망한 에너지 용량을 제공합니다.[38]
- 첫 번째 포어 시스템은 산화 제품 저장소 역할을 합니다.
- 두 번째 기공 시스템은 산소 운반 역할을 합니다.
비양성자

비수성 Li-공기 전지를 먼저 시연했습니다.[10] 일반적으로 에틸렌 카보네이트+ 프로필렌 카보네이트 용매를 LiPF6 또는 Libis-설폰이미드 염과 혼합하여 사용하지만, 액체 전해질이 아닌 겔화된 리튬 이온 배터리를 사용합니다.[20] 정전류 충전 및 방전 시 전압 차이는 양극의 0.01~0.5mA/cm² 및 50~500mA/g의 C와 같은 터무니없이 낮은 전류에서도 일반적으로 1.3~1.8V(OCP 약 4.2V)[19][18][39]이지만 충전 시 높은 과전압으로 인해 탄산염 용매가 증발하고 산화됩니다(그림 2 참조).[40] 말단 캡 글리세롤, DMSO, 디메틸아세트아미드 및 이온성 액체와 같은 다른 용매가 고려되었습니다.[19][20] 충전 시 탄소 음극이 +3.5 V vLi 이상으로 산화되어 LiCO가23 형성되고, 이는 비가역적인 용량 손실로 이어집니다.[20]
대부분의 노력에는 리튬 금속 양극, 액체 유기 전해질 및 다공성 탄소 음극으로 구성된 양성 물질이 포함되었습니다.[3] 전해질은 LiPF
6, LiAsF
6, LiN(SOCF
2
3),
2 LiSOCF
3
3 등의 리튬염을 용해시킬 수 있는 유기 액체라면 모두 가능하지만, 일반적으로 탄산염, 에테르 및 에스테르로 구성됩니다.[3][17] 탄소 음극은 일반적으로 나노 구조의 금속 산화물 촉매(일반적으로 MnO
2 또는 MnO
3
4)가 있는 높은 표면적의 탄소 물질로 구성됩니다. 리튬 금속이 전해액과 더 이상 반응하지 않도록 보호하는 음극과 전해액 사이의 장벽(기존의 Li-ion 배터리에서 전해액과 탄소-리튬 양극 사이에 형성된 장벽과 유사)이 자발적으로 형성되는 것이 주요 장점입니다. 재충전이 가능하지만,[9] 음극에서 생성된
2
2 LiO는 일반적으로 유기 전해질에 불용성이며, 이로 인해 음극/전해질 계면을 따라 축적됩니다. 이로 인해 비양성자 배터리의 음극이 막히고 부피가 팽창하기 쉬우므로 전도성이 점진적으로 감소하고 배터리 성능이 저하됩니다.[6][26][41] 또 다른 문제는 유기 전해질이 가연성이고 셀이 손상되면 발화할 수 있다는 것입니다.[7]
비록 대부분의 연구들이 LiO가
2
2 비수계 Li-O2 전지의 최종 방전 생성물이라는 것에 동의하고 있지만, 과산화물 O로의2−
2 직접적인 2-전자 전기 환원이 아니라 과산화물2−
2 O로의 1-전자 환원을 통해 형성된다는 상당한 증거가 있습니다.
- 2LiO
2 ⇌ Li
2O
2+O
2(1)
과산화물(Superoxide, O−
2)은 전통적으로 높은 친핵성, 염기성 및 산화 환원 전위로[19][18] 인해 비양성자성 산소 배터리에서 위험한 중간체로 간주되어 왔습니다. 그러나, 보고서에[42][43] 따르면 LiO는2 과산화물(LiO
2
2)로 방전되는 동안 중간체이며 최종 방전 생성물로 사용될 수 있습니다. 비에너지는 낮지만(배터리 무게는 조금 더 무겁지만) 개선된 사이클 수명으로 잠재적입니다. 실제로 특정 조건에서 과산화물은 실온에서 20-70시간의 규모로 안정적일 수 있음을 보여주었습니다.[42] 충전된 배터리에서 LiO의2 불균형 시 비가역적 용량 손실은 해결되지 않았습니다.
LiO가
2
2 제품일 때 O2 진화에 Pt/C, O2 환원에 Au/C가 가장 좋은 전기 촉매인 것 같습니다.[44] 그럼에도 불구하고, "비수성 전해질을 사용하는 재충전 가능한 리튬-공기 배터리의 성능은 산소 전극에서의 반응, 특히2 O evolution에 의해 제한됩니다. 기존의 다공성 탄소 공기 전극은 전기차 용도에 매우 높은 에너지 밀도의 배터리에 필요한 크기로 mAh/g 및 mAh/cm2 용량과 방전 속도를 제공할 수 없습니다."[44] 비수계 Li-O2 전지의 용량(mAh/cm2 단위)과 사이클 수명은 방전 시 불용성이며 전자 전도성이 떨어지는 LiOx 상의 증착에 의해 제한됩니다.[19] (LiO는
3
4 LiO2 및 LiO
2
2 상보다 더 나은 Li+ 전도도를 가질 것으로 예측됩니다.)[45] 이를 통해 Li-O2 배터리의 실용적인 비에너지가 시약 수준 계산에서 예측한 것보다 훨씬 작습니다. 이러한 파라미터는 한계에 도달한 것으로 보이며, 대체 방법에 의해서만 추가적인 개선이 기대됩니다.
수성-비양성자 혼합물
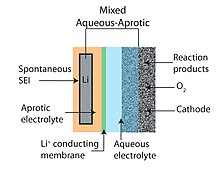
수성-비양성자 또는 혼합 Li-공기 배터리 설계는 비양성자 배터리 설계와 수성 배터리 설계의 장점을 통합하려고 시도합니다. 하이브리드 디자인의 공통적인 특징은 리튬 전도성 멤브레인으로 연결된 2부분(수성 1부분과 비양성자성 1부분) 전해질입니다. 음극은 음극이 수성 측과 접촉하는 동안 비양성자 측과 맞닿아 있습니다. 일반적으로 두 전해질을 연결하는 멤브레인은 리튬 전도성 세라믹을 사용합니다.[6][9]
리튬 금속 양극과 수성 양극을 결합할 수 있는 대안적인 접근법 중 하나는 고체 전해질(그림 3 참조)을 사용하는 것입니다.[46] NASICON 계열의 세라믹 고체 전해질(예: A ∈[Al, Sc, Y] 및 M ∈[Ti, Ge]를 갖는 LiAM(PO))이 연구되었습니다. 알칼리성 pH에서 물과 호환되고 큰 전기화학 창(그림 3,4 참조)을 갖는 이들의 낮은 Li+ 이온 전도도(< 0.005 S/cm, >85 ω cm)는 낮은 비용(즉, 100 mA/cm 이상의 동작 전류 밀도)을 요구하는 자동차 및 고정식 에너지 저장 애플리케이션에 적합하지 않습니다. 또한, Ti 및 Ge는 모두 금속 Li에 의해 환원되며, 세라믹 전극과 음극 사이의 중간층이 필요합니다. 대조적으로, 고체 고분자 전해질(SPE)은 물과 금속 Li에 반응하는 다른 작은 분자의 빠른 교차를 희생시키면서 더 높은 전도성을 제공할 수 있습니다. Li-O2 배터리에 고려되는 더 이색적인 막 중 하나는 단결정 실리콘입니다.[40]
2015년 연구원들은 양극에 다공성이 높은 그래핀을 사용한 디자인을 발표했는데, 리튬 비스(트리플루오로메틸)술포닐이미드/디메톡시에탄의 전해질에 물을 첨가하고 요오드화리튬을 "매개체"로 사용했습니다. 전해질은 과산화리튬(LiO
2
2) 대신 음극에서 수산화리튬(LiOH)을 생성합니다. 그 결과 93%의 에너지 효율(전압 갭 0.2)을 제공하고 출력에 거의 영향을 주지 않으면서 2,000회 이상 사이클링했습니다.[47][48] 그러나 디자인에는 주변 공기가 아닌 순수한 산소가 필요했습니다.[49]
솔리드 스테이트

솔리드 스테이트 배터리 설계는 파열로 인한 점화 가능성을 제거하여 안전성이 매력적입니다.[7] 현재의 전고체 Li-공기 전지는 리튬 음극, 세라믹, 유리 또는 유리-세라믹 전해질, 다공성 탄소 음극을 사용합니다. 일반적으로, 양극과 음극은 양극에서 전하 전달을 향상시키고 음극을 전해질에 전기화학적으로 결합시키는 폴리머-세라믹 복합체에 의해 전해질로부터 분리된다. 폴리머-세라믹 복합재는 전체 임피던스를 감소시킵니다. 전고체 배터리 설계의 주요 단점은 대부분의 유리 세라믹 전해질의 낮은 전도도입니다. 현재 리튬 고속 이온 전도체의 이온 전도도는 액체 전해질 대체 물질보다 낮습니다.[50]
과제들
2013년 현재, 디자이너들은 많은 도전에 직면해 있습니다.
음극
대부분의 Li-공기 배터리 한계는 음극에 있으며, 이는 잠재적인 이점의 원천이기도 합니다. (비양성자 설계로) 리튬 과산화물과 같은 방전 생성물로 다공성 탄소 음극이 막혀서 불완전 방전이 가장 심각합니다. 침전물의 여러 모드가 모델링되었습니다.[51] 온도, 종 농도 및 잠재력의 변화를 측정하기 위해 매개변수 Da를 정의했습니다.[52][53]
기공 크기와 기공 크기 분포의 효과는 잘 알려져 있지 않습니다.[22]
촉매는 리튬과 관련하여 비가역적인 LiO보다
2 LiO의
2
2 우선적인 핵 생성을 가능성을 보여주었습니다.[34]
공기극에는 대기 산소가 존재해야 하지만 수증기 등 오염물질이 손상될 수 있습니다.[4]
전기화학
2017년 셀 설계에서 전하 과전위는 방전 과전위보다 훨씬 높습니다. 전하 과잉 전위가 크면 2차 반응이 있음을 나타냅니다.[54] 따라서 전기 효율은 약 65%[22]에 불과합니다.
MnO
2, Co, Pt 및 Au와 같은 촉매는 잠재적으로 과잉 전위를 감소시킬 수 있지만 그 효과는 잘 알려져 있지 않습니다.[34] 몇몇 촉매들은 음극 성능, 특히 MnO를 향상시키며
2, 개선 메커니즘은 리튬 과산화물의 풍부한 초기 성장 사이트를 제공하는 표면 산소 산화물(surface oxygen redox)로 알려져 있습니다.[55] 또한 촉매가 산화물 퇴적물의 구조를 변화시킬 수 있다는 보고도 있습니다.[56][57]
방전 속도가 증가함에 따라 셀 용량이 크게 감소하는 것도 문제입니다. 세포 용량의 감소는 운동 전하 전달 한계에 기인합니다.[22] 양극 반응은 매우 빠르게 일어나기 때문에 전하 전달 한계는 음극에서 발생하는 것으로 생각됩니다.
안정성.
장기간 배터리 작동을 위해서는 모든 셀 구성 요소의 화학적 안정성이 필요합니다. 현재의 셀 설계는 반응 생성물과 중간체에 의한 산화에 대한 저항성이 좋지 않습니다. 많은 수성 전해질은 휘발성이며 시간이 지남에 따라 증발할 수 있습니다.[22] 일반적으로 기생 화학 반응, 예를 들어 활성 산소와 관련된 반응은 안정성을 저해합니다.[58][59]
적용들
차량
Li-공기 전지는 가솔린과 유사한 높은 이론적 비중과 체적 에너지 밀도 때문에 전기 자동차에 관심이 있습니다. 전기 모터는 높은 효율(내연 엔진의 경우 35%에 비해 95%)을 제공합니다. Li-공기 전지는 배터리를 유지하는 데 필요한 발전소의 균형이 무시할 정도의 질량이나 부피라고 가정할 때, 표준 연료 탱크의 3분의 1 크기의 배터리 팩을 갖춘 오늘날의 차량과 동등한 범위를 제공할 수 있습니다.[citation needed]
그리드 백업
2014년, 연구원들은 하이브리드 태양 전지 배터리를 발표했습니다. 기존 태양 전지가 생산하는 에너지의 최대 20%가 배터리로 이동하고 충전하면서 손실됩니다. 하이브리드는 생산된 에너지의 거의 100%를 저장합니다. 하이브리드의 한 버전은 칼륨-공기를 사용하는 칼륨-이온 배터리를 사용했습니다. 기존의 Li-ion 배터리보다 높은 에너지 밀도를 제공하고 비용이 적게 들며 독성 부산물을 방지했습니다. 최신 장치는 본질적으로 칼륨 대신 리튬을 대체했습니다.[60]
태양 전지는 필요한 산소가 통과할 수 있도록 이산화티타늄의 미세한 막대로 만들어진 그물망을 사용했습니다. 포착된 햇빛은 과산화리튬을 리튬 이온으로 분해하는 전자를 생성하여 배터리를 충전합니다. 방전하는 동안 공기의 산소가 과산화리튬을 보충했습니다.[60]
참고 항목
참고문헌
- ^ Badwal, Sukhvinder P. S.; Giddey, Sarbjit S.; Munnings, Christopher; Bhatt, Anand I.; Hollenkamp, Anthony F. (24 September 2014). "Emerging electrochemical energy conversion and storage technologies". Frontiers in Chemistry. 2: 79. Bibcode:2014FrCh....2...79B. doi:10.3389/fchem.2014.00079. PMC 4174133. PMID 25309898.
- ^ Christensen, J.; Albertus, P.; Sanchez-Carrera, R. S.; Lohmann, T.; Kozinsky, B.; Liedtke, R.; Ahmed, J.; Kojic, A. (2012). "A Critical Review of Li–Air Batteries". Journal of the Electrochemical Society. 159 (2): R1. doi:10.1149/2.086202jes.
- ^ a b c Younesi, Reza; Veith, Gabriel M.; Johansson, Patrik; Edström, Kristina; Vegge, Tejs (2015). "Lithium salts for advanced lithium batteries: Li–metal, Li–O 2, and Li–S". Energy Environ. Sci. 8 (7): 1905–1922. doi:10.1039/c5ee01215e.
- ^ a b c Ogasawara, T.; Débart, A. L.; Holzapfel, M.; Novák, P.; Bruce, P. G. (2006). "Rechargeable Li2O2Electrode for Lithium Batteries". Journal of the American Chemical Society. 128 (4): 1390–1393. doi:10.1021/ja056811q. PMID 16433559.
- ^ Debart, A; Bao, J; et al. (2008). "α-MnO
2 Nanowires: A Catalyst for theO
2 Electrode in Rechargeable Lithium Batteries". Angew. Chem. 47 (24): 4521–4524. doi:10.1002/anie.200705648. PMID 18461594. - ^ a b c d He, P.; Wang, Y.; Zhou, H. (2010). "A Li–air fuel cell with recycle aqueous electrolyte for improved stability". Electrochemistry Communications. 12 (12): 1686–1689. doi:10.1016/j.elecom.2010.09.025.
- ^ a b c d Kumar, B.; Kumar, J.; Leese, R.; Fellner, J. P.; Rodrigues, S. J.; Abraham, K. M. (2010). "A Solid-State, Rechargeable, Long Cycle Life Lithium–Air Battery". Journal of the Electrochemical Society. 157: A50. doi:10.1149/1.3256129. S2CID 92403112.
- ^ Wang, Yonggang (2010). "A lithium–air battery with a potential to continuously reduce O2 from air for delivering energy". Journal of Power Sources. 195 (1): 358–361. Bibcode:2010JPS...195..358W. doi:10.1016/j.jpowsour.2009.06.109.
- ^ a b c d e Girishkumar, G.; McCloskey, B.; Luntz, A. C.; Swanson, S.; Wilcke, W. (2010). "Lithium−Air Battery: Promise and Challenges". The Journal of Physical Chemistry Letters. 1 (14): 2193–2203. doi:10.1021/jz1005384.
- ^ a b c 에이브러햄 & 장 1996
- ^ a b c 루 앤 아민 2013
- ^ 발라이스, 크라이트스버그 & 아인-엘리 2014
- ^ Lu, Li et al. 2014
- ^ Ogasawara, Debart et al. 2006
- ^ Lee, Roev et al. 2015
- ^ Gallagher, KG; Goebel, S; Greszler, T; Mathias, M.; Oelerich, W; Eroglu, D. (2014). "Quantifying the promise of lithium–air batteries for electric vehicles". Energy and Environmental Science. 7 (5): 1555–1563. doi:10.1039/C3EE43870H.
- ^ a b Xu, K. (2004). "Nonaqueous Liquid Electrolytes for Lithium-Based Rechargeable Batteries". Chemical Reviews. 104 (10): 4303–417. doi:10.1021/cr030203g. PMID 15669157.
- ^ a b c McCloskey et al. 2015.
- ^ a b c d e 발라이스, 크레이츠버그 & 아인-엘리 2014.
- ^ a b c d e Imanishi et al. 2014.
- ^ Winter, M.; Brodd, R. J. (2004). "What Are Batteries, Fuel Cells, and Supercapacitors?". Chemical Reviews. 104 (10): 4245–4269. doi:10.1021/cr020730k. PMID 15669155.
- ^ a b c d e f g Kraytsberg, A.; Ein-Eli, Y. (2011). "Review on Li–air batteries—Opportunities, limitations and perspective". Journal of Power Sources. 196 (3): 886–893. Bibcode:2011JPS...196..886K. doi:10.1016/j.jpowsour.2010.09.031.
- ^ Tikekar, Mukul D.; Choudhury, Snehashis; Tu, Zhengyuan; Archer, Lynden A. (2016-09-08). "Design principles for electrolytes and interfaces for stable lithium-metal batteries". Nature Energy. 1 (9): 16114. Bibcode:2016NatEn...116114T. doi:10.1038/nenergy.2016.114. ISSN 2058-7546. S2CID 138881114.
- ^ Aurbach, D. (2000). "Review of selected electrode–solution interactions which determine the performance of Li and Li ion batteries". Journal of Power Sources. 89 (2): 206–218. Bibcode:2000JPS....89..206A. doi:10.1016/S0378-7753(00)00431-6.
- ^ Whittingham, M. S. (1976). "Electrical Energy Storage and Intercalation Chemistry". Science. 192 (4244): 1126–1127. Bibcode:1976Sci...192.1126W. doi:10.1126/science.192.4244.1126. PMID 17748676. S2CID 36607505.
- ^ a b c Kowalczk, I.; Read, J.; Salomon, M. (2007). "Li–air batteries: A classic example of limitations owing to solubilities". Pure and Applied Chemistry. 79 (5): 851. doi:10.1351/pac200779050851. S2CID 98144813.
- ^ a b 싱, M., 구르, I., 발사라, N.P. (2009) "고체 전해질 재료는 폴리머 처리 방법에 의해 제조 가능", 미국 특허 출원 #12271829.
- ^ Bates, J. (2000). "Thin-film lithium and lithium-ion batteries". Solid State Ionics (Submitted manuscript). 135 (1–4): 33–37. doi:10.1016/S0167-2738(00)00327-1.
- ^ 비스코, S; 니몬, Y. (2010) "활성 금속/수성 전기화학 전지 및 시스템", 미국 특허 #7645543.
- ^ 신에너지와 연료. 2011. 2011년 11월 20일 접속
- ^ 에드 위르겐 오 Besenhard, 배터리 재료 핸드북, New Your, Wiley-VCH, 1999, ISBN 3-527-29469-4.
- ^ Abraham, K. M.; Jiang, Z. (1996). "A Polymer Electrolyte-Based Rechargeable Lithium/Oxygen Battery". Journal of the Electrochemical Society. 143 (1): 1–5. Bibcode:1996JElS..143....1A. doi:10.1149/1.1836378. S2CID 96810495.
- ^ Andersen, Charles P.; Hu, Han; Qiu, Gang; Kalra, Vibha; Sun, Ying (2015). "Pore-Scale Transport Resolved Model Incorporating Cathode Microstructure and Peroxide Growth in Lithium–Air Batteries". J. Electrochem. Soc. 162 (7): A1135–A1145. doi:10.1149/2.0051507jes. S2CID 55640173.
- ^ a b c Lu, Yi-Chun (2010). "The Influence of Catalysts on Discharge and Charge Voltages of Rechargeable Li–Oxygen Batteries". Electrochemical and Solid-State Letters. 13 (6): A69. doi:10.1149/1.3363047. hdl:1721.1/79694. S2CID 16688473.
- ^ Read, J. (2002). "Characterization of the Lithium/Oxygen Organic Electrolyte Battery". Journal of the Electrochemical Society. 149 (9): A1190–A1196. Bibcode:2002JElS..149A1190R. doi:10.1149/1.1498256.
- ^ "Lithium–air batteries go viral for greater durability and performance". gizmag.com. 15 November 2013.
- ^ Oh, D.; Qi, J.; Lu, Y. C.; Zhang, Y.; Shao-Horn, Y.; Belcher, A. M. (2013). "Biologically enhanced cathode design for improved capacity and cycle life for lithium–oxygen batteries". Nature Communications. 4: 2756. Bibcode:2013NatCo...4.2756O. doi:10.1038/ncomms3756. PMC 3930201. PMID 24220635.
- ^ Williford, R. E.; Zhang, J. G. (2009). "Air electrode design for sustained high power operation of Li/air batteries". Journal of Power Sources. 194 (2): 1164–1170. Bibcode:2009JPS...194.1164W. doi:10.1016/j.jpowsour.2009.06.005.
- ^ Liu et al. 2016.
- ^ a b 루 앤 아민 2013.
- ^ Li, Xianglin; Faghri, Amir (2012). "Optimization of the Cathode Structure of Lithium–Air Batteries Based on a Two-Dimensional, Transient, Non-Isothermal Model". Journal of the Electrochemical Society. 159 (10): A1747–A1754. doi:10.1149/2.043210jes.
- ^ a b Zhai et al. 2015.
- ^ Lu et al. 2016.
- ^ a b Lu et al. 2010.
- ^ Shi, Xu & Zhao 2015.
- ^ Visco et al. 2004.
- ^ Delacey, Lynda (November 19, 2015). "More hurdles jumped on path to a practical lithium–air battery". www.gizmag.com. Retrieved 2015-12-03.
- ^ Liu, Tao; Leskes, Michal; Yu, Wanjing; Moore, Amy J.; Zhou, Lina; Bayley, Paul M.; Kim, Gunwoo; Grey, Clare P. (2015-10-30). "Cycling Li-O2 batteries via LiOH formation and decomposition". Science. 350 (6260): 530–533. arXiv:1805.03042. Bibcode:2015Sci...350..530L. doi:10.1126/science.aac7730. ISSN 0036-8075. PMID 26516278. S2CID 8780402.
- ^ "New design points a path to the 'ultimate' battery". phys.org. October 29, 2015. Retrieved 2015-12-03.
- ^ Kumar, B.; Kumar, J. (2010). "Cathodes for Solid-State Lithium–Oxygen Cells: Roles of Nasicon Glass-Ceramics". Journal of the Electrochemical Society. 157 (5): A611. doi:10.1149/1.3356988.
- ^ Y. Wang, 방전 퇴적물 형성 및 리튬-공기 배터리 성능에 미치는 영향, Electrochimica Acta 75 (2012) 239-246.
- ^ Y. Wang and S. C. Cho, 리튬-공기 배터리의 공기 음극 성능 분석, 전기화학회 저널, 160 (10) A1-A9 (2013)
- ^ Y. 왕, Z. Wang, H. Yuan 및 T. Li, Li-공기 배터리에서의 방전 산화물 저장 용량 및 전압 손실, Electrochimica Acta, 180 (2015) 382–393
- ^ Zhang, T.; Imanishi, N.; Shimonishi, Y.; Hirano, A.; Takeda, Y.; Yamamoto, O.; Sammes, N. (2010). "A novel high energy density rechargeable lithium/air battery". Chemical Communications (Submitted manuscript). 46 (10): 1661–1663. doi:10.1039/b920012f. PMID 20177608.
- ^ Zheng, Yongping; Song, Kyeongse; Jung, Jaepyeong; Li, Chenzhe; Heo, Yoon-Uk; Park, Min-Sik; Cho, Maenghyo; Kang, Yong-Mook; Cho, Kyeongjae (May 2015). "Critical Descriptor for the Rational Design of Oxide-Based Catalysts in Rechargeable Li–O Batteries: Surface Oxygen Density". Chemistry of Materials. 27 (9): 3243–3249. doi:10.1021/acs.chemmater.5b00056.
- ^ Darren Quick (5 April 2010). "Lithium–air batteries offer three times the energy density". Retrieved 5 Oct 2011.
- ^ Shimonishi, Y.; Zhang, T.; Imanishi, N.; Im, D.; Lee, D. J.; Hirano, A.; Takeda, Y.; Yamamoto, O.; Sammes, N. (2011). "A study on lithium/air secondary batteries—Stability of the NASICON-type lithium ion conducting solid electrolyte in alkaline aqueous solutions". Journal of Power Sources. 196 (11): 5128–5132. Bibcode:2011JPS...196.5128S. doi:10.1016/j.jpowsour.2011.02.023.
- ^ Yao, Xiahui; Dong, Qi; Cheng, Qingmei; Wang, Dunwei (2016). "Why Do Lithium-Oxygen Batteries Fail: Parasitic Chemical Reactions and Their Synergistic Effect". Angewandte Chemie International Edition. 55 (38): 11344–11353. doi:10.1002/anie.201601783. PMC 5113803. PMID 27381169.
- ^ 비양성자성 리튬의 충전 과정에서 단일항 산소 형성 –산소 배터리 J. Wandt, P. Jakes, J. Granwehr, H.A. Gasteiger, R.A. Eichel, Angew. 켐. Int. Ed. 2016, 128, 7006–7009. {doi: 10.1002/anie.201602142}}
- ^ a b Dimberuon, Peniel M. (October 28, 2014). "New Hybrid Solar Cell Battery Takes Aim at Solar Power's Energy Storage Problem". Singularity Hub. Retrieved 17 December 2016.
인용된 작품
- Balaish, Moran; Kraytsberg, Alexander; Ein-Eli, Yair (2014). "A critical review on lithium–air battery electrolytes". Physical Chemistry Chemical Physics. 16 (7): 2801. doi:10.1039/C3CP54165G.
- Imanishi, Nobuyuki; Matsui, Masaki; Takeda, Yasuo; Yamamoto, Osamu (2014). "Lithium Ion Conducting Solid Electrolytes for Aqueous Lithium-air Batteries". Electrochemistry. 82 (11): 938–945. doi:10.5796/electrochemistry.82.938.
- Liu, Bin; Xu, Wu; Yan, Pengfei; Sun, Xiuliang; Bowden, Mark E.; Read, Jeffrey; Qian, Jiangfeng; Mei, Donghai; Wang, Chong‐Min; Zhang, Ji‐Guang (January 2016). "Enhanced Cycling Stability of Rechargeable Li–O 2 Batteries Using High‐Concentration Electrolytes". Advanced Functional Materials. 26 (4): 605–613. doi:10.1002/adfm.201503697.
- Lu, Jun; Amine, Khalil (18 November 2013). "Recent Research Progress on Non-aqueous Lithium-Air Batteries from Argonne National Laboratory". Energies. 6 (11): 6016–6044. doi:10.3390/en6116016.
- Lu, Jun; Jung Lee, Yun; Luo, Xiangyi; Chun Lau, Kah; Asadi, Mohammad; Wang, Hsien-Hau; Brombosz, Scott; Wen, Jianguo; Zhai, Dengyun; Chen, Zonghai; Miller, Dean J.; Sub Jeong, Yo; Park, Jin-Bum; Zak Fang, Zhigang; Kumar, Bijandra; Salehi-Khojin, Amin; Sun, Yang-Kook; Curtiss, Larry A.; Amine, Khalil (January 2016). "A lithium–oxygen battery based on lithium superoxide". Nature. 529 (7586): 377–382. doi:10.1038/nature16484.
- Lu, Yi-Chun; Xu, Zhichuan; Gasteiger, Hubert A.; Chen, Shuo; Hamad-Schifferli, Kimberly; Shao-Horn, Yang (8 September 2010). "Platinum−Gold Nanoparticles: A Highly Active Bifunctional Electrocatalyst for Rechargeable Lithium−Air Batteries". Journal of the American Chemical Society. 132 (35): 12170–12171. doi:10.1021/ja1036572. hdl:1721.1/65124.
- McCloskey, Bryan D.; Burke, Colin M.; Nichols, Jessica E.; Renfrew, Sara E. (2015). "Mechanistic insights for the development of Li–O 2 battery materials: addressing Li 2 O 2 conductivity limitations and electrolyte and cathode instabilities". Chemical Communications. 51 (64): 12701–12715. doi:10.1039/C5CC04620C.
- Shi, L.; Xu, A.; Zhao, T. S. (2015). "Formation of Li 3 O 4 nano particles in the discharge products of non-aqueous lithium–oxygen batteries leads to lower charge overvoltage". Physical Chemistry Chemical Physics. 17 (44): 29859–29866. doi:10.1039/c5cp03886c.
- Visco, S. J.; Nimon, E.; Katz, B.; Jonghe, L. C. D.; Chu, M. Y. (2004). Abstract No. 53. The 12th International Meeting on Lithium Batteries Abstracts. Nara, Japan.
- Zhai, Dengyun; Lau, Kah Chun; Wang, Hsien-Hau; Wen, Jianguo; Miller, Dean J.; Lu, Jun; Kang, Feiyu; Li, Baohua; Yang, Wenge; Gao, Jing; Indacochea, Ernesto; Curtiss, Larry A.; Amine, Khalil (11 February 2015). "Interfacial Effects on Lithium Superoxide Disproportionation in Li-O 2 Batteries". Nano Letters. 15 (2): 1041–1046. doi:10.1021/nl503943z.
외부 링크
- 아르곤, 배터리 연구의 장을 열다 – 리튬 공기
- 휘발유를 배출하는 아르곤 첨단 배터리 연구 주행
- IBM Battery 500 프로젝트
- 폴리플러스 배터리 회사
- 주식회사 리션 리튬공기전지 설계
- 화학자들은 워털루 대학에서 재충전 가능한 리튬-산소 배터리를 개발하는 데 획기적인 진전을 이루었습니다.
- 이온성 액체를 포함하는 겔 폴리머 전해질을 기반으로 하는 준고체 충전형 리튬-산소 전지



