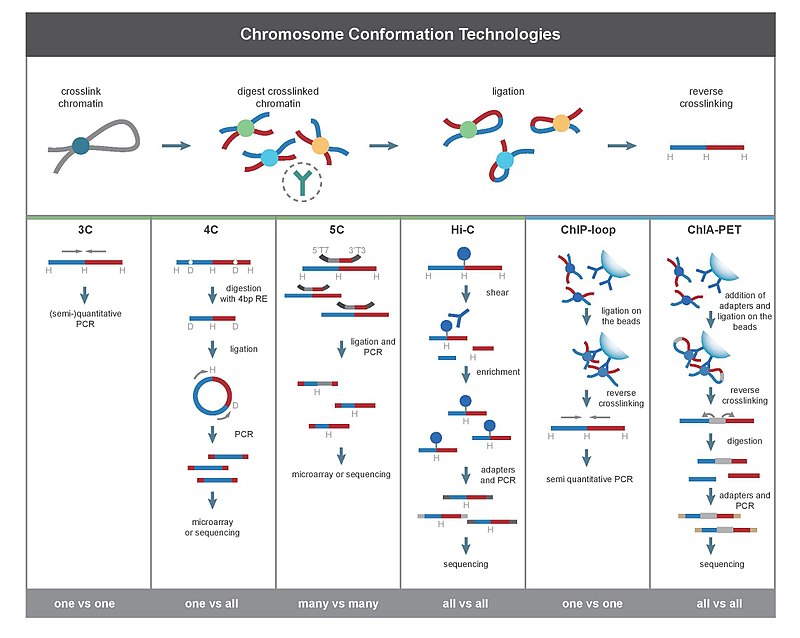
염색체 순응 포획
Chromosome conformation capture염색체 순응 포획 기술(흔히 3C 기술 또는 3C 기반 방법으로[1] 약칭)은 세포 내 염색질의 공간 구성을 분석하는 데 사용되는 분자생물학 방법의 집합이다. 이 방법들은 3-D 공간에서 근처에 있는 게놈 로키 사이의 상호작용 수를 정량화하지만 선형 게놈에서 많은 뉴클레오티드로 분리될 수 있다.[2] 그러한 상호작용은 촉진제-증진제 상호작용과 같은 생물학적 기능이나, 염색질의 간접적인 물리적 움직임이 로키를 충돌시키는 임의의 폴리머 루프에서 발생할 수 있다.[3] 상호작용 주파수는 직접 분석하거나 거리로 변환하여 3-D 구조 재구성에 사용할 수 있다.[4][5]
3C 기반 방법의 주요 차이점은 그 범위다. 예를 들어 PCR을 사용하여 3C 실험에서 상호작용을 검출할 때 두 특정 조각 사이의 상호작용을 정량화한다. 이와는 대조적으로 Hi-C는 가능한 모든 조각 쌍 사이의 상호작용을 동시에 계량한다. 3C에 의해 생산된 물질의 깊은 염기서열도 게놈 전체의 상호작용 지도를 만든다.
역사
역사적으로 현미경은 핵 조직을 조사하는 일차적인 방법이었는데,[6] 이는 1590년으로 거슬러 올라갈 수 있다.[7]
- 1879년, 발터 플레밍은 염색질이라는 용어를 만들었다.[8]
- 1883년, 어거스트 와이스만은 염색질과 유전자를 연결했다.
- 1884년 알브레히트 코셀은 히스톤을 발견했다.
- 1888년 서튼과 보베리는 세포 주기 동안 염색질의 연속성 이론을 제안했다.
- 1889년 빌헬름 폰 발데메이어는 "크로모솜"[10]이라는 용어를 만들었다.
- 1928년 에밀 하이츠는 헤테로크로마틴과 유로마틴이라는 용어를 만들었다.[11]
- 1942년 콘래드 와딩턴은 후생유전적 풍경을 가정했다.[12]
- 1948년에 롤린 하치키스는 DNA 메틸화를 발견했다.[13]
- 1953년에 왓슨과 크릭은 DNA의 이중나선 구조를 발견했다.[14]
- 1961년 메리 라이온은 X-비활성화의 원리를 가정했다.
- 1973/1974년, 염색질 섬유가 발견되었다.[12]
- 1975년에 피에르 챔본은 뉴클레오솜이라는 용어를 만들었다.[12]
- 1982년에 염색체 영역이 발견되었다.[15]
- 1984년, 존 T. Lis는 Chromatin 면역복구 기술을 혁신했다.
- 1993년에는 용해 중인 DNA의 원형화 빈도를 결정할 수 있는 방법인 Nuclear Lavigation Assay가 출판되었다. 이 분석은 에스트로겐이 프로락틴 유전자 촉진제와 근처의 증진제 사이의 상호작용을 유도한다는 것을 보여주기 위해 사용되었다.[16]
- 2002년에 잡 데커는 로키 사이의 상호작용 빈도의 밀도 매트릭스를 게놈의 공간적 구성을 유추하는 데 사용할 수 있다는 새로운 아이디어를 소개했다. 이 아이디어는 2002년 잡 데커와 하버드대 클렉너 연구실에서 동료들이 발표한 염색체 순응 포획(3C) 검사의 개발 근거가 됐다.[17][18]
- 2003년에 인간 게놈 프로젝트가 완성되었다.
- 2006년에 마리케 시모니스는 4C를 발명했고,[19] 도스티는 Dekker 연구소에서 5C를 발명했다.[20]
- 2007년, B. 프랭클린 푸그는 Chip-seq 기술을 혁신했다.[21]
- 2009년 에레즈 리버만 에이든과 욥 데커는 하이C,[22] 멜리사 J. 풀우드, 이쥔 룬은 치아-PET를 발명했다.[23]
- 2012년, The Ren 그룹과 Edith Hear와 Job Dekker가 이끄는 그룹은 포유류에서 TAD(Topology Association Domains)를 발견했다.[24][25]
- 2013년 나가노 다카시와 피터 프레이저는 하이C와 단세포 하이C를 위한 인뉴클레리 레깅스를 도입했다.[26]
- 2014년 수하스 라오, 미리암 헌틀리 외 연구진은 현장 Hi-C와 4-cutter 제한 효소의 사용을 개발했으며, 여러 인간 세포 라인에 대해 킬로바아제 분해능까지 낮춰 최초의 고해상도 데이터 세트를 출시했다. 그들은 또한 Hi-C 지도에서 CTCF-Cohesin 루핑의 첫 번째 명확한 증거를 식별하고 이러한 루프의 기초가 되는 수렴 CTCF 모티브 규칙을 식별했다.[27]
실험 방법
모든 3C 방법은 세포 샘플에 대해 수행되는 유사한 단계의 집합으로 시작한다.
첫째, 세포 게놈은 포름알데히드와 교차연계되는데,[28] 이것은 게놈 로키 사이의 상호작용을 "동결"시키는 결합을 도입한다. 상온에서 10~30분 동안 포름알데히드로 1~3% 포름알데히드로 세포를 치료하는 것이 가장 일반적이지만, 고단백-DNA 교차연결을 방지하기 위한 표준화가 필요한데, 이는 후속 단계에서 제한소화의 효율성에 부정적인 영향을 미칠 수 있기 때문이다.[29] 그리고 나서 게놈은 제한적인 엔도뉴클레스로 조각조각 잘라진다. 제한 조각의 크기는 상호작용 매핑의 분해능을 결정한다. EcoR1 또는 Hinder와 같이 6bp 인식 시퀀스를 절단하는 제한 효소(RE)III는 4000bp에 한번씩 게놈을 잘라내 인간 게놈에 100만개의 파편을 주기 때문에 이런 목적으로 사용된다.[29][30] 보다 정밀한 상호작용 매핑을 위해 RE를 인식하는 4bp를 사용할 수도 있다. 다음 단계는 근접성 기반 레깅입니다. 이는 낮은 DNA 농도에서 발생하거나 T4 DNA 리가아제가 존재하는 온전한 투과성[26] 핵 내에서 발생하며,[31] 교차 연계된 상호작용 단편들 간의 교합이 교차 연계가 되지 않는 파편들 사이의 교합보다 선호된다. 그 후 상호 작용하는 loci는 PCR 방법에 의해 결합 결합 결합을 증폭시켜 정량화된다.[29][31]
오리지널
3C(원-vs-1)
염색체 순응 포획(3C) 실험은 단일 쌍의 유전체 로키 사이의 상호작용을 정량화한다. 예를 들어, 3C는 후보 촉진자와 촉진제 상호작용을 테스트하는 데 사용될 수 있다. 연결된 파편은 알려진 프라이머가 있는 PCR을 사용하여 검출된다.[2][17] 그렇기 때문에 이 기법은 상호작용하는 지역에 대한 사전 지식이 필요한 것이다.
4C(One-vs-all)
염색체 순응 캡쳐온칩(4C)(원형 염색체 순응 캡쳐라고도 함)은 한 로커와 다른 모든 게놈 로키 사이의 상호작용을 캡처한다. 그것은 자가 원형으로 된 DNA 조각을 만들기 위한 두 번째 조사 단계를 포함하는데, 이것은 역 PCR을 수행하는 데 사용된다. 역 PCR은 알려진 시퀀스를 사용하여 그것에 연결된 알 수 없는 시퀀스를 증폭시킬 수 있다.[32][2][19] 3C와 5C와는 대조적으로, 4C 기법은 상호작용하는 염색체 영역에 대한 사전 지식이 필요하지 않다. 4C를 사용하여 얻은 결과는 서로 가까운 지역 간에 감지되는 대부분의 상호작용과 함께 매우 재현 가능하다. 단일 마이크로 어레이에서 약 100만 개의 상호작용을 분석할 수 있다.[citation needed]
5C(다중-vs-다중)
염색체 순응 포획 탄소 카피(5C)는 특정 영역 내의 모든 제한 조각들 사이의 상호작용을 감지하며, 이 영역의 크기는 일반적으로 메가베이스보다 크지 않다.[2][20] 이것은 만유 영장류를 모든 조각에 묶음으로써 이루어진다. 다만 5C는 커버리지가 상대적으로 낮다. 5C 기법은 근육 내 결찰 단계에서 접합 문제를 극복하며 특정 관심 위치의 복잡한 상호작용을 구성하는 데 유용하다. 이 접근방식은 게놈 전체에 걸친 복잡한 상호작용을 수행하는데 적합하지 않은데, 이는 수백만 개의 5C 프라이머를 사용해야 하기 때문이다.[citation needed]
Hi-C (All-vs-all)
Hi-C는 고투과 염기서열을 이용해 파편의[2][22] 뉴클레오티드 시퀀스를 찾아내고 쌍체 끝 염기서열을 이용해 각 묶인 파편의 양 끝에서 짧은 염기서열을 찾아낸다. 이와 같이, 주어진 묶인 파편의 경우, 얻은 두 시퀀스는 근접 기반 레깅 단계에서 함께 묶인 두 개의 서로 다른 제한 파편을 나타내야 한다. 시퀀스 쌍은 게놈에 개별적으로 정렬되므로, 해당 레깅 이벤트에 관련된 파편을 결정한다. 따라서 파편 간의 가능한 모든 쌍방향 교호작용을 시험한다.
시퀀스 캡처 기반 방법
많은 방법들이 3C 및 Hi-C 라이브러리를 풍부하게 하기 위해 올리고뉴클레오티드 캡처를 사용한다.[33][34] 이러한 방법에는 Capture-C,[36] NG Capture-C,[35] Capture-3C, [33][37]HiCap, Capture [38]Hi-C, Micro Capture-C가 있다.[35][39] 이러한 방법은 4C 기반 방법보다 높은 분해능과 민감도를 생성할 수 있으며,[40] 마이크로 캡쳐-C는 사용 가능한 3C 기법 중 가장 높은 분해능을 제공하며 기본 쌍 분해능 데이터를 생성할 수 있다.[39]
단세포법
Chip-seq와 Hi-C와 같은 이러한 방법의 단세포 적응을 사용하여 개별 세포에서 발생하는 상호작용을 조사할 수 있다.[41][42]
다중 상호작용 방법
여러 가지 방법들이 동시에 여러 개의 레그 접합부를 배열하여 염색질의 여러 영역이 상호작용하는 고차 구조를 검출한다. 이러한 방법에는 트라이-C,[43] 3방향 4C/C-워크,[44] 다중접촉 4C(MC-4C)가 포함된다.[45]
면역복구 기반 방법
킵루프
Chip-loop은 3C와 Chip-seq를 결합하여 관심 단백질에 의해 매개되는 두 관심 위치 사이의 상호작용을 탐지한다.[2][46] Chip-loop은 잦은 DNA 충돌이 발생하지 않기 때문에 단백질을 통해 매개되는 장거리 시스 상호작용과 트랜스 상호작용을 식별하는 데 유용할 수 있다.[citation needed]
게놈 와이드 메서드
ChIA-PET는 Hi-C와 Chip-seq를 결합하여 관심 단백질에 의해 매개되는 모든 상호작용을 검출한다.[2][23] HiCchIP는 입력 재료가 적은 ChIA-PET와 유사한 분석이 가능하도록 설계됐다.[47]
생물학적 영향
3C 방법은 염색체의 새로운 구조적 특징의 발견, 염색체 루프의 카탈로그화, 전사적 조절 메커니즘에 대한 이해증대(질병으로 이어질 수 있는 혼란) 등 여러 생물학적 통찰력을 이끌어냈다.[6]
3C 방법은 규제 요소들이 규제하는 유전자에 대한 공간적 근접성의 중요성을 입증했다. 예를 들어 글로빈 유전자를 표현하는 조직에서는 β-글로빈 로쿠스 제어 부위가 이러한 유전자와 함께 루프를 형성한다. 이 고리는 유전자가 발현되지 않는 조직에서는 발견되지 않는다.[48] 이 기술은 모델 유기체와 인간 모두에서 염색체에 대한 유전적, 후생적 연구를 더욱 도왔다.[not verified in body]
이러한 방법들은 후생유전학적 표지와 상관관계가 있는 TAD(Topology Connecting Domain)로 게놈의 대규모 조직을 밝혀냈다. 일부 TAD는 전사적으로 활성화되어 있는 반면 다른 TAD는 억제되어 있다.[49] 많은 TAD들이 D. 멜라노가스터, 마우스 그리고 인간에게서 발견되었다.[50] 더욱이, CTCF와 응집력은 TADs와 Enhancer-promoter 상호작용을 결정하는데 중요한 역할을 한다. 결과는 엔핸서-프로모터 루프에서 CTCF 바인딩 모티브의 방향이 엔핸서가 정확한 목표를 찾기 위해 서로 마주보고 있어야 한다는 것을 보여준다.[51]
인간병
이 논문에서 검토된 바와 같이, 프로모터와 촉진제 상호 작용의 결함으로 인해 발생하는 여러 가지 질병이 있다.[52]
베타 탈라세증은 LCR 강화제 성분이 삭제되면서 생기는 혈액 장애의 일종이다.[53][54]
Holoprosencephaly는 SBE2 enhancer 원소의 돌연변이에 의해 발생하는 두상성 장애로, 결과적으로 SHI 유전자의 생산을 약화시켰다.[55]
PPD2(삼뇌 엄지손가락의 다발성)는 ZRS Enhancer의 돌연변이에 의해 발생하며, 이는 결과적으로 SHI 유전자의 생산을 강화시켰다.[56][57]
폐의 아데노카르시노마는 MYC 유전자에 대한 강화제 원소의 복제에 의해 발생할 수 있다.[58]
T세포 급성 림프성 백혈병은 새로운 강화제의 도입에 의해 발생한다.[59]
데이터 분석
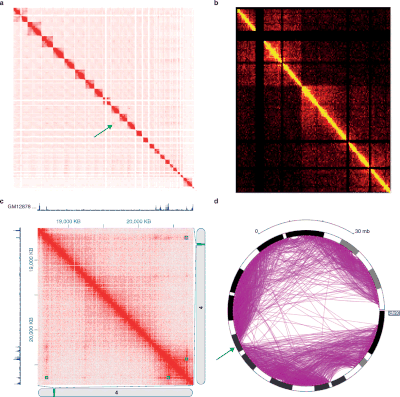
서로 다른 3C 스타일의 실험은 구조와 통계 특성을 매우 다르게 하는 데이터를 생산한다. 이와 같이 실험 유형별로 구체적인 분석 패키지가 존재한다.[34]
Hi-C 데이터는 흔히 3-D 공간에서 연관된 게놈의 선형적으로 연속적인 영역인 TAD(Topology Connecting Domain)와 같은 게놈 전체 염색체 조직을 분석하는 데 사용된다.[49] Hi-C 데이터에서 TAD를 식별하기 위해 여러 알고리즘이 개발되었다.[4][64]
Hi-C와 그 이후의 분석은 진화하고 있다. Fit-Hi-C는 상호작용의 거리 추가(초기 스플라인 피팅, 일명 스플라인-1)와 null 모델(스플라인-2)의 정제(spline-2)를 수정하는 이산형 바이닝 접근법에 기초한 방법이다. Fit-Hi-C의 결과는 p-값 및 q-값과의 쌍방향 색소 내 상호작용 목록이다.[63]
게놈의 3-D 조직도 접촉 매트릭스의 아이겐데 구성을 통해 분석할 수 있다. 각 고유 벡터는 구조 특성을 공유하는 선형 연속성이 반드시 있는 것은 아닌 로키 집합에 해당한다.[65]
3C 기술에서 중요한 교란 요인은 무작위 폴리머 거동에 의해 발생하는 게놈 로키 사이의 빈번한 비특정 상호작용이다. 두 위치 사이의 교호작용은 통계적 유의성 시험을 통해 구체적으로 확인해야 한다.[3]
Hi-C 연락처 맵 표준화
원시 Hi-C 접촉 열 지도를 정상화하는 방법에는 크게 두 가지가 있다. 첫 번째 방법은 동일한 가시성을 가정하는 것이다. 즉, 각 염색체 위치에 대해 상호작용이 발생할 가능성이 동등하다는 것을 의미한다. 따라서 Hi-C 접촉 맵의 실제 신호는 균형 행렬이어야 한다(균형 행렬에는 일정한 행 합과 열 합이 있다). 가시성이 동일하다고 가정하는 알고리즘의 예로는 원시 Hi-C 접촉 맵을 균형 매트릭스로 스케일링하는 싱혼-노프 알고리즘이 있다.
다른 방법은 각 염색체 위치와 관련된 편향이 있다고 가정하는 것이다. 각 좌표의 접촉 지도 값은 두 개의 접촉 위치와 관련된 위치 시간 편향에서 참 신호가 될 것이다. 이러한 편향 모델을 해결하기 위한 알고리즘의 예로는 반복 교정이 있는데, 이는 원시 Hi-C 접촉 지도에서 반복적으로 행과 열 편향을 퇴보한 것이다. Hi-C 데이터의 분석에 사용할 수 있는 많은 소프트웨어 도구가 있다.[66]
DNA 모티브 분석
DNA 모티브는 특정한 짧은 DNA 시퀀스로, 흔히 길이가[67] 8-20개인 뉴클레오티드는 공통의 생물학적 기능을 가진 일련의 시퀀스로 통계적으로 과잉 표현된다. 현재, 장거리 염색질 상호작용에 대한 규제 모티브는 광범위하게 연구되지 않았다. 몇몇 연구는 촉진자와 촉진제 상호작용에서 DNA 모티브가 미치는 영향을 해명하는 데 초점을 맞추었다.
베일리 외 연구진 촉진자 지역의 ZNF143 모티브가 촉진자와 촉진자 상호작용을 위한 시퀀스 특수성을 제공한다는 것을 확인했다.[68] ZNF143 모티브의 돌연변이는 ZNF143이 새로운 염색체-루핑 인자임을 암시하는 프로모터-엔핸서 상호작용 빈도를 감소시켰다.
게놈 척도 모티프 분석의 경우 2016년 웡 외 연구진은 K562 세포 라인에 대한 1만9491개의 DNA 모티프 쌍을 발기인과 발기부전자 상호작용에 대해 보고했다.[69] 그 결과 모티브 페어링 다중성(특정 모티브와 짝을 이루는 모티브의 수)이 상호작용 거리 및 규제 영역 유형과 연계될 것을 제안했다. 이듬해 웡은 6개의 인간 세포 라인에 18,879개의 모티브 쌍이 있다는 기사를 또 하나 냈다.[70] 이 작품의 참신한 기여는 페어링된 시퀀스에 직접 적용할 수 있는 모티브 발견 도구인 모티프하이데스가 있다.
암 게놈 분석
3C 기반 기술은 암 게놈의 염색체 재배열을 통찰할 수 있다.[71] 게다가, 그들은 규제 요소와 그들의 목표 유전자에 대한 공간 근접성의 변화를 보여줄 수 있고, 이것은 게놈의 구조와 기능적 기초를 더 깊이 이해하게 한다.[72]
참조
- ^ de Wit E, de Laat W (January 2012). "A decade of 3C technologies: insights into nuclear organization". Genes & Development. 26 (1): 11–24. doi:10.1101/gad.179804.111. PMC 3258961. PMID 22215806.
- ^ a b c d e f g Hakim O, Misteli T (March 2012). "SnapShot: Chromosome confirmation capture". Cell. 148 (5): 1068.e1–2. doi:10.1016/j.cell.2012.02.019. PMC 6374129. PMID 22385969.
- ^ a b c Ay F, Bailey TL, Noble WS (June 2014). "Statistical confidence estimation for Hi-C data reveals regulatory chromatin contacts". Genome Research. 24 (6): 999–1011. doi:10.1101/gr.160374.113. PMC 4032863. PMID 24501021.
- ^ a b c Rao SS, Huntley MH, Durand NC, Stamenova EK, Bochkov ID, Robinson JT, Sanborn AL, Machol I, Omer AD, Lander ES, Aiden EL (December 2014). "A 3D map of the human genome at kilobase resolution reveals principles of chromatin looping". Cell. 159 (7): 1665–80. doi:10.1016/j.cell.2014.11.021. PMC 5635824. PMID 25497547.
- ^ Varoquaux N, Ay F, Noble WS, Vert JP (June 2014). "A statistical approach for inferring the 3D structure of the genome". Bioinformatics. 30 (12): i26–33. doi:10.1093/bioinformatics/btu268. PMC 4229903. PMID 24931992.
- ^ a b Denker A, de Laat W (June 2016). "The second decade of 3C technologies: detailed insights into nuclear organization". Genes & Development. 30 (12): 1357–82. doi:10.1101/gad.281964.116. PMC 4926860. PMID 27340173.
- ^ "Who invented the microscope? A complete Microscope History". Vision Engineering Ltd. Archived from the original on 22 April 2018.
- ^ "Photography by Benjamin Saur Tübingen Walther Flemming a German Physician". Course Hero, Inc.
- ^ Martins LA (1999). "Did Sutton and Boveri propose the so-called Sutton-Boveri chromosome hypothesis?". Genet. Mol. Biol. 22 (2): 261–272. doi:10.1590/S1415-47571999000200022.
- ^ "Genes and genetics: The language of scientific discovery". Oxford English Dictionary. Oxford University Press. 2012-08-16.
- ^ Harris M (2015-02-05). "Heterochromatin and euchromatin mains".
- ^ a b c Deichmann U (August 2016). "Epigenetics: The origins and evolution of a fashionable topic". Developmental Biology. 416 (1): 249–254. doi:10.1016/j.ydbio.2016.06.005. PMID 27291929.
- ^ Lu H, Liu X, Deng Y, Qing H (December 2013). "DNA methylation, a hand behind neurodegenerative diseases". Frontiers in Aging Neuroscience. 5: 85. doi:10.3389/fnagi.2013.00085. PMC 3851782. PMID 24367332.
- ^ "The Francis Crick Papers: The Discovery of the Double Helix, 1951–1953".
- ^ Cremer T, Cremer M (March 2010). "Chromosome territories". Cold Spring Harbor Perspectives in Biology. 2 (3): a003889. doi:10.1101/cshperspect.a003889. PMC 2829961. PMID 20300217.
- ^ Cullen KE, Kladde MP, Seyfred MA (July 1993). "Interaction between transcription regulatory regions of prolactin chromatin". Science. 261 (5118): 203–6. Bibcode:1993Sci...261..203C. doi:10.1126/science.8327891. PMID 8327891.
- ^ a b Dekker J, Rippe K, Dekker M, Kleckner N (February 2002). "Capturing chromosome conformation". Science. 295 (5558): 1306–11. Bibcode:2002Sci...295.1306D. doi:10.1126/science.1067799. PMID 11847345. S2CID 3561891.
- ^ Osborne CS, Ewels PA, Young AN (January 2011). "Meet the neighbours: tools to dissect nuclear structure and function". Briefings in Functional Genomics. 10 (1): 11–7. doi:10.1093/bfgp/elq034. PMC 3080762. PMID 21258046.
- ^ a b Simonis M, Klous P, Splinter E, Moshkin Y, Willemsen R, de Wit E, van Steensel B, de Laat W (November 2006). "Nuclear organization of active and inactive chromatin domains uncovered by chromosome conformation capture-on-chip (4C)". Nature Genetics. 38 (11): 1348–54. doi:10.1038/ng1896. PMID 17033623. S2CID 22787572.
- ^ a b Dostie J, Richmond TA, Arnaout RA, Selzer RR, Lee WL, Honan TA, et al. (October 2006). "Chromosome Conformation Capture Carbon Copy (5C): a massively parallel solution for mapping interactions between genomic elements". Genome Research. 16 (10): 1299–309. doi:10.1101/gr.5571506. PMC 1581439. PMID 16954542.
- ^ Albert I, Mavrich TN, Tomsho LP, Qi J, Zanton SJ, Schuster SC, Pugh BF (March 2007). "Translational and rotational settings of H2A.Z nucleosomes across the Saccharomyces cerevisiae genome". Nature. 446 (7135): 572–6. Bibcode:2007Natur.446..572A. doi:10.1038/nature05632. PMID 17392789. S2CID 4416890.
- ^ a b Lieberman-Aiden E, van Berkum NL, Williams L, Imakaev M, Ragoczy T, Telling A, et al. (October 2009). "Comprehensive mapping of long-range interactions reveals folding principles of the human genome". Science. 326 (5950): 289–93. Bibcode:2009Sci...326..289L. doi:10.1126/science.1181369. PMC 2858594. PMID 19815776.
- ^ a b Fullwood MJ, Liu MH, Pan YF, Liu J, Xu H, Mohamed YB, et al. (November 2009). "An oestrogen-receptor-alpha-bound human chromatin interactome". Nature. 462 (7269): 58–64. Bibcode:2009Natur.462...58F. doi:10.1038/nature08497. PMC 2774924. PMID 19890323.
- ^ Dixon JR, Selvaraj S, Yue F, Kim A, Li Y, Shen Y, Hu M, Liu JS, Ren B (April 2012). "Topological domains in mammalian genomes identified by analysis of chromatin interactions". Nature. 485 (7398): 376–80. Bibcode:2012Natur.485..376D. doi:10.1038/nature11082. PMC 3356448. PMID 22495300.
- ^ Nora EP, Lajoie BR, Schulz EG, Giorgetti L, Okamoto I, Servant N, Piolot T, van Berkum NL, Meisig J, Sedat J, Gribnau J, Barillot E, Blüthgen N, Dekker J, Heard E (April 2012). "Spatial partitioning of the regulatory landscape of the X-inactivation centre". Nature. 485 (7398): 381–5. Bibcode:2012Natur.485..381N. doi:10.1038/nature11049. PMC 3555144. PMID 22495304.
- ^ a b Nagano, Takashi; Lubling, Yaniv; Stevens, Tim J.; Schoenfelder, Stefan; Yaffe, Eitan; Dean, Wendy; Laue, Ernest D.; Tanay, Amos; Fraser, Peter (October 2013). "Single-cell Hi-C reveals cell-to-cell variability in chromosome structure". Nature. 502 (7469): 59–64. Bibcode:2013Natur.502...59N. doi:10.1038/nature12593. PMC 3869051. PMID 24067610.
- ^ Rao, Suhas; Huntley, Miriam (December 2014). "A 3D map of the human genome at kilobase resolution reveals principles of chromatin looping". Cell. 159 (7): 1665–1680. doi:10.1016/j.cell.2014.11.021. PMC 5635824. PMID 25497547.
- ^ Gavrilov A, Eivazova E, Priozhkova I, Lipinski M, Razin S, Vassetzky Y (2009). "Chromosome conformation capture (from 3C to 5C) and its ChIP-based modification". Chromatin Immunoprecipitation Assays. review. Methods in Molecular Biology. Vol. 567. pp. 171–88. doi:10.1007/978-1-60327-414-2_12. ISBN 978-1-60327-413-5. PMID 19588093.
- ^ a b c Naumova N, Smith EM, Zhan Y, Dekker J (November 2012). "Analysis of long-range chromatin interactions using Chromosome Conformation Capture". Methods. 58 (3): 192–203. doi:10.1016/j.ymeth.2012.07.022. PMC 3874837. PMID 22903059.
- ^ Belton JM, Dekker J (June 2015). "Chromosome Conformation Capture (3C) in Budding Yeast". Cold Spring Harbor Protocols. 2015 (6): 580–6. doi:10.1101/pdb.prot085175. PMID 26034304.
- ^ a b Gavrilov AA, Golov AK, Razin SV (2013-03-26). "Actual ligation frequencies in the chromosome conformation capture procedure". PLOS ONE. 8 (3): e60403. Bibcode:2013PLoSO...860403G. doi:10.1371/journal.pone.0060403. PMC 3608588. PMID 23555968.
- ^ Zhao, Zhihu; Tavoosidana, Gholamreza; Sjolinder, Mikael; Gondor, Anita; Mariano, Piero; Wang, Sha; Kanduri, Chandrasekhar; Lezcano, Magda; Sandhu, Kuljeet Singh; Singh, Umashankar; Pant, Vinod; Tiwari, Vijay; Kurukuti, Sreenivasulu; Ohlsson, Rolf (2006). "Circular chromosome conformation capture (4C) uncovers extensive networks of epigenetically regulated intra- and interchromosomal interactions". Nature Genetics. 38 (11): 1341–7. doi:10.1038/ng1891. PMID 17033624. S2CID 2660843.
- ^ a b 미국 특허 10287621
- ^ a b Schmitt AD, Hu M, Ren B (December 2016). "Genome-wide mapping and analysis of chromosome architecture". Nature Reviews Molecular Cell Biology. 17 (12): 743–755. doi:10.1038/nrm.2016.104. PMC 5763923. PMID 27580841.
- ^ a b Hughes JR, Roberts N, McGowan S, Hay D, Giannoulatou E, Lynch M, et al. (February 2014). "Analysis of hundreds of cis-regulatory landscapes at high resolution in a single, high-throughput experiment". Nature Genetics. 46 (2): 205–12. doi:10.1038/ng.2871. PMID 24413732. S2CID 205348099.
- ^ Davies JO, Telenius JM, McGowan SJ, Roberts NA, Taylor S, Higgs DR, Hughes JR (January 2016). "Multiplexed analysis of chromosome conformation at vastly improved sensitivity". Nature Methods. 13 (1): 74–80. doi:10.1038/nmeth.3664. PMC 4724891. PMID 26595209.
- ^ Sahlén, Pelin; Abdullayev, Ilgar; Ramsköld, Daniel; Matskova, Liudmila; Rilakovic, Nemanja; Lötstedt, Britta; Albert, Thomas J.; Lundeberg, Joakim; Sandberg, Rickard (2015-08-03). "Genome-wide mapping of promoter-anchored interactions with close to single-enhancer resolution". Genome Biology. 16: 156. doi:10.1186/s13059-015-0727-9. ISSN 1474-760X. PMC 4557751. PMID 26313521.
- ^ Jäger R, Migliorini G, Henrion M, Kandaswamy R, Speedy HE, Heindl A, Whiffin N, Carnicer MJ, Broome L, Dryden N, Nagano T, Schoenfelder S, Enge M, Yuan Y, Taipale J, Fraser P, Fletcher O, Houlston RS (February 2015). "Capture Hi-C identifies the chromatin interactome of colorectal cancer risk loci". Nature Communications. 6: 6178. Bibcode:2015NatCo...6.6178J. doi:10.1038/ncomms7178. PMC 4346635. PMID 25695508.
- ^ a b Hua P, Badat M, Hanssen L, Hentges L, Crump N, Downes D, Jeziorska DM, Oudelaar AM, Schwessinger R, Taylor S, Milne TA, Hughes JR, Higgs DR, Davies, JO (June 2021). "Defining genome architecture at base-pair resolution". Nature. 595 (7865): 125–129. doi:10.1038/s41586-021-03639-4. PMID 34108683.
- ^ Davies JO, Oudelaar AM, Higgs DR, Hughes JR (January 2017). "How best to identify chromosomal interactions: a comparison of approaches". Nature Methods. 14 (2): 125–134. doi:10.1038/nmeth.4146. PMID 28139673. S2CID 4136037.
- ^ Nagano T, Lubling Y, Stevens TJ, Schoenfelder S, Yaffe E, Dean W, et al. (October 2013). "Single-cell Hi-C reveals cell-to-cell variability in chromosome structure". Nature. 502 (7469): 59–64. Bibcode:2013Natur.502...59N. doi:10.1038/nature12593. PMC 3869051. PMID 24067610.
- ^ Schwartzman O, Tanay A (December 2015). "Single-cell epigenomics: techniques and emerging applications". Nature Reviews Genetics. 16 (12): 716–26. doi:10.1038/nrg3980. PMID 26460349. S2CID 10326803.
- ^ Oudelaar, A. Marieke; Davies, James O. J.; Hanssen, Lars L. P.; Telenius, Jelena M.; Schwessinger, Ron; Liu, Yu; Brown, Jill M.; Downes, Damien J.; Chiariello, Andrea M.; Bianco, Simona; Nicodemi, Mario (2018). "Single-allele chromatin interactions identify regulatory hubs in dynamic compartmentalized domains". Nature Genetics. 50 (12): 1744–1751. doi:10.1038/s41588-018-0253-2. ISSN 1546-1718.
- ^ Olivares-Chauvet, Pedro; Mukamel, Zohar; Lifshitz, Aviezer; Schwartzman, Omer; Elkayam, Noa Oded; Lubling, Yaniv; Deikus, Gintaras; Sebra, Robert P.; Tanay, Amos (2016). "Capturing pairwise and multi-way chromosomal conformations using chromosomal walks". Nature. 540 (7632): 296–300. doi:10.1038/nature20158. ISSN 1476-4687.
- ^ Allahyar, Amin; Vermeulen, Carlo; Bouwman, Britta A. M.; Krijger, Peter H. L.; Verstegen, Marjon J. A. M.; Geeven, Geert; van Kranenburg, Melissa; Pieterse, Mark; Straver, Roy; Haarhuis, Judith H. I.; Jalink, Kees (2018). "Enhancer hubs and loop collisions identified from single-allele topologies". Nature Genetics. 50 (8): 1151–1160. doi:10.1038/s41588-018-0161-5. ISSN 1546-1718.
- ^ Horike S, Cai S, Miyano M, Cheng JF, Kohwi-Shigematsu T (January 2005). "Loss of silent-chromatin looping and impaired imprinting of DLX5 in Rett syndrome". Nature Genetics. 37 (1): 31–40. doi:10.1038/ng1491. PMID 15608638. S2CID 2884412.
- ^ Mumbach MR, Rubin AJ, Flynn RA, Dai C, Khavari PA, Greenleaf WJ, Chang HY (November 2016). "HiChIP: efficient and sensitive analysis of protein-directed genome architecture". Nature Methods. 13 (11): 919–922. doi:10.1038/nmeth.3999. PMC 5501173. PMID 27643841.
- ^ Tolhuis B, Palstra RJ, Splinter E, Grosveld F, de Laat W (December 2002). "Looping and interaction between hypersensitive sites in the active beta-globin locus". Molecular Cell. 10 (6): 1453–65. doi:10.1016/S1097-2765(02)00781-5. PMID 12504019.
- ^ a b Cavalli G, Misteli T (March 2013). "Functional implications of genome topology". Nature Structural & Molecular Biology. 20 (3): 290–9. doi:10.1038/nsmb.2474. PMC 6320674. PMID 23463314.
- ^ Dekker J, Marti-Renom MA, Mirny LA (June 2013). "Exploring the three-dimensional organization of genomes: interpreting chromatin interaction data". Nature Reviews Genetics. 14 (6): 390–403. doi:10.1038/nrg3454. PMC 3874835. PMID 23657480.
- ^ Guo Y, Xu Q, Canzio D, Shou J, Li J, Gorkin DU, et al. (August 2015). "CRISPR Inversion of CTCF Sites Alters Genome Topology and Enhancer/Promoter Function". Cell. 162 (4): 900–10. doi:10.1016/j.cell.2015.07.038. PMC 4642453. PMID 26276636.
- ^ Krijger PH, de Laat W (December 2016). "Regulation of disease-associated gene expression in the 3D genome". Nature Reviews Molecular Cell Biology. 17 (12): 771–782. doi:10.1038/nrm.2016.138. PMID 27826147. S2CID 11484886.
- ^ Fritsch EF, Lawn RM, Maniatis T (June 1979). "Characterisation of deletions which affect the expression of fetal globin genes in man". Nature. 279 (5714): 598–603. Bibcode:1979Natur.279..598F. doi:10.1038/279598a0. PMID 450109. S2CID 4243029.
- ^ Van der Ploeg LH, Konings A, Oort M, Roos D, Bernini L, Flavell RA (February 1980). "gamma-beta-Thalassaemia studies showing that deletion of the gamma- and delta-genes influences beta-globin gene expression in man". Nature. 283 (5748): 637–42. Bibcode:1980Natur.283..637V. doi:10.1038/283637a0. PMID 6153459. S2CID 4371542.
- ^ Jeong Y, El-Jaick K, Roessler E, Muenke M, Epstein DJ (February 2006). "A functional screen for sonic hedgehog regulatory elements across a 1 Mb interval identifies long-range ventral forebrain enhancers". Development. 133 (4): 761–72. doi:10.1242/dev.02239. PMID 16407397.
- ^ Lettice LA, Heaney SJ, Purdie LA, Li L, de Beer P, Oostra BA, et al. (July 2003). "A long-range Shh enhancer regulates expression in the developing limb and fin and is associated with preaxial polydactyly". Human Molecular Genetics. 12 (14): 1725–35. doi:10.1093/hmg/ddg180. PMID 12837695.
- ^ Wieczorek D, Pawlik B, Li Y, Akarsu NA, Caliebe A, May KJ, et al. (January 2010). "A specific mutation in the distant sonic hedgehog (SHH) cis-regulator (ZRS) causes Werner mesomelic syndrome (WMS) while complete ZRS duplications underlie Haas type polysyndactyly and preaxial polydactyly (PPD) with or without triphalangeal thumb". Human Mutation. 31 (1): 81–9. doi:10.1002/humu.21142. PMID 19847792. S2CID 1715146.
- ^ Zhang X, Choi PS, Francis JM, Imielinski M, Watanabe H, Cherniack AD, Meyerson M (February 2016). "Identification of focally amplified lineage-specific super-enhancers in human epithelial cancers". Nature Genetics. 48 (2): 176–82. doi:10.1038/ng.3470. PMC 4857881. PMID 26656844.
- ^ Mansour MR, Abraham BJ, Anders L, Berezovskaya A, Gutierrez A, Durbin AD, et al. (December 2014). "Oncogene regulation. An oncogenic super-enhancer formed through somatic mutation of a noncoding intergenic element". Science. 346 (6215): 1373–7. doi:10.1126/science.1259037. PMC 4720521. PMID 25394790.
- ^ Lajoie BR, van Berkum NL, Sanyal A, Dekker J (October 2009). "My5C: web tools for chromosome conformation capture studies". Nature Methods. 6 (10): 690–1. doi:10.1038/nmeth1009-690. PMC 2859197. PMID 19789528.
- ^ Deng X, Ma W, Ramani V, Hill A, Yang F, Ay F, et al. (August 2015). "Bipartite structure of the inactive mouse X chromosome". Genome Biology. 16 (1): 152. doi:10.1186/s13059-015-0728-8. PMC 4539712. PMID 26248554.
- ^ Zhou X, Lowdon RF, Li D, Lawson HA, Madden PA, Costello JF, Wang T (May 2013). "Exploring long-range genome interactions using the WashU Epigenome Browser". Nature Methods. 10 (5): 375–6. doi:10.1038/nmeth.2440. PMC 3820286. PMID 23629413.
- ^ a b Yardımcı GG, Noble WS (February 2017). "Software tools for visualizing Hi-C data". Genome Biology. 18 (1): 26. doi:10.1186/s13059-017-1161-y. PMC 5290626. PMID 28159004.
- ^ Dixon JR, Selvaraj S, Yue F, Kim A, Li Y, Shen Y, et al. (April 2012). "Topological domains in mammalian genomes identified by analysis of chromatin interactions". Nature. 485 (7398): 376–80. Bibcode:2012Natur.485..376D. doi:10.1038/nature11082. PMC 3356448. PMID 22495300.
- ^ Imakaev M, Fudenberg G, McCord RP, Naumova N, Goloborodko A, Lajoie BR, et al. (October 2012). "Iterative correction of Hi-C data reveals hallmarks of chromosome organization". Nature Methods. 9 (10): 999–1003. doi:10.1038/nmeth.2148. PMC 3816492. PMID 22941365.
- ^ Imakaev M, Fudenberg G, McCord RP, Naumova N, Goloborodko A, Lajoie BR, Dekker J, Mirny LA (October 2012). "Iterative correction of Hi-C data reveals hallmarks of chromosome organization". Nature Methods. 9 (10): 999–1003. doi:10.1038/nmeth.2148. PMC 3816492. PMID 22941365.
- ^ Zambelli F, Pesole G, Pavesi G (March 2013). "Motif discovery and transcription factor binding sites before and after the next-generation sequencing era". Briefings in Bioinformatics. 14 (2): 225–37. doi:10.1093/bib/bbs016. PMC 3603212. PMID 22517426.
- ^ 베일리, S.D, 장, X, 데사이, K, 에이드, M, 코라딘, O, 카우퍼-살·라리, R, … 루피엔, M. (2015년) ZNF143은 유전자 촉진자에서 염색질 상호작용을 확보하기 위한 시퀀스 특수성을 제공한다. 네이처 커뮤니케이션즈, 2,6186. https://doi.org/10.1038/ncomms7186에서 검색됨
- ^ K. Wong, Y. Li, C. 펭, "인간 내 장거리 염색체 상호작용에 대한 커플링 DNA 모티브 쌍의 식별" 32권, no. 2015년 9월 321~324페이지.
- ^ 왕가춘; 모티프하이데스: 쌍체 시퀀스, 생물정보학, 제33권, 제19권, 2017년 10월 1일, 페이지 3028–3035, https://doi.org/10.1093/bioinformatics/btx381에서 드 노보 DNA 모티브 쌍 발견에 대한 기대치를 극대화한다.
- ^ Harewood L, Kishore K, Eldridge MD, Wingett S, Pearson D, Schoenfelder S, Collins VP, Fraser P (June 2017). "Hi-C as a tool for precise detection and characterisation of chromosomal rearrangements and copy number variation in human tumours". Genome Biology. 18 (1): 125. doi:10.1186/s13059-017-1253-8. PMC 5488307. PMID 28655341.
- ^ Taberlay PC, Achinger-Kawecka J, Lun AT, Buske FA, Sabir K, Gould CM, et al. (June 2016). "Three-dimensional disorganization of the cancer genome occurs coincident with long-range genetic and epigenetic alterations". Genome Research. 26 (6): 719–31. doi:10.1101/gr.201517.115. PMC 4889976. PMID 27053337.
추가 읽기
- Barutcu AR, Fritz AJ, Zaidi SK, van Wijnen AJ, Lian JB, Stein JL, Nickerson JA, Imbalzano AN, Stein GS (January 2016). "C-ing the Genome: A Compendium of Chromosome Conformation Capture Methods to Study Higher-Order Chromatin Organization". Journal of Cellular Physiology. 231 (1): 31–5. doi:10.1002/jcp.25062. PMC 4586368. PMID 26059817.
- Marbouty M, Koszul R (December 2015). "Metagenome Analysis Exploiting High-Throughput Chromosome Conformation Capture (3C) Data". review. Trends in Genetics. 31 (12): 673–682. doi:10.1016/j.tig.2015.10.003. PMC 6831814. PMID 26608779.
- Dekker J (25 November 2014). "Two ways to fold the genome during the cell cycle: insights obtained with chromosome conformation capture". Epigenetics & Chromatin. 7 (1): 25. doi:10.1186/1756-8935-7-25. PMC 4247682. PMID 25435919.
- O'Sullivan JM, Hendy MD, Pichugina T, Wake GC, Langowski J (September–October 2013). "The statistical-mechanics of chromosome conformation capture". Nucleus. 4 (5): 390–8. doi:10.4161/nucl.26513. PMC 3899129. PMID 24051548.
- Umbarger MA (November 2012). "Chromosome conformation capture assays in bacteria". review. Methods. 58 (3): 212–20. doi:10.1016/j.ymeth.2012.06.017. PMID 22776362.
- Parelho V, Merkenschlager M (September 2005). "Gene expression: growing up together may help genes go their separate ways". news and commentary. European Journal of Human Genetics. 13 (9): 993–4. doi:10.1038/sj.ejhg.5201464. PMID 15999115. S2CID 29714576.
- Marvin M, Tan-Wong SM (2016-04-23). "Chromosome conformation capture" (commercial method). Abcam PLC. Retrieved 23 April 2016.