트리메틸보레인
Trimethylborane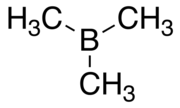 | |||
| | |||
| 이름 | |||
|---|---|---|---|
| 선호 IUPAC 이름 트리메틸보레인[1] | |||
| 기타 이름 트리메틸보린 트리메틸보론 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 켐스파이더 | |||
| ECHA InfoCard | 100.008.926 | ||
| EC 번호 |
| ||
펍켐 CID | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| C3H9B | |||
| 어금질량 | 55.92 g/190 | ||
| 외관 | 무색의 가스 또는 액체 | ||
| 밀도 | -100 °C에서[3] 0.625 g/cm3 | ||
| 녹는점 | -161.5°C(-258.7°F, 111.6K) | ||
| 비등점 | -20.2°C(-4.4°F, 253.0K) | ||
| 경미하고 반응성이 높은 | |||
| 구조 | |||
| Δ | |||
| 위험 | |||
| 산업안전보건(OHS/OSH): | |||
주요 위험 | 공기 중 자연발화성, 화상의 원인 | ||
| GHS 라벨 표시: | |||
   | |||
| 위험 | |||
| H220, H250, H280, H314 | |||
| P210, P222, P260, P264, P280, P301+P330+P331, P302+P334, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P370+P378, P377, P381, P403, P405, P410+P403, P422, P501 | |||
| 플래시 포인트 | 해당 없음, 화로포리 가스 | ||
| -40°C(-40°F, 233K)[4] | |||
| 관련 화합물 | |||
관련 화합물 | |||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
트리메틸보레인(TMB)은 B(CH3)3라는 공식(MeB로도3 쓸 수 있으며 메틸을 나타내는 Me와 함께)을 가진 독성, 파이로포린 가스다.
특성.
액체로서 그것은 무색이다. 적외선 스펙트럼에서 가장 강한 선은 1330cm이고−1 그 다음 선은 3010cm−1, 1185cm이다−1.
용해점은 -161.5℃이고, 비등점은 -20.2℃이다.
증기 압력은 로그 P = 6.1385 + 1.75 로그 T - 1393.3/T - 0.007735 T에 의해 주어진다. 여기서 T는 켈빈 단위로 온도다.[5] 분자량은 55.914이다. 증기발생 열은 25.6 kJ/mol이다.[4]
준비
트리메틸보레인은 1862년 에드워드 프랭클랜드에 의해 처음 설명되었는데,[6] 그는 또한 암모니아를 함유한 그것의 성질을 언급하였다.[7] 위험성 때문에 이 화합물은 알프레드 스톡과 프리드리히 자이들러가 붕소 트리클로로이드 가스와 디메틸진크의 반응을 이용했던 1921년까지 더 이상 연구되지 않았다.[8] 비록 이 물질은 Grignard 시약을 사용하여 준비될 수 있지만, 출력은 용제의 원하지 않는 제품에 의해 오염된다. 트리메틸보레인은 헥산느의 트리메틸알루미늄과 디부틸에테르에 보론트리브로미드를 용매로 반응시켜 수율 98%의 소규모로 만들 수 있다.[5] 그러나 다른 방법으로는 트리메틸알루민산염화 트리메틸알루미늄을 트리메틸알루미늄과 함께 트리메틸알루미늄을 반응시키는 것이 있다.[9] 그러나 또 다른 방법은 요오드화 메틸 마그네슘에 보론 삼불화물을 에테르에 첨가하는 것이다.[10]
반응
트리메틸보레인(Trimethylborane)은 농도가 충분히 높으면 공기 중에 자연 발화한다. 녹색 불꽃과 함께 타올라 그을음이 생긴다.[11] 용제나 기체 단계에서 산소를 이용한 느린 산화는 2개의 붕소와 3개의 산소 원자의 고리를 포함하는 디메틸트리옥사디보랄렌을 생성할 수 있다. 그러나 주요 제품은 디메틸보릴메틸페로산화물로, 디메톡시메틸보레인(dimethoxymethylborane)으로 빠르게 분해된다.[12]
트리메틸보레인은 강한 루이스 산이다. B(CH3)3는 다른 루이스 베이스뿐만 아니라 암모니아: (NH3):B(CH3)3[13]로 인덕트를 형성할 수 있다. B(CH3)3의 루이스산 성질은 EA= 2.90과 CA=3.60을 산출하는 ECW 모델에 의해 분석되었다. 트리메틸보레인이 트리메틸아민으로 유도체를 형성하면 B와 N 결과의 메틸 그룹들 사이에 강한 거부반응이 나타난다. ECW 모델은 이 긴장 효과의 측정을 제공할 수 있다.
트리메틸보레인은 상온에서 물과 염소와 반응한다. 그것은 또한 그리스와 반응하지만 테플론이나 유리와는 반응하지 않는다.[5]
트리메틸보레인은 디보레인과 불균형하게 반응하여 메틸디보레인과 디메틸디보레인을 형성한다: (CH3)BH2.BH3 및 (CH3)2BH.BH3.
트리메틸인산염과 함께 기체로 반응해 몰당 -41kcal의 형성열로 단단한 루이스 소금을 형성한다. 이 유도체의 승화열은 -24.6 kcal/mol이다. 트리메틸아신이나 트리메틸스티빈에는 아무런 반응이 없다.[10]
트리메틸보레인과 반응하는 메틸리튬은 테트라메틸보레산염인 LiB(CH3)를 생성한다.4[14] 테트라메틸보레이트 이온은 음전하를 가지며, 네오펜탄, 테트라메틸실레인, 테트라메틸모늄 양이온으로 이소전자적이다.
사용하다
트리메틸보레인은 중성자 계수기로 사용되어 왔다. 이것을 사용하기 위해서는 매우 순수해야 한다.[13] 그것은 또한 붕소와 탄소가 함께 침전되어야 하는 화학적 증기 증착에도 사용된다.
참조
- ^ "CHAPTER P-6. Applications to Specific Classes of Compounds". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 974. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ Graner, G.; Hirota, E.; Iijima, T.; Kuchitsu, K.; Ramsay, D. A.; Vogt, J.; Vogt, N. (2001). "C3H9B Trimethylborane". Molecules containing Three or Four Carbon Atoms. Landolt-Börnstein - Group II Molecules and Radicals. Vol. 25C. p. 1. doi:10.1007/10688787_381. ISBN 978-3-540-66774-2.
- ^ http://www.voltaix.com/images/doc/Msb000_TMB.pdf Voltaix의 MSDS
- ^ a b 트리메틸보레인
- ^ a b c William S. Rees, Jr. and al (1990). Alvin P. Ginsberg (ed.). Trimethylborane. Inorganic Syntheses. Vol. 27. p. 339.
- ^ E. Frankland (1862). "Ueber eine neue Reihe organischer Verbindungen, welche Bor enthalten". Justus Liebigs Ann. Chem. 124: 129–157. doi:10.1002/jlac.18621240102.
- ^ R. Nishiyabu, Y. Kubo, T.D. James and J. S. Fossey (2011). "Boronic acid building blocks: tools for self assembly". Chem. Commun. 47 (4): 1124–1150. doi:10.1039/C0CC02921A. PMID 21113558.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ A. Stock and F. Zeidler (1921). "Zur Kenntnis des Bormethyls und Boräthyls". Ber. Dtsch. Chem. Ges. A/B. 54 (3): 531–541. doi:10.1002/cber.19210540321.
- ^ Roland Köster, Paul Binger, Wilhelm V. Dahlhoff (1973). "A Convenient Preparation of Trimethylborane and Triethylborane". Synthesis and Reactivity in Inorganic and Metal-Organic Chemistry. 3 (4): 359–367. doi:10.1080/00945717308057281.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ a b Donald Charles Mente (May 1975). "The Reactions of Trimethyl group Va Lewis Bases with simple Boron Lewis Acids" (PDF).
- ^ Herbert Ellern (1968). Military and Civilian Pyrotechnics. Chemical Publishing Company. p. 24. CiteSeerX 10.1.1.137.1104. ISBN 9780820603643.
- ^ Barton, Lawrence; Crump, John M.; Wheatley, Jeffrey B. (June 1974). "Trioxadiborolanes from the oxidation of methyldiborane". Journal of Organometallic Chemistry. 72 (1): C1–C3. doi:10.1016/s0022-328x(00)82027-6.
- ^ a b Gaylon S. Ross; et al. (2 October 1961). "Preparation of High Purity Trimethylborane" (PDF). Journal of Research of the National Bureau of Standards Section A. 66 (1).
- ^ 1958년 게오르크 위티그