산토닌
Santonin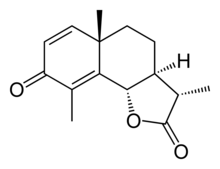 | |
 | |
| 이름 | |
|---|---|
| 우선 IUPAC 이름 (3S,3aS,5aS,9bS)-3,5a,9-트리메틸-3a,5,5a,9b-테트라히드로나프토[1,2-b]프랑-2,8(3H,4H)-디온 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 첸블 | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.006.874 |
| 케그 | |
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| C15H18O3 | |
| 몰 질량 | 246.30162 |
| 녹는점 | 172 °C (342 °F, 445 K) |
| 비등점 | 423°C(793°F, 696K) |
| 녹지 않다 | |
| 증기압 | 1*10−7mmHg |
| 위험 요소 | |
| 플래시 포인트 | 190 °C (374 °F, 463 K) |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
산토닌은 과거에 구충제로 널리 사용되었던 약이다.무색의 편평한 프리즘으로 이루어진 유기화합물로 빛의 작용으로 약간 노랗게 변하며 알코올, 클로로포름 및 끓는 물에 녹는다.
US Pharmacopoeia에 따르면, 산토닌은 "무색, 빛나는, 납작한, 프리즘 결정, 무취, 거의 맛이 없지만, 그 후에 쓴 맛이 난다. 공기에 노출되는 것이 아니라 빛에 노출되면 노란색으로 변한다"고 한다.찬물에 거의 녹지 않으며, 15°C에서 알코올의 40개 부분에 용해됩니다.(화씨 59°F)는 끓는 물의 250 부분과 끓는 알코올의 8 부분이며, 에테르 140 부분, 클로로포름의 4 부분 및 가성 알칼리 용액에도 용해된다.170°C로 가열할 경우(338°F)), 산토닌이 녹아서 빠르게 냉각되면 비정질 덩어리를 형성하며, 이 덩어리는 미량의 용제와 접촉하는 오일을 즉시 결정화한다.고온에서는 부분적으로 변화하지 않고 승화하며, 점화되면 잔류물이 남지 않고 소비된다.산토닌은 알코올로 적신 리트머스지에 중성입니다.산토닌은 수산화칼륨 알코올 용액과 함께 밝은 분홍빛이 도는 붉은 액체를 생성하며, 점차 무채색이 된다.산토닌은 가성 알칼리 용액에서 산과의 과포화에 의해 완전히 침전된다.[1]
격리
그것은 산토니카(Artemisia maritima var의 펴지지 않은 두상화)에서 유래했다. 스테치만니아나)다른 사람들은 A. cina 또는 A. chamemelifolia를 [2][3][4][5]파생종이라고 부른다.
산토닌의 구조를 결정하는 것은 초기 집중적인 [6][7][8]연구의 주제였다.산토닌으로부터 얻은 최초의 광생산은 루미산토닌이다.[9]이 배열에서 C-3 카르보닐기는 C-2로 이동하고, C-4메틸기는 C-1로 이동하고, C-10 카본은 반전한다.
구충제 사용
산토닌은 기생충을 마비시켜 몸 밖으로 내보낼 수 있게 한다.산토닌은 농도에 따라 지렁이 앞쪽(앞쪽)을 마비시키는 효과가 있고 뒤쪽(뒤쪽)에는 자극 효과가 있다.이로 인해 웜은 스스로 조정하지 못하고 [10]호스트 내에서 위치를 유지하는 기능을 상실합니다.하제를 사용하면 벌레가 쉽게 기절할 수 있다.1880년대 실험에서는 40시간이 지난 후에도 산토닌은 묽은 [11]알칼리의 포화 용액을 사용하는 회충에 치명적인 영향을 미치지 않는 것으로 나타났다.
산토닌은 이전에 미국과 영국의 약국에 등록되었지만, 더 안전한 아스카리제 개발과 함께 사용되지 않게 되었고, 대부분의 [12]국가에서 더 이상 약물로 등록되지 않습니다.
반응 및 특성
산토닌은 기반 촉매 가수분해 후 다단계 재배열 [13]과정을 통해 산톤산(CHO15204)으로 전환될 수 있다.
산토닌은 카르본산염의 형성과 함께 알칼리에 용해된다.아세트산 용액 중 산토닌은 약 1개월 동안 햇빛에 노출되면 (무색) 포토랜톤산(CHO15225)으로 변환되며, 일반적으로 독성이 낮은 것으로 간주된다.후자의 에틸에스테르(Ethyl ester)는 산토닌의 알코올 용액이 햇빛(세스티니)에 노출되었을 때 얻어진다.산토닌이 빛에 노출되면 노란색으로 변색된다.산토닌은 광학적으로 공중회전성이 있다.
제안된 생합성
α-산토닌의 완전한 생합성은 밝혀지지 않았지만 α-산토닌은 파르테놀라이드와 매우 유사하다.제안된 생합성은 세스퀴터펜 합성효소에 의한 파르네실 이인산(FPP)의 +-제르마크렌 A의 환화로 시작된다.+-제르마크렌 A의 수산효소는 이소프로페닐 측쇄를 수산화한다.중간 제르마카트리엔-12-al을 통한 제르마카트리엔-12-ol의 제르마카트리엔-12-oic acid로의 산화는 NADP 의존성+ 탈수소효소에 의해 이루어진다.다음으로 저마카트리엔-12-oic산을 C6에서 수산화시킨 후 젖소화형성(+)-코스투놀라이드.[14]
두 번째 고리 폐쇄 전에 (+)-코스트놀라이드의 메틸렌을 환원하는 것이 제안되었다.이환식 데칼린 고리 시스템은 유데실 양이온을 거쳐 C1에서 히드록실화를 통해 형성된다.C3에서의 추가 산화는 β-케토히드록실기를 형성하고, HO를 제거하면2 α-산토닌의 [15]제안된 생합성 경로가 완성된다.
광화학
햇빛에 노출되었을 때 α-산토닌의 화학 작용은 최초로 보고된 유기 광화학 반응이라는 특징이 있다.트롬스도르프는 1834년에 α-산토닌 결정이 "폭발"[16]하기 전에 햇빛에 노출되었을 때 노란색으로 변했다고 보고했다.이 고체상 반응의 산물은 1968년 마쓰우라에 의해 광배열의 산물로 확인되었으며, 격자 제어 Diels-Alder 반응과 [2+2]-포토사이클로디션이 [17]뒤따랐다.한편, 용액상의 빛에 노출되면, 단량체 골격 재배치 생성물이 형성된다.광다이머화의 메커니즘에 대해 자세히 [18]조사했다.
과거 약리학적 용도
산토닌은 1830년대 독일 화학자들에 의해 투르크메니스탄의 식물인 아르테미시아 시나에서 추출하여 개발되었다.그 당시 아르테미시아는 종종 항헬미네틱 치료제로 사용되었고, 여러해살이 약으로 널리 이용되었다.당시 일반적인 치료법은 500ml의 물에 5~10g의 허브를 주입하는 것이었다.캐스터 오일은 배출 과정을 돕는 데 사용될 수 있습니다.1843년까지 독일에서 산토닌이 함유된 사탕 로젠가 사용 가능했다고 보고되었다.
산토닌은 19세기 중반부터 1950년대까지 구충제로 사용되었으며, 전형적으로 설사제와 함께 투여되었다.Santonin은 회충 Ascaris 요충의 침입 치료와 일반적으로 Ascarid parassitoses(사충 기생충 기생충 포함)에 사용되었다.그것은 촌충의 침입을 치료하는데 효과가 없다.
산토닌은 종종 장충의 특허 치료제의 주요 성분으로 발견되었다.그것은 웜로젠, 파우더, 시럽, 강장제 [19]등 다양한 효능의 다양한 제제로 판매되었다.
1926년 동안 일본 제조업자들은 장내 기생충 박멸 노력의 일환으로 거의 모든 페이스트리, 과자, 토닉에 산토닌을 혼합하여 러시아로부터 연간 [20]5톤의 산토닌을 수입했다고 동방 러시아 무역회사 관계자가 보고했다.
브리태니커 백과사전(1911)은 일반적인 선량이 2 - 5그램이었다고 지적한다.(이것은 총 용량이었다; 많은 요법들이 3일 동안 매일 3회 복용을 요구했고, "3일 동안 하루에 3번 티스푼" 요법은 산토닌의 사용이 줄어들기 시작한 50년대 무렵에 전형적이었다; 일반적인 "50s 요법"에서 용량당 실제 투여량은 성인 용량당 20-30mg에 가까웠지만, 특히 "1회 투여량"을 통해 산토닌을 투여했다.좌약)은 19세기 후반에서 20세기 초에 흔했다.)이전에 등록된 유일한 영국 제제는 "산토닌 로젠지"였지만, "산토닌의 소다" (산토닌의 소다) 또한 이전에 미국 약국에서 공식 제제로 등록되었다.산토닌을 포함한 상업용 제제들은 또한 50년대 후반까지 미국의 약제들에 등장했습니다; 1955년 발표된 현대 약물 백과사전 및 치료 지수 (Massengill에 의해 생산됨)와 Winthrop-Stearns-Nowthropi에 의해 만들어진 일반적인 산토닌 제제들.
산토닌은 또한 방광의 아토니를 치료하는데 덜 사용되었다.이 사용법은 20세기 초 이후 크게 감소했다.
산토닌의 투여 형태는 다양했다; 19-20세기에는 산토닌 로젠제나 아스카리드 감염의 단회 투여 치료를 위해 고안된 좌약이 전형적인 치료 형태였고, 1950년대에는 미국에서 시판되고 있는 두 가지 남은 산토닌 제제는 액체 의약품이었다.
산토닌의 위험 및 사용 어려움
Santonin은 (현대 구충제에 비해) 사용이 매우 복잡하고 환자에게 상당히 심각한 위험을 수반하는 약물이었다.산토닌이나 산토닌이 함유된 식물을 나열하는 거의 모든 조제법과 허브는 황색 시력과 치명적인 반응의 실제 위험을 열거합니다; 산토닌의 소량조차도 보통 황색 시력 또는 아마도 녹색 시력 장애를 야기합니다.브리태니커 백과에서도 다음과 같이 언급했습니다.
...이러한 효과는 보통 며칠 안에 사라집니다.그러나 다량의 복용은 독성 영향, 실어증, 근육 떨림, 간질성 경련을 일으키고 시력 장애는 전맹으로 이어질 수 있다.
보다 전형적인 것은 킹스 아메리칸 조제소의 산토닌 부작용에 관한 경고입니다.
산토닌은 활성 물질로, 부적절한 용량으로 심각한 증상, 심지어 사망까지 일으킬 수 있습니다.2개의 곡류만큼 적은 양이 5년의 약한 아이를 죽였다고 하며, 5개의 곡류는 같은 나이의 아이에서 약 30분 동안 사망을 초래했다.독성 영향으로는 위통, 표면의 창백함 및 냉증, 두부주사, 떨림, 어지럼증, 동공확장, 눈의 경련, 발진, 다량의 땀, 혈뇨, 경련운동, 테타닉 경련 실신, 무감각 등이 있다.콜레라 모르스와 유사한 증상이 가끔 나타나며, 모든 경우에 소변은 특징적인 황색 또는 녹황색을 나타낸다.우리는 "지렁이 로젠"을 투여함으로써 생기는 경련을 관찰했다.산토닌에 의한 사망은 호흡마비로 인해 발생하며, 검시 결과 수축된 빈 우심실, 약 1온스의 액체, 왼쪽 심장에 검은 혈액, 염증된 십이지장, 그리고 위장에 염증이 생긴 패치가 밝혀졌습니다. 산토닌은 종종 시력에 단일한 영향을 미쳐, s를 유발합니다.노란색 또는 녹색인 것처럼 변색된 것처럼 보이는 주변 물체, 때로는 파란색 또는 빨간색. 또한 소변에 노란색 또는 녹색을 부여하고, 액체가 알칼리성일 경우 붉은색을 띠게 한다.지오반니 교수는 산토닌의 영향을 받았을 때 눈에 보이는 물체의 노란색은 시신경에 대한 선택적 작용이 아니라 약물이 공기에 노출되었을 때 취하는 노란색에 의존한다고 믿게 되었다.공기 중에 착색된 산토닌은 이 효과를 일으키지 않고 흰색 기사만 따른다.공기는 산토닌, 그것이 함유된 소변, 그리고 혈관에서 뽑아낼 때 혈액의 혈청에 노란색을 부여한다.조반니에 따르면, 흡수에 의해 물체가 이 색을 나타내는 것은 수액에 대한 직접적인 작용 때문이다.그러나 현재 로즈의 견해는 알칼리 혈청이 산토닌을 분해하고 산토닌은 뇌의 투시 중추에 작용하여 크로마토피아 또는 크산톱시아를 생성한다는 것이다.
적어도 한 가지 현대 허브는 산토닌의 이와 같은 심각한 부작용에 주목했다.
산토닌이 허브 구충제 중 가장 독성이 강한 약이라는 사실이 아니더라도, 산토닌을 사용한 구충제는 현대 구충제에 비해 복잡하다.일반적으로 산토닌은 "단일 용량" 요법을 위해 완전히 단식 중(약물을 복용하기 전과 복용 후 모두) 또는 배부른 상태에서 섭취해야 하며, 치료 전 2~3일 동안 및 치료 중(산토닌이 지방 용해성이며 si의 위험이 증가하기 때문에) 식단의 모든 지방과 기름을 피해야 한다.부작용); 산토닌의 과정 후, 죽은 벌레를 정화하기 위해 설사제를 투여해야 한다.(1955년 현재 미국에서 등록된 2개의 산토닌 제제는 사실 산토닌/정제 조합이었다.룸브리시드는 산토닌과 세나를 포함하고 있으며, 윈롭스트의 제제는 일반 제제이다.)s산토닌/산토나라 사그라다 조합 약)
산토닌은 심각한 부작용, 설사약의 필요성, 그리고 많은 안전한 제충제 개발로 인해 거의 사용되지 않게 되었다.일반적으로 메벤다졸과 피란텔 파모에이트는 산토닌이 이전에 사용되었던 현대의 약제 실천에 사용된다. 전체 의학 지침조차 산토닌의 심각하고 때로는 치명적인 부작용과 훨씬 안전한 구충제의 가용성 때문에 산토닌의 사용을 피하는 것을 강력히 권고한다[1].이사회 지침 65/65 유럽경제공동체(EEC)는 산토닌 제제에 대해 "허용될 수 없는" 위해성-편익 비율을 갖도록 공식적으로 판결했으며 산토닌을 함유한 제제는 더 이상 EU 국가에서 등록할 수 없다[2].
산토닌과 압신테
압신테가 투혼의 [21]함량으로 확실히 더 악명 높은 반면, 이 술은 또한 소량의[citation needed] 산토닌을 함유하고 있다.인상주의 미술, 특히 반 고흐의 작품은 투혼과 그것의 추정 향정신성 효과에 의해 영감을 받은 것이 아니라, 산토닌의 알려진 부작용인 "노란 비전" 또는 크산톱시아에 의해 영감을 받은 것일 수도 있다는 추측이 일부 정당에 의해 제기되어 왔다.그러나 이것은 산토닌 함량이 크산톱시아를 일으키기에 불충분하다고 지적한 아놀드와 로프투스(1991)에 의해 가장 두드러지게 논쟁되었다.
「 」를 참조해 주세요.
- 아르테미신, 산토닌의 히드록실화 유도체
레퍼런스
- ^ 원본 출처, US Pharmacopoeia, 1898
- ^ 브리태니커 백과사전(1911년판)에 따르면
- ^ 현대 식물학에서는 또한 아르테미시아 시나 레반트 쑥을 최종 출처로 열거하고 있습니다; 이것은 또한 킹스 아메리칸 디스펜서 같은 산토닌 사용 전성기에 출판된 공식의 진술에 의해 뒷받침됩니다.
- ^ King's American Depository, 1898(이 작품은 현재 공공영역에 있음)
- ^ Botanical.com (산토닌의 주요 소스인 레반트 웜시드에 관한 기사)
- ^ Woodward, R. B.; Brutschy, F. J.; Baer, Harold (1948). "The Structure of Santonic Acid". Journal of the American Chemical Society. 70 (12): 4216–4221. doi:10.1021/ja01192a070. PMID 18105974.
- ^ Clemo, George Roger; Haworth, Robert Downs (1930). "CCCXL.—The constitution of santonin. Part III. Proof of the positions of the methyl groups". J. Chem. Soc.: 2579–2582. doi:10.1039/JR9300002579.
- ^ Clemo, George Roger; Haworth, Robert Downs; Walton, Eric (1929). "CCCX.—The constitution of santonin. Part I. The synthesis of dl-santonous acid". J. Chem. Soc.: 2368–2387. doi:10.1039/JR9290002368.
- ^ 바튼, D.H.R.; 드마요, P.; 샤피크, M., J.화학.1958년, 140-145호바튼.D. H. R.; P. T. Gillam, P. T., 1960, J. Chem.사회 4596-4599번지
- ^ 구충제 효능의 화학요법 연구를 위한 체외 방법, 1943년.E. 볼드윈기생충학, 35, 89-111
- ^ 슈뢰더, W. von, 1885년 Arch. exp.패스, 파막, 19, 290
- ^ 현대 약물 백과사전 및 치료 색인, 제6판, Drug Publications Inc, 1955
- ^ 베이스 촉매 재배열 2009-02-07 Wayback Machine에 보관
- ^ 1. 드 크래커(De Kraker, J.W.), 프랜슨(M.C.), 달모(Dalm M.C.), 드 그루트(De Groot, A.), 바우미스터(Bouwmeester, H.J.), 치커리 뿌리에서 게르마크렌 A 카르본산의 생합성.세스퀴테르펜 락톤 생합성에 관여하는 시토크롬 P450(+)-게르마크렌 수산화효소 및 NADP+의존성 세스퀴테르페노이드 탈수소효소의 실증.(2001).식물 생리학. 125(4): 1930-40.
- ^ 바튼, D.H.R.; 모스, G.P.;"스테로이드와 테르페노이드의 생합성에 대한 조사"제1부산토닌의 생합성에 관한 예비 연구"(1968).J. Chem.Soc. 338(8): 1813-18.
- ^ Trommsdorff, Hermann (1834-01-01). "Ueber Santonin". Annalen der Pharmacie. 11 (2): 190–207. doi:10.1002/jlac.18340110207. ISSN 0365-5490.
- ^ Matsuura, Teruo; Sata, Yoshiteru; Ogura, Katsuyuki; Mori, Mayumi (1968-01-01). "Protoinduced reactions. XXIII. A novel photorearranement of santonin in the solid state". Tetrahedron Letters. 9 (44): 4627–4630. doi:10.1016/S0040-4039(00)72896-6. ISSN 0040-4039.
- ^ Natarajan, Arunkumar; Tsai, C. K.; Khan, Saeed I.; McCarren, Patrick; Houk, K. N.; Garcia-Garibay, Miguel A. (2007-08-01). "The Photoarrangement of α-Santonin is a Single-Crystal-to-Single-Crystal Reaction: A Long Kept Secret in Solid-State Organic Chemistry Revealed". Journal of the American Chemical Society. 129 (32): 9846–9847. doi:10.1021/ja073189o. ISSN 0002-7863. PMID 17645337.
- ^ Hiss, A. Emil (1898). Thesaurus of Proprietary Preparations and Pharmaceutical Specialties: Including "patent" Medicines, Proprietary Pharmaceuticals, Open-formula Specialties, Synthetic Remedies, Etc. G. P. Engelhard.
- ^ 미국약사회 약학회지, 15(1926년 7월), 575.
- ^ Erowid.org Absinthe FAQ
이 문서에는 현재 퍼블릭 도메인에 있는 출판물의 텍스트가 포함되어 있습니다.




