니켈(II)비스(아세틸아세토네이트)
Nickel(II) bis(acetylacetonate)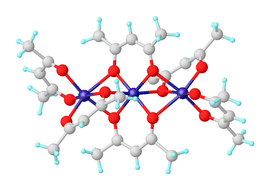 | |
 | |
| 이름 | |
|---|---|
| 기타 이름 Ni(acac),2 니켈 아크 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.019.887 |
| EC 번호 |
|
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| C30H42니3O12 | |
| 몰 질량 | 770.734 g/120−1 |
| 외모 | 짙은 녹색 |
| 밀도 | 1.455g/cm3 |
| 녹는점 | 229.5°C(445.1°F, 502.6K)(분해) |
| 호2 | |
| 위험 요소 | |
| GHS 라벨링: | |
  | |
| 위험. | |
| H302, H317, H334, H350 | |
| P201, , , , , , , , , , , , , ,, | |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
니켈(II) 비스(아세틸아세토네이트)는 식 [Ni(ac)]23의 배위 복합체이며, 여기서 acac은 아세틸아세톤의 탈양성자에서 유래한 음이온572− CHO이다.이것은 톨루엔과 같은 유기 용제에 용해되는 짙은 녹색 상사성 고체입니다.물과 반응하여 청록색 디아쿼 복합체 Ni(ac)2를 생성한다.HO2)2[1]
구조 및 속성
무수 니켈Ⅱ) 아세틸아세톤산염은 Ni(acac)6의3 분자로 존재한다.3개의 니켈 원자는 대략적으로 공선형이며 각각의 쌍은 2μ2 산소 원자에 의해 브리지됩니다.각 니켈 원자는 가교 옥시겐과 [2]비가교 옥시겐의 Ni-O 결합 길이 차이로 인해 사각형으로 왜곡된 팔면체 형상을 가진다.Ni(acac)6 분자는 cis-Ni(acac)2 "단량체"의 비대칭 점군에도 불구하고 거의 중심대칭이다. 이는3 [3]드문 일이다.삼량체 구조를 통해 모든 니켈 중심이 8면체 배위성을 달성할 수 있습니다.트리머는 니켈 중심 쌍 간에 산소 중심이 분자 내에서 공유되는 경우에만 형성됩니다.무수 복합체는 흥미로운 자기 특성을 가지고 있다.약 80K까지는 3.2μ의B 유효 자기 모멘트로 정상적인 상사성을 나타내며, 이는 2개의 짝이 없는 전자로 d이온으로8 예상되는 스핀 전용 모멘트에 가깝다.3개의 니켈 [4]이온이 모두 포함된 강자성 교환 상호작용으로 인해 4.3K에서 유효 모멘트는 4.1μ까지B 상승합니다.
아세틸아세톤산염 배위자의 부피가 큰 유사체에 결합할 때 입체 장애물은 모노니켈 유도체의 형성에 유리하다.이러한 현상은 3-메틸아세틸아세토네이트 [5]유도체에 대해 관찰된다.
이수화물
무수 형태와 마찬가지로 Ni(II) 중심은 8면체 배위 부위를 차지한다.배위구는 두 개의 이등분 아세틸아세틸아세틸아세틸아세틸아세틸아세틸아세틸아세틸아세틸아세틸아세틸아세틸아세틸아세틸아세틸니(acac)2HO)2는2 시스 이성질체 [6]및 트랜스 이성질체로 존재한다.Ni(acac)(2피리딘-N-옥시드)2[7]에 대해서도 트랜스 이성질체가 관찰된다.트랜스 이성질체에서는 축방향 Ni-O 결합의 길이가 적도 Ni-O 결합(2.0085Ω, 1.9961Ω)[8]보다 크다.
합성
비스(2,4-펜탄디온나토)니켈(II)아세틸아세톤으로 니켈 질산염을 염기의 존재 하에 처리하여 제조한다.청록색 디아쿼 착화체 Ni(CHCOCHCOCH33)(2HO2)2[9]입니다.
- Ni(NO3)2 + CHCOCHCOCH323 + 22 HO + 2 NaOH → Ni(CHCOCHCOCH33)(2HO2)2 + 23 NaNO
이 복합체는 Dean-Stark 트랩을 사용하여 공생 [9]증류에 의해 탈수될 수 있습니다.
- 3 Ni(CHCOCH33)(2HO2)2 → [Ni(CHCOCHCOCH33)]23 + 6 HO2
Ni(acac)2를 가열하면(HO2)2 170–210 °C에서 감소된 압력(0.2~0.4 mmHg)으로 무수 형태의 서브라이임과 물을 제거합니다.[3]
반응
무수 복합체는 루이스 염기 범위와 반응하여 단량체 [10]부가물을 생성한다.테트라메틸에틸렌디아민(테메다)[11]과의 반응이 해당된다.
- [Ni(CHCOCHCOCH33)]23 + 3tmeda → 3Ni(CHCOCHCOH33)(2tmeda)
니(acac)2HO)2는2 메틴 위치에서 높은 수율로 빠르게 반응하여 이소시아네이트로부터 디아미드를 생성한다.관련 반응은 디에틸 아조디카르복실산염 및 디메틸 아세틸렌디카르복실산염과 함께 발생합니다.
- 니(acac)2HO2)2 + 2 PhNCO → Ni(OCMeC252(O) NHPh)2 + 2 HO2
적용들
무수 복합체는 니켈 비스(시클로옥타디엔) 및 테트라메틸에틸렌디아민(디메틸) 니켈(II)[12][11]과 같은 니켈 기반 촉매의 전구체입니다.
[Ni(acac)]23는 NiO 박막을 Sol-gel 기술을 [10]이용하여 전도성 유리 기판에 증착하기 위한 전구체이다.

「 」를 참조해 주세요.
레퍼런스
- ^ R. C. Mehrotra; R. Bohra; D. P. Gaur (1978). Metal ß-Diketones and Allied Derivatives. Academic Press. ISBN 0124881505.
- ^ G. J. Bullen, R. Mason & P. Pauling (1961). "Octahedral Co-ordination of Nickel in Nickel(II) Bisacetylacetone". Nature. 189 (4761): 291–292. doi:10.1038/189291a0. S2CID 37394858.
- ^ a b G. J. Bullen, R. Mason & P. Pauling. (1965). "The crystal and Molecular Structure of Bis(acetylacetonato)nickel (II)". Inorganic Chemistry. 4 (4): 456–462. doi:10.1021/ic50026a005.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 1157. ISBN 978-0-08-037941-8.
- ^ 1. A. Döhring, R. Goddard, P. W. Jolly, C. Krüger, V. R. Polyakov, Inorg, "3-치환 펜탄-2, 4-디온 니켈(II) 유도체에서의 모노머-트리머 이성질"화학 1997, 36, 177-183.doi:10.1021/ic960441c
- ^ M. Kudrat-E-Zahan, Y. Nishida & H. Sakiyama (2010). "Identification of cis/trans isomers of bis(acetylacetonato)nickel(II) complexes in solution based on electronic spectra". Inorganica Chimica Acta. 363: 168–172. doi:10.1016/j.ica.2009.09.011.
- ^ B. N. Figgis; M. A. Hitchman (2000). "Ligand Field Theory and its Application".
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ O. Metin, L. T. Yildirim & S. Ozkar (2007). "Synthesis, characterization and crystal structure of bis(acetylacetonato)dimethanolnickel(II)". Inorganic Chemistry. 10 (9): 1121–1123. doi:10.1016/j.inoche.2007.06.011.
- ^ a b Wielandt, J. W.; Ruckerbauer, D. (2010). Bis(1,5-cyclooctadiene)nickel(0). Inorganic Syntheses. Vol. 35. p. 120. doi:10.1002/9780470651568.ch6.
- ^ a b Paul A. Williams; Anthony C. Jones; Jamie F. Bickley; Alexander Steiner; Hywel O. Davies; Timothy J. Leedham; Susan A. Impey; Joanne Garcia; Stephen Allen; Aline Rougier; Alexandra Blyr (2001). "Synthesis and Crystal Structures of Dimethylaminoethanol Adducts of Ni(II) Acetate and Ni(II) Acetylacetonate. Precursors for the Sol–Gel Deposition of Electrochromic Nickel Oxide Thin Films". Journal of Materials Chemistry. 11 (9): 2329–2334. doi:10.1039/b103288g.
- ^ a b Kaschube, Wilfried; Pörschke, Klaus R.; Wilke, Günther (1988). "Tmeda-Nickel-Komplexe". Journal of Organometallic Chemistry. 355 (1–3): 525–532. doi:10.1016/0022-328X(88)89050-8.
- ^ Göttker-Schnetmann, Inigo; Mecking, Stefan (2020). "A Practical Synthesis of (tmeda)Ni(CH3)2, Isotopically Labeled (tmeda)Ni(13CH3)2, and Neutral Chelated-Nickel Methyl Complexes". Organometallics. 39 (18): 3433–3440. doi:10.1021/acs.organomet.0c00500. S2CID 224930545.
- ^ Shrestha, Ruja; Dorn, Stephanie C. M.; Weix, Daniel J. (2013-01-16). "Nickel-Catalyzed Reductive Conjugate Addition to Enones via Allylnickel Intermediates". Journal of the American Chemical Society. 135 (2): 751–762. doi:10.1021/ja309176h. PMC 3547151. PMID 23270480.




