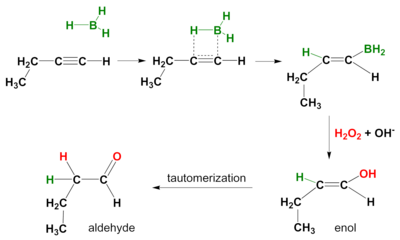
수력-산소 반응
Hydroboration–oxidation reaction하이드로보레이션-산소 반응(hydroboration-oxidation reaction)은 알켄을 알코올로 바꾸는 2단계 수화 반응이다.[1] 그 과정은 수소와 이중 결합이 있었던 히드록실 집단의 동기적 덧셈을 낳는다. 하이드로보레이션-산소화는 반 마르코브니코프 반응으로, 하이드록실 그룹이 덜 대체된 탄소에 부착된다. 따라서 이 반응은 산성 촉매 첨가 및 옥시머큐레이션-감소 프로세스와 같은 다른 수화 반응에 대해 보다 입체적이고 보완적인 레지오케미컬 대안을 제공한다. 그 반응은 Herbert C에 의해 처음 보고되었다. 1950년대[2] 후반 브라운과 1979년 노벨 화학상을 수상하면서 인정받았다.
반응의 일반적인 형태는 다음과 같다.
테트라하이드로푸란(THF)은 하이드로보조에 사용되는 원형용제다.
메커니즘 및 범위
하이드로보레이션 단계
첫 번째 단계에서는 붕소(BH3)가 이중 결합에 추가되어 수소 원자 중 하나를 붕소에 결합되는 원자에 인접한 탄소로 이동시킨다. 이 하이드로보레이션은 각 B-H 결합을 연속적으로 반응하여 각 B-H 결합에 세 개의 연골이 각3 BH에 추가되도록 두 번 더 반복된다. 그 결과 발생한 트릴킬보레인은 두 번째 단계에서 과산화수소로 처리된다. 이 과정은 B-C 채권을 HO-C 채권으로 대체한다. 붕소 시약은 붕산으로 전환된다. 그 반응은 원래 H.C.에 의해 설명되었다. 1957년 1헥산올을 1헥산올로 변환하기 위해 갈색.[3]
붕소를 함유한 집단이 히드록실 집단에 의해 대체된다는 것을 안다면 초기 수력보존 단계가 섭정성을 결정한다는 것을 알 수 있다. 하이드로보레이션은 반 마르코브니코프 방식으로 진행된다. 반응 순서 역시 입체적인 것으로서 (알켄의 같은 면에) 동기 덧셈을 준다. 수력보조는 동기 선택적이며 산화작용은 붕소를 같은 기하학적 위치를 가진 히드록실로 대체한다. 따라서 1-메틸사이클로펜틴은 주로 디보레인과 반응하여 트랜스-1-하이드록시-2-메틸사이클로펜탄(Trans-1-hydroxy-2-methylcylopentane[4]), 즉 새로 첨가된 H와 OH는 서로 시스(Cis)이다.
붕소에 부착된 모든 하이드로겐이 옮겨질 때까지 붕소 그룹 BH는2 더 많은 연호를 추가할 것이다. 이는 하이드로보레인 1개 몰이 알켄 3개 몰로 반응을 일으킨다는 것을 의미한다. 게다가, 하이드로보레인이 두 개 이상의 수소를 가질 필요는 없다. 예를 들어 RBH2 유형의 시약이 일반적으로 사용되며, 여기서 R은 분자의 나머지를 나타낼 수 있다. 이러한 변형된 수력보존 시약에는 9-BBN, 카테콜보레인, 디시아밀보렌이 포함된다.
산화 단계
반응 순서의 두 번째 단계에서 핵포질 수소 과산화 음이온이 붕소 원자를 공격한다. 알킬이 산소로 이동하면 알킬 보레인이 스테레오케미칼을 유지하게 된다(실제로는 모노칼 보리닉 에스테르 BHOR가2 아닌 트릴칼 붕산염 B(OR)3를 통해 반응이 일어난다).
반응에서 'H' 원자는 BH에서26 나오고, 'O' 원자는 과산화수소(HO22)에서 나오는 반면, O가 부착된 'H' 원자는 용매(참조 메커니즘)에서 나온다.
알키네 수력 발전
알카인에도 수력반응이 일어난다. 다시 작용모드는 동기화되고 2차 반응 제품은 단자 알키네에서 알데히드, 내부 알키네에서 케톤이 나온다. 양쪽 파이본에 걸쳐 수력 증식을 방지하기 위해 디시아밀(di-sec-iso-amyl) 보란과 같은 부피가 큰 보란(borane)이 사용된다.[5]
대체 산화
과산화수소 대신 다른 산화제를 사용하면 알케인의 알코올이 아닌 카보닐 제품이 나올 수 있다. 촉매 테트라프로필람모늄 과루테네이트를 함유한 N-산화메틸모르폴린 N-산화물은 알킬보란을 카보닐로 변환하여 케톤 또는 알데히드 제품을 원 알켄의 탄소에 부착된 다른 그룹에 따라 달라진다.[6] 각종 디크롬산이나 관련 크롬(VI) 시약도 케톤을 주지만 단자 알케인에 대해서는 알데히드 대신 카르복실산을 주기도 한다.[7]
참조
- ^ Marc G. Loudon (2002). "Addition Reactions of Alkenes". Organic Chemistry (fourth ed.). New York: Oxford University Press. pp. 168–172. ISBN 0-19-511999-1.
- ^ Brown, H. C.; Zweifel, G. (1959). "A STEREOSPECIFIC CIS HYDRATION OF THE DOUBLE BOND IN CYCLIC DERIVATIVES". Journal of the American Chemical Society. 81: 247. doi:10.1021/ja01510a059.
- ^ Brown, H.; Rao, B. C. (1957). "Communications – Selective Conversion of Olefins into Organoboranes Through Competitive Hydroboration, Isomerization and Displacement Reactions". Journal of Organic Chemistry. 22 (9): 1137. doi:10.1021/jo01360a626.
- ^ Hawthorne, M. F. (1961). "Amine Boranes. VIII. The Hydroboration of Terminal Olefins, Dienes and Terminal Acetylenes with Trimethylamine t-Butylborane". Journal of the American Chemical Society. 83 (11): 2541–2544. doi:10.1021/ja01472a027.
- ^ Brown, H. C.; Gupta, S. K. (1972). "Catecholborane (1,3,2-benzodioxaorole) as a new, general monohydroboration reagent for alkynes. Convenient synthesis of alkeneboronic esters and acids from alkynes via hydroboration". Journal of the American Chemical Society. 94 (12): 4370. doi:10.1021/ja00767a072.
- ^ Yates, Matthew H. (1997). "One-pot conversion of olefins to carbonyl compounds by hydroboration / NMO–TPAP oxidation". Tetrahedron Lett. 38: 2813–2816. doi:10.1016/S0040-4039(97)00476-0.
- ^ Brown, Herbert C.; Kulkarni, Shekhar V.; Khanna, Vijay V.; Patil, Virendra D.; Racherla, Uday S. (1992). "Organoboranes for Synthesis. 14. Convenient Procedures for the Direct Oxidation of Organoboranes from Terminal Alkenes to Carboxylic Acids". J. Org. Chem. 57 (23): 6173–6177. doi:10.1021/jo00049a024.
외부 링크
- 유기화학포털 하이드로보레이션(최근 문헌 포함) https://www.organic-chemistry.org/namedreactions/brown-hydroboration.shtm