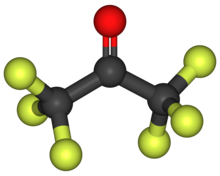
헥사플루오로아세톤
Hexafluoroacetone | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 1,1,1,3,3,3-헥사플루오로프로판-2-1 | |
| 기타 이름 과불화아세톤 육불화 아세트산 과불화로2-프로파논 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.010.616 |
| EC 번호 |
|
펍켐 CID | |
| RTECS 번호 |
|
| 유니 | |
| UN 번호 | 2420 |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C3F6O | |
| 어금질량 | 166.02 g/166 |
| 외관 | 무색가스 |
| 냄새 | 곰팡내가[1] 나다 |
| 밀도 | 1.32 g/ml, 액체 |
| 녹는점 | -129°C(144K) |
| 비등점 | -28°C(245K) |
| 물과 반응한다. | |
| 증기압 | 5.8 atm(20°C)[1] |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | 독성(T), 부식성(C) |
| GHS 라벨 표시: | |
     | |
| 위험 | |
| H280, H301, H310, H311, H314, H315, H330, H360, H370, H372 | |
| P201, P202, P260, P262, P264, P270, P271, P280, P281, P284, P301+P310, P301+P330+P331, P302+P350, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P307+P311, P308+P313, P310, P312, P314, P320, P321, P322, P330, P332+P313, P361, P362, P363, P403+P233, P405, P410+P403, P501 | |
| NFPA 704(화재 다이아몬드) | |
| 플래시 포인트 | 불연성[1] |
| NIOSH(미국 건강 노출 제한): | |
PEL(허용) | 없는[1] |
REL(권장) | TWA 0.1ppm(0.7mg/m3) [피부][1] |
IDLH(즉시 위험) | N.D.[1] |
| 관련 화합물 | |
관련 케톤; 유기화합물 | 아세톤; 헥사플루오로2-프로판올 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
헥사플루오로아세톤(HFA)은 공식(CF3)2을 가진 화학 화합물이다.CO. 구조적으로 아세톤과 유사하지만 반응성은 현저하게 다르다. 이 기체는 무색, 발광성, 불연성, 고반응성 기체로 곰팡이 냄새가 난다.[2] 이 물질의 가장 흔한 형태는 헥사플루오로아세톤 세스키하이드레이트(1.5 HO2)로,
2 헥사플루오로프로판-2-diol(FC
3)
2C(OH)의 헤미하이드레이트다.
합성
HFA로 가는 산업 루트는 HF로 헥사클로로아세톤을 처리한다.[3]
- (CCL3)2CO + 6HF → (CF3)2CO + 6 HCl
헥사플루오로프로필렌 산화물 재분류를 통해 HFA를 공급한다.
실험실에서 HFA는 과불화로프로펜으로부터 2단계 과정으로 준비될 수 있다. 첫 번째 단계에서 KF는 원소 황으로 알켄의 반응을 촉진하여 1,3-디티탄[(CF3)2CS]2을 부여한다. 이 종은 요오드산염에 의해 산화되어 주어진다 (CF3)2CO.[4]
사용하다
헥사플루오로아세톤은 헥사플루오로이소프로판올 생산에 사용된다.
- (CF3)2CO + H2 → (CF3)2CHOH
또한 폴리머 화학에 사용되는 [3]단층체인 헥사플루오로이소부틸렌의 전구체로 사용되며, 미다플루오르, 비스페놀 AF, 4,4--(헥사플루오로이소필리딘)디프탈산 무수화물, 알리타메의 합성에서도 건물 블록으로 사용된다.
반응도
헥사플루오로아세톤은 전기식이다. 핵소체는 카보닐 탄소를 공격한다. 물에는 헥사플루오로아세톤이 주로 수화물로 존재한다. 이 보석 다이올의 형성을 위한 평형 상수(Keq)는 106 M이다−1. 아세톤에 대한 유사한 평형은 불리한 10M이다−3−1.[5] 헥사플루오로아세톤-하이드레이트는 산성이다. 유사 반응에서 암모니아는 헥사플루오로아세톤에 첨가하여 헤미날(CF3)2C(OH)(NH2)를 주고, 이 물질은 염화인산염으로 탈수하여 이미네(CF3)2를 준다.씨엔에이.[6]
참고 항목
참조
- ^ a b c d e f NIOSH Pocket Guide to Chemical Hazards. "#0319". National Institute for Occupational Safety and Health (NIOSH).
- ^ CDC - 화학적 위험에 대한 NIOSH 포켓 가이드
- ^ a b Günter Siegemund; Werner Schwertfeger; Andrew Feiring; Bruce Smart; Fred Behr; Herward Vogel; Blaine McKusick (2002). "Fluorine Compounds, Organic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a11_349.
- ^ Van Der Puy, M.; Anello, L. G. (1990). "Hexafluoroacetone". Organic Syntheses.; Collective Volume, vol. 7, p. 251
- ^ Lemal, David M. (2004). "Perspective on Fluorocarbon Chemistry". The Journal of Organic Chemistry. 69 (1): 1–11. doi:10.1021/jo0302556. PMID 14703372.
- ^ W. J. Middleton; H. D. Carlson (1970). "Hexafluoroacetone imine". Org. Syntheses. 50: 81–3. doi:10.15227/orgsyn.050.0081..