불소석
Fluorite| 불소석 | |
|---|---|
 | |
| 일반 | |
| 카테고리 | 할로겐화 광물 |
| 공식 (유닛) | CaF2 |
| IMA 기호 | 후루루[1] |
| 스트룬츠 분류 | 3. AB.25 |
| 수정계 | 등각선 |
| 크리스털 클래스 | 육팔면체(m3m) H-M 기호: (4/m 3 2/m) (cF12) |
| 스페이스 그룹 | FM3m (제225호) |
| 단위 셀 | a = 5.4626Ω, Z = 4 |
| 신분증 | |
| 색. | 무채색. 단, 샘플은 불순물 때문에 진한 색을 띠는 경우가 많습니다.보라, 라일락, 황금색-노란색, 녹색, 파란색, 분홍색, 샴페인, 갈색입니다. |
| 수정 습관 | 잘 형성된 거친 크기의 결정, 결절형, 보트리올형, 드물게 주상 또는 섬유상, 입상, 질량 |
| 트윈닝 | {111}, 인터터넷에서 공통, 평평함 |
| 갈라짐 | 팔면체, {111}에 완벽, {011}에 분할 |
| 골절 | 부원추형에서 고르지 않음 |
| 고집 | 부서지기 쉽다 |
| 모스 척도 경도 | 4 (광물) |
| 광택 | 유리체 |
| 스트릭 | 하얀색 |
| 명료성 | 투명에서 반투명 |
| 비중 | 3.175–3.184 희토류 원소 함유량이 높은 경우 3.56 |
| 광학적 특성 | 등방성, 약한 이상 이방성 |
| 굴절률 | 1.433–1.448 |
| 가용성 | 3 |
| 용해성 | 약간 수용성이고 뜨거운 염산에 있는 |
| 기타 특징 | 형광, 인광, 열발광 및/또는 삼발광일 수 있음 |
| 레퍼런스 | [2][3][4][5] |
불소(fluorspar라고도 함)는 불화칼슘, CaF의2 광물 형태입니다.그것은 할로겐화물 광물에 속합니다.이것은 8면체와 더 복잡한 등각형의 형태는 드물지 않지만 등각 입방정형으로 결정화된다.
광물 경도의 Mohs 척도는 스크래치 경도 비교를 기반으로 값 4를 [6]불소석으로 정의합니다.
순수한 불소는 가시광선과 자외선에서 모두 무색하고 투명하지만, 불순물은 보통 그것을 화려한 광물로 만들고, 이 돌은 장식용과 백열용으로 사용된다.산업적으로 불소석은 제련 및 특정 유리 및 에나멜 생산에 플럭스로 사용됩니다.가장 순수한 등급의 불소는 대부분의 불소를 함유한 미세 화학 물질의 중간 공급원인 불산 제조를 위한 불소 공급원이다.광학적으로 투명한 불소 렌즈는 분산이 낮기 때문에, 그것으로 만들어진 렌즈는 색수차가 적어 현미경이나 망원경에서 가치가 있다.형광광학도 원적외선 및 중적외선 범위에서 사용할 수 있는데, 기존 안경은 사용하기에 너무 불투명합니다.
역사와 어원
fluorite라는 단어는 흐르는 것을 뜻하는 라틴어 동사 flure에서 유래했다.이 광물은 슬래그의 점도를 낮추기 위해 철 제련에서 플럭스로 사용됩니다.플럭스라는 용어는 흐름, 느슨함, 느슨함을 뜻하는 라틴어 형용사 플럭서스에서 유래했다.불소광물은 원래 불소광물로 불소광물로 불리며 1530년 게오르기우스 아그리콜라에 의해 출판된 베르만브스의 시브 드 메탈리카 대화책에서 처음으로 논의; 또는 금속의 성질에 관한 대화]에서 플럭스로서 유용한 광물로 [7][8]처음 논의되었다.언어학, 광업, 야금학에 전문지식을 가진 독일 과학자인 아그리콜라는 플루스파트를 플루스(하천, 강)와 스파트(석고,[9][10] 스페르스탄, 창돌과 유사한 비금속 광물이라는 뜻)에서 온 독일 플루스파트의 신라틴화라고 명명했다.
1852년, 불소석은 특정 장소의 불소석 중 특정 불순물에 의해 두드러지는 형광 현상에 이름을 붙였습니다.불소는 또한 그것의 구성 원소에 [3]불소라는 이름을 붙였습니다.현재, "불소"라는 단어는 산업 및 화학 상품으로서 불소를 가장 많이 사용하는 반면, "불소"는 광물학 및 대부분의 다른 의미로 사용됩니다.
고고학, 보석학, 고전학, 그리고 이집트학에서 라틴어인 뮤리나와 몰리나는 불소를 [11]가리킨다.대 플리니우스는 그의 내추럴리스 역사책 37권에서 이 돌을 보라색과 흰색 반점이 있는 귀중한 보석으로 묘사하고 있으며, 그의 물건들은 로마상이라고 묘사하고 있다.
구조.
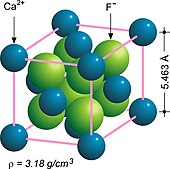
불소석은 큐빅 모티브로 결정화된다.크리스털 트윈링은 일반적이며 관찰된 크리스털 습관에 복잡성을 더합니다.불소석은 팔면체 [13]조각의 생성을 돕는 4개의 완벽한 절단면을 가지고 있다.형석이 채택한 구조 모티브는 형석 구조라고 불릴 정도로 일반적이다.칼슘 양이온의 원소 치환에는 스트론튬과 이트륨이나 세륨 [5]등의 특정 희토류 원소(REE)가 포함되는 경우가 많다.
발생 및 채굴
불소석은 일반적으로 열수 작용을 [14]통해 장석 화성암에서 늦게 결정되는 광물로 형성됩니다.그것은 특히 화강암 페그마타이트에서 흔하다.특히 암석에서는 열수작용을 통해 형성된 정맥 퇴적물로 발생할 수 있다.이러한 정맥 퇴적물에서는 갈레나, 스팔레라이트, 바라이트, 석영 및 석회석과 관련될 수 있습니다.불소석은 또한 퇴적암의 성분으로 곡물이나 [14]사암에서 시멘트 재료로 발견될 수 있다.
주로 남아프리카, 중국, 멕시코, 몽골, 영국, 미국, 캐나다, 탄자니아, 르완다, 아르헨티나에 분포하는 흔한 광물입니다.
세계 불소석 매장량은 2억3000만t(Mt)으로 추정되며 가장 많은 매장량은 남아프리카공화국(약 41Mt), 멕시코(32Mt), 중국(24Mt)이다.중국은 연간 약 3Mt(2010년)로 세계 1위를 달리고 있으며 멕시코(1.0Mt), 몽골(0.45Mt), 러시아(0.22Mt), 남아프리카공화국(0.13Mt), 스페인(0.12Mt), 나미비아(0.11Mt)[15][needs update] 순이다.
북미에서 가장 큰 불소 퇴적물 중 하나는 캐나다 뉴펀들랜드의 버린 반도에 있습니다.지질학자 J.B.는 이 지역에서 처음으로 형광체를 공식적으로 인정했다.1843년 주크.그는 세인트로렌스 항구의 서쪽에서 "갈레나" 즉 납 광석과 불소화 석회의 발생에 주목했다.플루어스파 상업 채굴에 대한 관심은 1928년에 시작되었고 1933년에 첫 번째 광석이 채굴되었다고 기록되어 있다.결국 아이언 스프링스 광산에서 갱도는 970피트(300m) 깊이에 도달했다.세인트로렌스 지역에서는 정맥이 매우 길게 지속되고 그 중 몇 개는 넓은 렌즈를 가지고 있다.작업 가능한 크기의 정맥이 있는 지역은 약 60평방마일(160km2)[16][17][18]로 구성되어 있습니다.
2018년 캐나다 플루오르스파 주식회사는 세인트 로렌스에서 광산[19] 생산을 다시 시작했습니다. 2019년 봄에는 제품을 시장으로 [20]이동하기 위한 보다 저렴한 수단으로 부린 반도 서쪽에 새로운 선적 항구를 개발할 계획이었고, 2021년 7월 31일 새로운 항구에서 광석을 선적하는 데 성공했습니다.이것은 30년 만에 처음으로 세인트 [21]로렌스에서 직접 광석을 수송한 것이다.
러시아 [22]달네고르스크에서 최대 20cm의 입방정체 결정체가 발견되었다.기록된 가장 큰 불소석 단결정은 크기가 2.12m이고 무게가 약 [23]16톤이었다.불소는 스페인 아스투리아스의 [24]칼도베이로 봉우리 광산에서도 발생한다.
'블루 존'
불소의 가장 오래된 지역 중 하나는 영국 더비셔의 캐슬톤으로, "더비셔 블루 존"이라는 이름으로 여러 광산이나 동굴에서 보라색 파란색 불소를 추출했습니다.19세기에는 장식적인 가치를 위해 이 매력적인 불소가 채굴되었다.광물질인 블루존은 현재 희귀하며, 매년 수백 킬로그램만 관상용과 장식용으로 채굴된다.채광은 여전히 블루존 캐번과 트레크 클리프 [25]캐번에서 이루어진다.
최근 중국에서 발견된 퇴적물은 전형적인 블루존석과 [26]비슷한 색상과 띠 모양의 불소를 만들어냈다.
형광
조지 가브리엘 스톡스는 1852년에 불소석으로부터의 [27][28]형광 현상을 명명했다.
많은 불소석 샘플은 자외선 아래에서 형광을 나타내는데, 이것은 [27]불소석으로부터 이름을 따온 특성이다.많은 미네랄과 다른 물질들이 형광을 일으킨다.형광은 자외선의 양자에 의해 전자 에너지 레벨이 상승한 후 전자가 이전 에너지 상태로 점진적으로 후퇴하여 그 과정에서 가시광선의 양자를 방출하는 것을 포함합니다.불소석에서는 방출되는 가시광선이 가장 일반적으로 파란색이지만 빨간색, 보라색, 노란색, 녹색 및 흰색도 발생합니다.불소석의 형광은 이트륨이나 이터비움 같은 광물 불순물이나 결정 격자의 휘발성 탄화수소와 같은 유기물 때문일 수 있다.특히, 형광 현상 자체의 명칭에 책임이 있는 영국의 특정 지역의 불소에서 볼 수 있는 파란색 형광은 [29]결정 내에 2가의 유로피움이 포함되어 있는 것에 기인한다.엘비움 등 희토류 불순물을 함유한 천연 시료에서도 적외선이 가시광선 방출을 자극하는 업컨버전 형광이 관찰되고 있는데, 이 현상은 보통 합성 [30]물질에서만 보고된다.
형광성 종류 중 하나는 클로로판인데, 클로로판은 불그스름하거나 보라색이며 가열(열발광)되거나 자외선으로 비추면 에메랄드 그린으로 밝게 형광을 발합니다.
불소석 시료가 형광에 노출될 때 방출되는 가시광선의 색상은 원래 시료를 채취한 위치에 따라 달라지며, 다른 장소의 결정 격자에 다른 불순물이 포함되어 있다.모든 불소석 형광체도 같은 지역에서도 똑같이 밝게 빛나지 않는다.따라서 자외선은 시료의 식별을 위한 신뢰할 수 있는 도구가 아니며 혼합물의 미네랄을 정량화하기 위한 도구가 아니다.예를 들어, 영국의 불소 중 노섬버랜드, 더럼, 컴브리아 동부에서 온 불소는 가장 일관되게 형광을 띠는 반면 요크셔, 더비셔, 콘월에서 온 불소는 형광을 띠는 경우 일반적으로 약하게만 형광을 띤다.
색.
불소는 이색성이기 때문에 원소 불순물로 착색될 수 있습니다.불소는 다양한 색상으로 이루어져 "세계에서 가장 화려한 광물"로 불리고 있다.다양한 색조의 무지개의 모든 색은 흰색, 검은색, 투명한 결정과 함께 불소 샘플로 표현됩니다.가장 흔한 색은 보라색, 파란색, 녹색, 노란색 또는 무색입니다.덜 흔한 것은 분홍색, 빨간색, 흰색, 갈색, 검은색이다.일반적으로 컬러 존 분할 또는 밴딩이 있습니다.불소석의 색상은 불순물, 방사선 노출, 색중심의 빈 공간 부재 등의 요인에 의해 결정됩니다.
사용하다
불소 및 불소 공급원
불소석은 다양한 물질을 생산하는 데 사용되는 상품 화학 물질인 불화수소의 주요 공급원입니다.플루오르화수소는 농축 황산의 작용에 의해 미네랄로부터 해방됩니다.
생성된 HF는 불소, 불소 탄소 및 다양한 불소 물질로 변환됩니다.1990년대 후반 현재,[32] 연간 50억 킬로그램이 채굴되었다.
천연 불소석에는 세 가지 주요 산업용 유형이 있으며, 이러한 산업에서는 일반적으로 "불소"라고 불리며, 순도 등급에 따라 다릅니다.세 가지 등급 중 가장 낮은 등급인 야금 등급 불소석(60-852% CaF)은 전통적으로 강철 생산에서 불순물 제거와 알루미늄 생산에서 원료의 융점을 낮추는 플럭스로 사용되어 왔습니다.세라믹 등급의 불소석(85~952% CaF)은 오팔렌센트 유리, 에나멜 및 조리기구 제조에 사용됩니다.최고 등급인 '산급 불소석'(97% 이상 CaF2)은 미국에서 불소석과 황산을 [33]반응시켜 불화수소와 불산을 만드는 데 사용되는 불소석 소비량의 약 95%를 차지한다.
국제적으로, 산성급 불소석은 알루미늄 제련에 사용되는 주요 불소 화합물인 AlF3 및 빙정석(NaAlF36)의 생산에도 사용됩니다.알루미나는 주로 녹은 NaAlF36, AlF3 및 불소석(CaF2)으로 구성된 수조에 용해되어 알루미늄의 전해 회수를 가능하게 합니다.불소 손실은 AlF의3 첨가로 완전히 대체되며, AlF의 대부분은 알루미나의 과잉 나트륨과 반응하여 NaAlF를36 [33]형성합니다.
틈새 용도
라피다리의 용도
천연 불소광물은 장식용과 백열용도가 있다.불소석은 비교적 부드러워서 반귀석으로 널리 쓰이지 않지만 구슬에 구멍을 뚫어 장신구에 사용할 수 있다.그것은 또한 장식적인 조각에 사용되며, 돌의 영역을 이용한 전문가 조각이 있다.
광학
실험실에서 플루오르화칼슘은 적외선 및 자외선 파장 양쪽에 대해 투명하고(약 0.15μm~9μm), 파장에 따른 굴절률 변화가 매우 낮기 때문에 일반적으로 창호재로 사용된다.또한 이 물질은 소수의 시약에 의해 공격된다.집적회로 리소그래피를 위한 반도체 스테퍼 제조에 사용되는 공통 파장인 157 nm의 짧은 파장에서 플루오르화칼슘의 굴절률은 고출력 밀도에서 약간의 비선형성을 나타내므로 이러한 목적을 위한 사용이 금지되었다.21세기 초에 불화칼슘의 스테퍼 시장이 붕괴되어 많은 대형 제조 시설이 문을 닫았습니다.캐논과 다른 제조업체들은 합성 성장한 불화칼슘 성분의 결정을 렌즈에 사용하여 아포크로매틱 설계를 지원하고 광분산을 줄였습니다.이 용도는 대부분 새로운 안경과 컴퓨터 보조 디자인으로 대체되었다.적외선 광학 재료로서 플루오르화칼슘을 널리 사용할 수 있으며 이스트만 코닥의 상표명 "Irtran-3"로 알려지기도 했습니다.
불소석은 불소에 근접하는 특수 광학 특성을 가진 저분산 유리인 불소 크라운(또는 불소 크라운) 유리와 혼동해서는 안 됩니다.진짜 불소는 유리가 아니라 결정성 물질이다.이 저분산 유리를 1개 이상의 소자로 하는 렌즈나 광학군은, 기존의 저분산 유리와 부싯돌 유리 소자를 이용해 무채색 렌즈를 만드는 것에 비해, 색수차가 적다.광학 그룹은 서로 다른 유형의 유리를 조합하여 사용합니다. 각 유형의 유리는 서로 다른 방식으로 빛을 굴절시킵니다.다른 종류의 유리를 조합하는 것으로써, 렌즈 메이커는 불필요한 특성을 소거하거나 큰폭으로 저감 할 수 있습니다.색수차가 가장 중요합니다.이러한 렌즈 디자인 중 가장 좋은 것은 종종 아포크로매틱이라고 불립니다(위 참조).형광 크라운 유리(Shott FK51)와 적절한 "플린트" 유리(Shott KzFSN 2 등)를 함께 사용하면 망원경 대물 렌즈, 현미경 대물 렌즈 및 카메라 망원 렌즈에서 매우 높은 성능을 제공할 수 있습니다.불소 원소는 마찬가지로 상호 보완적인 "플린트" 원소(Shott LaK 10 [35]등)와 쌍을 이룬다.굴절성 또는 불소 및 특정 플린트 요소의 굴절성은 가시광선 스펙트럼 전체에 걸쳐 보다 낮고 균일한 분산을 제공하여 색상의 초점을 보다 가깝게 유지합니다.불소석으로 만든 렌즈는 적어도 더블렛 망원경 용도로는 형광 크라운 기반 렌즈보다 우수하지만, 제작이 더 어렵고 비용이 [36]더 많이 듭니다.
프리즘과 렌즈를 위한 불소석 사용은 19세기 [37]말 빅토르 슈만에 의해 연구되고 장려되었다.광학적인 결함이 없는 자연발생 불소결정은 현미경 목적을 달성할 수 있을 정도로만 컸다.
1950년대와 60년대에 인공적으로 성장한 불소 결정의 등장으로, 일부 고성능 광학 망원경과 카메라 렌즈 소자에 유리 대신 사용될 수 있었다.망원경에서, 불소 원소는 고배율 천체들의 고해상도 이미지를 가능하게 한다.캐논사는 더 나은 망원렌즈에 사용되는 합성 불소결정을 생산한다.세쌍둥이를 포함한 불소 크라운 유리를 사용한 새로운 디자인이 저렴한 가격에 비슷한 성능을 제공함에 따라 망원경 렌즈에 불소석 사용은 1990년대 이후 감소해왔다.불소 및 불소화합물의 다양한 조합은 레이저 및 UV 및 [38]적외선을 위한 특수 광학에 응용되는 합성 결정으로 만들 수 있습니다.
반도체 산업용 노광 도구는 약 157나노미터 파장의 자외선에 불소 광학 소자를 이용한다.이 파장에서 불소석은 독특하게 높은 투명도를 가지고 있다.불소 대물 렌즈는 대형 현미경 회사(Nikon, Olympus, Carl Zeiss 및 Leica)에서 제조됩니다.자외선에 대한 투명성으로 형광 현미경 검사에 [39]사용할 수 있습니다.불소석은 또한 이러한 렌즈의 광학적 이상을 교정하는 역할을 합니다.니콘은 자외선 이미지 [40]생성용 불소 및 합성 석영 소자 카메라 렌즈(105mm f/4.5 UV)를 최소 1개 이상 제조한 바 있다.Konica는 SLR 카메라용 불소렌즈인 헥사논 300mm f/6.3을 생산했습니다.
자연 중 불소가스의 발생원
2012년, 독일 바이에른의 불소 광산에서 자연적으로 발생하는 불소 가스의 첫 번째 공급원이 발견되었다.이전에는 불소가스는 반응성이 매우 높고 다른 [41]화학물질과 빠르게 반응하기 때문에 자연적으로 발생하지 않는다고 생각되었다.불소석은 보통 무색이지만 근처에서 발견되는 몇몇 다양한 형태는 검은색으로 보이며 '페티드 불소석' 또는 앙투아조나이트로 알려져 있습니다.소량의 우라늄과 그 딸제품이 함유된 이 광물은 구조체 내의 불소 음이온 산화를 유도할 수 있는 충분한 에너지를 방출하여 광물에 갇힌 불소로 만든다.페티드 플루오르화염의 색은 주로 칼슘 원자가 남아 있기 때문이다.앙투아조나이트에 포함된 기체에 대해 고체불소-19 NMR을 실시한 결과, 피크가 [42]F와 일치하는2 425ppm으로 나타났다.
이미지들
휴스턴 자연과학박물관 Cullen Hall of Gewals and Minerals 전시관 불소 결정
「 」를 참조해 주세요.
- 불소석 생산순 나라 목록
- 광물 목록
- 플루오르화 마그네슘 – UV 광학에도 사용
레퍼런스
![]() 이 문서에는 미국 지질 조사 문서의 퍼블릭 도메인 자료가 포함되어 있습니다."Fluorspar" (PDF).
이 문서에는 미국 지질 조사 문서의 퍼블릭 도메인 자료가 포함되어 있습니다."Fluorspar" (PDF).
- ^ Warr, L.N. (2021). "IMA–CNMNC approved mineral symbols". Mineralogical Magazine. 85 (3): 291–320. Bibcode:2021MinM...85..291W. doi:10.1180/mgm.2021.43. S2CID 235729616.
- ^ Anthony, John W.; Bideaux, Richard A.; Bladh, Kenneth W.; Nichols, Monte C. (eds.). "Fluorite". Handbook of Mineralogy (PDF). Vol. III (Halides, Hydroxides, Oxides). Chantilly, VA, US: Mineralogical Society of America. ISBN 0962209724. Retrieved December 5, 2011.
- ^ a b 불소석Mindat.org
- ^ 불소석Webmineral.com
- ^ a b Hurlbut, Cornelius S.; Klein, Cornelis, 1985, 광물학 설명서, 324-325, 제20판, ISBN 0-471-80580-7.
- ^ Tabor, D. (1954). "Mohs's Hardness Scale - A Physical Interpretation". Proc. Phys. Soc. B. 67 (3): 249. Bibcode:1954PPSB...67..249T. doi:10.1088/0370-1301/67/3/310. Retrieved 19 January 2022.
- ^ "Discovery of fluorine". Fluoride History.
- ^ compiled by Alexander Senning. (2007). Elsevier's dictionary of chemoetymology: the whies and whences of chemical nomenclature and terminology. Amsterdam: Elsevier. p. 149. ISBN 978-0-444-52239-9.
- ^ Harper, Douglas. "fluorite". Online Etymology Dictionary.
- ^ Harper, Douglas. "spar". Online Etymology Dictionary.
- ^ 제임스 하렐 2012.UCLA 이집트학 백과사전, 보석.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Nesse, William D. (2000). Introduction to mineralogy. New York: Oxford University Press. pp. 376–377. ISBN 9780195106916.
- ^ a b Deer, W. A. (2013). An introduction to the rock-forming minerals. London: The Mineralogical Society. ISBN 978-0-903056-27-4. OCLC 858884283.
- ^ 플루어스파USGS.gov (2011)
- ^ 세인트 로렌스 플루어스파 광산 재가동 Lawrence, NL. Burin Minerals Ltd. (2009년 4월 9일)
- ^ Van Alstine, R. E. (1944). "The fluorspar deposits of Saint Lawrence, Newfoundland". Economic Geology. 39 (2): 109. doi:10.2113/gsecongeo.39.2.109.
- ^ Strong, D. F.; Fryer, B. J.; Kerrich, R. (1984). "Genesis of the St. Lawrence fluorspar deposits as indicated by fluid inclusion, rare earth element, and isotopic data". Economic Geology. 79 (5): 1142. doi:10.2113/gsecongeo.79.5.1142.
- ^ "St. Lawrence fluorspar mine gets $5M from feds, hundreds of jobs touted". Cbc.ca. Retrieved 14 December 2021.
- ^ Farrell, Colin. "CFI seeking new location for shipping port in St. Lawrence, NL SaltWire". Saltwire.com. Retrieved 14 December 2021.
- ^ Sheppard, Noah. "First Shipment of Fluorspar in Over 30 Years Exported From St. Lawrence". Vocm.com. Retrieved 14 December 2021.
- ^ Korbel, P. 및 Novak, M. (2002) The Complete Encyclopedia of Minerals, Book Sales, ISBN 0785815201.
- ^ Rickwood, P. C. (1981). "The largest crystals" (PDF). American Mineralogist. 66: 885–907.
- ^ "Caldoveiro Mine, Tameza, Asturias, Spain". mindat.org.
- ^ Hill, Graham; Holman, John (2000). Chemistry in context. Nelson Thornes. ISBN 0174482760.
- ^ Ford, Trevor D. (1994). "Blue John fluorspar". Geology Today. 10 (5): 186. doi:10.1111/j.1365-2451.1994.tb00422.x.
- ^ a b Stokes, G. G. (1852). "On the Change of Refrangibility of Light". Philosophical Transactions of the Royal Society of London. 142: 463–562. doi:10.1098/rstl.1852.0022.
- ^ Stokes, G. G. (1853). "On the Change of Refrangibility of Light. No. II". Philosophical Transactions of the Royal Society of London. 143: 385–396, at p. 387. doi:10.1098/rstl.1853.0016. JSTOR 108570. S2CID 186207789.
- ^ Przibram, K. (1935). "Fluorescence of Fluorite and the Bivalent Europium Ion". Nature. 135 (3403): 100. Bibcode:1935Natur.135..100P. doi:10.1038/135100a0. S2CID 4104586.
- ^ Moffatt, Jillian Elizabeth; Payten, Thomas Bede; Tsiminis, Georgios; Prinse, Thomas Jacob de; Teixeira, Lewis Da Silva; Klantsataya, Elizaveta; Ottaway, David John; Smith, Barnaby Whitmore; Spooner, Nigel Antony (2021-01-07). "Upconversion Fluorescence in Naturally Occurring Calcium Fluoride". Applied Spectroscopy. 75 (6): 674–689. Bibcode:2021ApSpe..75..674M. doi:10.1177/0003702820979052. PMID 33241707. S2CID 227176307.
- ^ McKeever, S. W. S. (1988). Thermoluminescence of Solids. Cambridge University Press. p. 9. ISBN 0-521-36811-1.
- ^ Aigueperse, Jean; Paul Mollard; Didier Devilliers; Marius Chemla; Robert Faron; Renée Romano; Jean Pierre Cuer (2005). "Fluorine Compounds, Inorganic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a11_307. ISBN 3527306730.
- ^ a b 밀러, 마이클 씨Fluorspar, USGS 2009 광물 연감
- ^ "The Crawford Cup". British Museum. Retrieved 20 December 2014.
- ^ "Interactive Abbe Diagram". SCHOTT AG. 2019. Retrieved February 20, 2018.
- ^ 루튼, 해리, 반 벤로이, 마틴(1988년).망원경 광학 평가 및 설계.윌만 벨 주식회사
- ^ Lyman, T. (1914). "Victor Schumann". Astrophysical Journal. 38: 1–4. Bibcode:1914ApJ....39....1L. doi:10.1086/142050.
- ^ Capper, Peter (2005). Bulk crystal growth of electronic, optical & optoelectronic materials. John Wiley and Sons. p. 339. ISBN 0-470-85142-2.
- ^ Rost, F. W. D.; Oldfield, Ronald Jowett (2000). Photography with a microscope. Cambridge University Press. p. 157. ISBN 0-521-77096-3.
- ^ Ray, Sidney F. (1999). Scientific photography and applied imaging. Focal Press. pp. 387–388. ISBN 0-240-51323-1.
- ^ 원소 불소가 자연에서 발생한다는 첫 번째 직접적인 증거입니다.Labspaces.net (2012-07-06)2013-08-05에 취득.
- ^ Witers, Neil (2012년 7월 1일) 불소는 마침내 자연 화학 세계에서 발견되었습니다.Rsc.org


















