인산염 다이칼슘
Dicalcium phosphate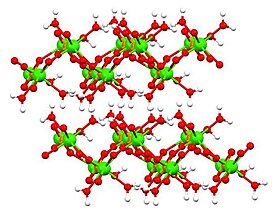 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 인산칼슘 | |
| 기타 이름 인산칼슘, 인산 칼슘 소금(1:1) | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.028.933 |
| E 넘버 | E341(ii) (대위, ...) |
펍켐 CID | |
| 유니 |
|
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| CaHPO4 | |
| 어금질량 | 136.06 g/㎥(무수) 172.09(수화물) |
| 외관 | 백색 가루 |
| 냄새 | 무취의 |
| 밀도 | 2.929 g/cm3(무수) 2.31 g/cm3(수화물) |
| 녹는점 | 부패하다 |
| 0.02 g/100 mL (무수) 0.02 g/100 mL(수화물) | |
| 구조 | |
| 삼두의 | |
| 위험 | |
| NFPA 704(화재 다이아몬드) | |
| 플래시 포인트 | 불연성 |
| 관련 화합물 | |
기타 음이온 | 화인산칼슘 |
기타 양이온 | 인산 마그네슘 모노칼슘인산염 인산염 트리칼슘 스트론튬 인산염 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
디칼슘 인산염은 CaHPO와4 그것의 디하이드레이트를 포함한 인산칼슘이다. 공통 이름의 "di" 접두사는 HPO42– 음이온의 형성이 인산, HPO에서34 두 양성자를 제거하는 것을 포함하기 때문에 발생한다. 그것은 또한 디 베이직 인산칼슘 또는 모노 수소 인산칼슘으로도 알려져 있다. 인산염 다이칼슘은 식품 첨가물로 사용되며 일부 이쑤시개에서 광택제로 발견되며 생체 물질이다.[1][2]
준비
디베이스 칼슘 인산염은 인산염으로 수산화칼슘을 중화시켜 생성되는데, 이 칼슘을 고체로서 침전시킨다. 60 °C에서 무수 형태는 다음과 같이 침전된다.[3]
히드록시파타이트를 형성하는 열화를 방지하기 위해 피로인산나트륨 또는 트리마그네슘 인산염 옥타하이드레이트를 치약에 광택제로 사용하는 경우 첨가한다.[1]
연속적인 프로세스에서 CaCl은2 (NH4)2HPO로4 처리되어 dihydrate를 형성할 수 있다.
그런 다음 약 65–70 °C까지 가열하여 결정 침전물로서, 일반적으로 추가적인 처리에 적합한 평평한 직경 결정체로서 무수 CaHPO를4 형성한다.[4]
디 베이직 칼슘 인산염 디하이드레이트(dibasic calcium phosphate dihydrate)는 의료적 용도가 있는 '브러시이트' 칼슘 인산염 천장(CPCs)'에서 형성 "β-TCP/MCPM"(β-트리칼슘 인산염/모노칼슘 인산염) 칼슘 인산염 세트의 형성에서 전반적인 설정 반응의 예는 다음과 같다.[5]

구조
인산염의 세 가지 형태가 알려져 있다.
- 디하이드레이트, CaHPO4•2HO2('DPCD'), 미네랄 브러시이트
- 단수화물, CaHPO4•HO2('DCPM')
- 미네랄 모네이트인 무수 CaHPO4('DCPA') pH 4.8 이하에서는 디아이드레이트 및 무수 형태의 디칼슘 인산염은 칼슘 인산염 중에서 가장 안정적(불용성)이다.
무수·이수화 형태의 구조는 X선 결정학에 의해 결정되었고, 단수화물의 구조는 전자 결정학에 의해 결정되었다. 단수화물[6][7](위 표에 표시됨)은 층층 구조를 채택한다.
사용 및 발생
디 베이직 칼슘 인산염은 주로 조식용 시리얼, 개 간식, 농축 밀가루, 국수 제품에서 식이 보조제로 사용된다. 체취를 없애기 위한 일부 제품을 포함한 일부 의약품 조제에서도 식탁용 제제로 사용된다. 디 베이직 칼슘 인산염은 일부 식이 칼슘 보충제에서도 발견된다(예: Bonexin). 그것은 가금 사료에 사용된다. 일부 이쑤시개에는 타르타르 조절제로도 쓰인다.[8]
인산염 다이페르슘을 가열하면 유용한 광택제인 디페르슘 디프인산염:
디하이드레이트(브러시이트) 형태에서는 일부 신장 결석과 치과용 칼쿨리에서 발견되기도 한다.[9][3]calculi)에서 발견된다.
참고 항목
참조
- ^ a b Corbridge, D. E. C. (1995). "Phosphates". Phosphorus - an Outline of its Chemistry, Biochemistry and Uses. Studies in Inorganic Chemistry. Vol. 20. pp. 169–305. doi:10.1016/B978-0-444-89307-9.50008-8. ISBN 9780444893079.
- ^ Salinas, Antonio J.; Vallet-Regí, María (2013). "Bioactive ceramics: From bone grafts to tissue engineering". RSC Advances. 3 (28): 11116. Bibcode:2013RSCAd...311116S. doi:10.1039/C3RA00166K.
- ^ a b Rey, C.; Combes, C.; Drouet, C.; Grossin, D. (2011). "Bioactive Ceramics: Physical Chemistry". Comprehensive Biomaterials. pp. 187–221. doi:10.1016/B978-0-08-055294-1.00178-1. ISBN 9780080552941.
- ^ Ropp, R.C. (2013). "Group 15 (N, P, As, Sb and Bi) Alkaline Earth Compounds". Encyclopedia of the Alkaline Earth Compounds. pp. 199–350. doi:10.1016/B978-0-444-59550-8.00004-1. ISBN 9780444595508.
- ^ Tamimi, Faleh; Sheikh, Zeeshan; Barralet, Jake (2012). "Dicalcium phosphate cements: Brushite and monetite". Acta Biomaterialia. 8 (2): 474–487. doi:10.1016/j.actbio.2011.08.005. PMID 21856456.
- ^ Curry, N. A.; Jones, D. W. (1971). "Crystal structure of brushite, calcium hydrogen orthophosphate dihydrate: A neutron-diffraction investigation". Journal of the Chemical Society A: Inorganic, Physical, Theoretical: 3725. doi:10.1039/J19710003725.
- ^ Lu, Bing-Qiang; Willhammar, Tom; Sun, Ben-Ben; Hedin, Niklas; Gale, Julian D.; Gebauer, Denis (2020-03-24). "Introducing the crystalline phase of dicalcium phosphate monohydrate". Nature Communications. 11 (1): 1546. Bibcode:2020NatCo..11.1546L. doi:10.1038/s41467-020-15333-6. ISSN 2041-1723. PMC 7093545. PMID 32210234.
- ^ Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). "Phosphoric Acid and Phosphates". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a19_465.pub3. ISBN 978-3527306732.
- ^ Pak, Charles Y.C.; Poindexter, John R.; Adams-Huet, Beverley; Pearle, Margaret S. (2003). "Predictive value of kidney stone composition in the detection of metabolic abnormalities". The American Journal of Medicine. 115 (1): 26–32. doi:10.1016/S0002-9343(03)00201-8. PMID 12867231.



