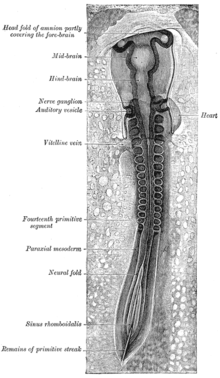
소마이트
Somite| 소마이트 | |
|---|---|
 45시간 배양된 병아리 배아의 반쪽 횡단부. 배아의 등지(뒷면) 표면은 이 페이지의 상단을 향하고, 배지(앞면) 표면은 하단을 향한다. | |
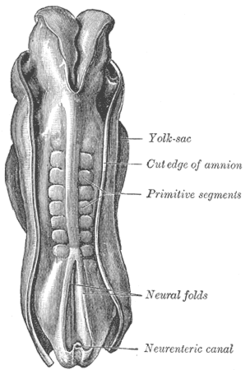 인간 배아의 등심, 길이 2.11mm. (원시분절은 소마이트를 식별하는 데 사용된다.) | |
| 세부 사항 | |
| 카네기 무대 | 9 |
| 날들 | 20[1] |
| 전구체 | 근축중추 |
| 낳다 | 피부과, 근위축, 스클러토메 |
| 식별자 | |
| 라틴어 | 명예의 |
| 메슈 | D019170 |
| TE | E5.0.2.2.2.0.3 |
| FMA | 85522 |
| 해부학적 용어 | |
소마이트(구식 용어: 원시 세그먼트)는 분절된 동물에서 머리부터 꼬리까지의 축을 따라 소마제 발생의 배아 단계에서 형성되는 쌍방향으로 쌍방향으로 짝을 이룬 두 개의 근축 중층이다. 척추동물에서, 소미이트는 척추, 늑골, 후두골의 일부인 척추뼈, 골격근, 연골, 힘줄, 피부(뒷면)의 척추뼈, 골격근, 골격근, 피부(뒷면)로 세분된다.[2]
소마이트라는 단어는 메타메르라는 단어 대신에 쓰이기도 한다. 이 정의에서 소마이트는 안절부나 절지동물에서 볼 수 있는 것과 같이 동물 신체 계획에서 동질적으로 손상된 구조물이다.[3]
개발
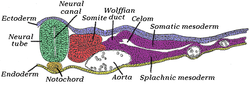
중간막은 다른 두 개의 세균층인 엑토더름과 엔도더름과 동시에 형성된다. 신경관 양쪽에 있는 중추를 근축중추라고 한다. 노토코드가 되는 코드메소더름이라고 불리는 신경관 밑의 중간자와 구별된다. 근축 중추는 처음에 병아리 배아에서 "분절판" 또는 다른 척추동물에서 "분절되지 않은 중절판"이라고 불린다. 원시적인 줄무늬가 퇴행하고 신경주름이 모여들면서(결국 신경관이 되기 위해), 근축중간막은 소마이트라고 불리는 블록으로 분리된다.[4]
포메이션
소말리아성 이전의 메소드롬은 메소드름이 소마이트를 형성할 수 있게 되기 전에 소말리아적 운명에 맡긴다. 각 소마이트 내의 셀은 소마이트 내의 위치를 기준으로 지정된다. 게다가, 그들은 소변생성 과정에서 비교적 늦은 시간까지 어떤 종류의 소변에서 파생된 구조물이 될 수 있는 능력을 가지고 있다.[4]
솜털의 개발은 시계와 파동전면 모델에 의해 설명되는 시계 메커니즘에 의존한다. 모델에 대한 한 가지 설명에서, 진동 Natch와 Wnt 신호는 시계를 제공한다. 파동은 FGF 단백질의 경사로로서 회전에서 카우달(꼬리 경사로 없음)까지이다. 소미테는 배아의 길이를 따라 머리에서 꼬리까지 차례로 형성되며, 각각의 새로운 소미테는 이전 소미테의 꼬리 부분에 형성된다.[5][6]
그 간격의 타이밍은 보편적이지 않다. 종마다 간격 타이밍이 다르다. 병아리 배아에서는 90분마다 소마이트가 형성된다. 마우스에서 간격은 가변적이다.
일부 종의 경우 발육률이 온도나 다른 환경적 요인에 의해 영향을 받을 수 있기 때문에 배아 발달 단계를 임신 후 시간보다 더 신뢰성 있게 결정하기 위해 소민 수를 사용할 수 있다. 신경관의 양쪽에 동시에 소마이트가 나타난다. 세포의 운명은 소미생식에 앞서 결정되었기 때문에, 발달하는 소미트의 실험적인 조작은 소미트의 회전/주석 방향을 바꾸지 않는다. 소마이트 형성은 노긴 세포를 통해 유도될 수 있다. 솜사이의 수는 배아 크기에 따라 다르며 독립적이다(예를 들어 수술이나 유전공학을 통해 변형된 경우). 닭 배아는 50개의 소미트를 가지고 있다; 쥐는 65개의 소미트를 가지고 있는 반면, 뱀은 500개의 소미트를 가지고 있다.[4][7]
근축중추 내의 세포들이 함께 모여들기 시작하면서 소미토메레스라고 불리며, 이는 부분들 사이의 완전한 분리가 없음을 나타낸다. 외세포는 각 소마이트 주위에 상피를 형성하기 위해 중간-상피 전이 과정을 거친다. 내세포는 메센치메스로 남아있다.
노치 신호 전달
노치 시스템은 시계와 파동전선의 일부로서 소마이트의 경계를 형성한다. DLL1과 DLL3는 노치 리간드로, 변이가 발생하여 다양한 결함을 발생시킨다. 노치는 소마이트의 카우달 반을 설정하는 HES1을 조절한다. 노치 활성화는 LFNG를 작동시켜 노치 수용체를 억제한다. 노치 활성화는 또한 LFNG를 비활성화하는 HES1 유전자를 켜서 노치 수용체를 다시 활성화하고, 따라서 진동 클럭 모델을 고려한다. MESP2는 EPHA4 유전자를 유도하여 분할을 일으켜 소마이트를 분리하는 반발작용을 일으킨다. EPHA4는 소마이트의 경계로 제한된다. EPHB2는 또한 경계를 위해 중요하다.
중간-상피 전이
피브로넥틴과 N-카데린은 발달하는 배아에서 중간-상피 전이 과정의 핵심이다. 이 과정은 아마도 파라축과 MESP2에 의해 조절될 것이다. 다시, MESP2는 노치 신호에 의해 조절된다. 파축은 시토스켈레톤과 관련된 공정에 의해 조절된다.
사양
홉스 유전자는 소미테스가 발생하기 전에 소미테스 전(前) 소미테스(somatic medoderm)를 명시하여 전(前)-후(後) 축을 따라 위치를 기준으로 소미테를 전체적으로 규정한다. 소미테를 만든 후, 한 지역에서 완전히 다른 지역으로 소미테를 이식하면 원래 지역에서 주로 관찰되는 구조가 형성된다는 사실에서 알 수 있듯이, 소미테의 전체적 정체성은 이미 결정되었다. 대조적으로, 각 체내 세포들은 체내 발달이 비교적 늦을 때까지 가소성(어떤 종류의 구조를 형성하는 능력)을 유지한다.[4]
파생상품
발달한 척추동물 배아에서는 소미테가 갈라져 피부과, 골격근(묘토메), 힘줄과 연골([8]신디토메트), 골격(sclerotom)을 형성한다.
스클러로톰은 피부과 근섬유가 있기 전에 구별되기 때문에 데르모모톰이라는 용어는 피부과 근섬유가 분리되기 전에 결합되는 것을 말한다.[9]
피부과
피부과는 근막중간소마이트의 등측부위로 피부(피부)를 발생시킨다. 인간 배아에서 그것은 발생의 셋째 주에 발생한다.[2] 더마묘토메(슬레로돔이 이동하면 남은 소미트)가 갈라져 피부과 근섬유가 형성될 때 형성된다.[2] 피부암은 목과 몸통의 피부, 지방, 결합조직에 기여하지만, 대부분의 피부는 측면 판 중간에서 유래한다.[2]
묘토메
근섬유는 동물의 근육을 형성하는 소마이트의 그 부분이다.[2] 각 묘좀은 후축 부분(epmere)과 후축 부분(hypemere), 앞쪽에 하이포메르(hypomere)로 나뉜다.[2] 저축 분할에서 나온 근막은 흉부와 앞 복벽의 근육을 형성한다. 후두근의 질량은 포유류의 목과 줄기의 확장근육을 형성하기 위해 그 부분적인 성격을 잃는다.
물고기, 도롱뇽, 카실리아인, 파충류에서 체내 근육조직은 종종 접히고 겹쳐지지만 배아에서와 같이 분절된 상태로 남아 있으며, 후축질량과 경축질량은 몇 개의 뚜렷한 근육군으로 나뉜다.[citation needed]
글레로돔
척추와 늑골 연골과 후두골의 일부를 형성하고, 근검은 등, 늑골, 팔다리의 근육 조직을 형성하며, 신디톰은 힘줄을 형성하고 피부과는 등을 형성한다. 또한, 소마이트는 신경 파고 세포의 이동 경로와 척추 신경의 축을 명시한다. 소마이트 내의 초기 위치에서, sclerotome 세포는 notochord를 향해 내적으로 이동한다. 이 세포들은 다른 쪽에서 온 경골세포와 만나 척추체를 형성한다. 한 스클러토옴의 하반부는 인접한 스클러토옴의 상반신과 결합하여 각 척추체를 형성한다.[10] 이 척추체에서, 척수세포는 뒤틀리게 움직이며 발달하는 척수를 둘러싸고 척추 아치를 형성한다. 다른 세포들은 늑골을 형성하기 위해 흉추의 비용적 과정으로 원위적으로 움직인다.[10]
절지동물에서
갑각류 발달에서 소마이트는 가상의 원시 갑각류 체계의 한 부분이다. 현재의 갑각류에서는 그 중 몇 개가 융합되어 있을 수 있다.[citation needed]
참고 항목
참조
- ^ "The Third Week Of Life". Retrieved 2007-10-13.
- ^ a b c d e f Larsen, William J. (2001). Human embryology (3. ed.). Philadelphia, Pa.: Churchill Livingstone. pp. 53–86. ISBN 978-0-443-06583-5.
- ^ "Metamere". Dictionary and Thesaurus-Merriam-Webster Online. Merriam-Webster. 2012. Retrieved 11 December 2012.
- ^ a b c d Gilbert, S.F. (2010). Developmental Biology (9th ed.). Sinauer Associates, Inc. pp. 413–415. ISBN 978-0-87893-384-6.
- ^ Baker, R. E.; Schnell, S.; Maini, P. K. (2006). "A clock and wavefront mechanism for somite formation". Developmental Biology. 293 (1): 116–126. doi:10.1016/j.ydbio.2006.01.018. PMID 16546158.
- ^ Goldbeter, A.; Pourquié, O. (2008). "Modeling the segmentation clock as a network of coupled oscillations in the Notch, Wnt and FGF signaling pathways". Journal of Theoretical Biology. 252 (3): 574–585. doi:10.1016/j.jtbi.2008.01.006. PMID 18308339.
- ^ Gomez, C; et al. (2008). "Control of segment number in vertebrate embryos". Nature. 454 (7202): 335–339. Bibcode:2008Natur.454..335G. doi:10.1038/nature07020. PMID 18563087. S2CID 4373389.
- ^ Brent AE, Schweitzer R, Tabin CJ (April 2003). "A somitic compartment of tendon progenitors". Cell. 113 (2): 235–48. doi:10.1016/S0092-8674(03)00268-X. PMID 12705871. S2CID 16291509.
- ^ "med.unc.edu". Retrieved 2007-10-19.
- ^ a b 워커, 워렌 F. 주니어(1987) 척추동물 샌프란시스코의 기능 해부학: 손더스 칼리지 출판.