크로낙시
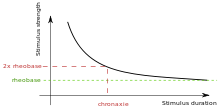
Chronaxie크로낙시는 전류가 근육이나 뉴런을 자극하는 데 필요한 최소 시간이다. Rheobase는 근육이나 신경을 자극한 맥박 지속시간이 비한정인 가장 낮은 강도다.[1] 크로낙시는 셀 내 전압 정량 나트륨 채널의 밀도에 따라 달라지는데, 이는 셀의 흥분성에 영향을 미친다. 크로낙시는 조직의 종류에 따라 다르다: 빠른 트위치 근육은 낮은 크로낙시를 가지고 있고, 느린 트위치 근육은 더 높은 크로낙시를 가지고 있다. 크로낙시는 흥분성 조직의 자극을 위한 최적의 자극 펄스 지속시간을 선택할 수 있는 조직-흥분성 매개변수다. 크로낙시(c)는 무한장기 자극 펄스의 임계값 전류인 두 개의 로바시치 (b) 강도의 전류에 대한 자극 펄스 지속시간의 라픽케 설명자다. Lapicque는 다음과 같은 두 가지 수량(c,b)이 전류의 강도 지속 곡선을 정의한다는 것을 보여주었다. I = b(1+c/d), 여기서 d는 펄스 지속시간이다. 그러나 자극을 설명하기 위해 사용되는 두 가지 다른 전기적 매개변수가 있다: 에너지와 전하. 최소 에너지는 시간연속과 동일한 펄스 지속시간에 발생한다. 최소 전하(BC)는 무한히 짧은 시간 펄스와 함께 발생한다. 10c와 동일한 펄스 지속시간을 선택하려면 rheobase(b)보다 10%만 높은 전류가 필요하다. 0.1c의 펄스 지속시간을 선택하려면 최소 충전량(bc)보다 10% 높은 충전이 필요하다.
역사
크로낙시(renonaxie)와 뢰바세(rheobase)라는 용어는 1909년에 출판된 루이 라피크(Louis Lapicque)의 유명한 Définition expérimentale de l'execitabilité)에 관한 논문에서 처음 만들어졌다.[2]
위의 I(d) 곡선은 일반적으로 Weiss(1901)에 기인한다. 예: (Rattay 1990) 참조. 현재 강도의 지속시간에 대한 의존성을 나타내는 2개의 '단순' 수학적 서술자 중 가장 단순하며, d:로 와이스의 선형 전하 진행으로 이어진다.
라피크 자신의 글과 더 최근의 작품 모두 선형 전하 근사치와 대립하고 있다. 이미 1907년에 라픽케는 단일-RC 등가 회로를 사용하여 모델링한 세포막의 선형 1차 근사치를 사용하고 있었다. 따라서 다음과 같다.
여기서 τ= R 은(는) 막 시간 상수 - 1차 선형 막 모델에서:
- v + R= I C 여기서 V- - -
크로낙시(c)는 여기에 명시적으로 존재하지 않는다는 점에 유의하십시오. 또한 Taylor 지수 분해(약 d=0)에 의한 매우 짧은 지속 d .
일정한 충전 근사치로 이어진다. 후자는 또한 이온 채널 탕구 메커니즘과 세포내 전류 흐름을 고려한 더 복잡한 흥분성 막 모델을 잘 적합시킬 수 있으며, 이는 두 가지 간단한 공식에서 벗어나는 주요 원인이 될 수 있다.
이러한 '하위'는 라피크(1907년, 1926년, 1931년)에 의해 명확하게 설명되지만, 위스 수준을 강조했던 게데스(2004)가 라피크에 귀속시켜 그리 잘 설명하지는 못한다.
측정
관심 있는 근육에 전극을 삽입한 다음 표면 전류를 사용하여 자극을 받는다. 과호흡으로 인한 크로낙시 값의 증가는 피부 임피던스의 변화로, 이러한 변화를 일으키는 생리학적 요인들이 자율신경계의 영향을 받고 있기 때문이라고 할 수 있다. 피부와 기저 조직의 상태가 경피 자극에 의한 연대기 측정 결과를 판단할 때 주의할 수 있는 선행 영향의 예.[3] 링거 용액에 직립하여 전극과 직접 접촉하지 않고 용액을 통해 자극하는 신선하고 정상적인 사토리우스에는 두 개의 매우 뚜렷한 강도 지속 곡선이 나타나게 되는데, 그 중 하나는 수백분의 1초 이상에 걸쳐 퍼져 있다.[4]
가치
체온에서 포유류 심실의 크로낙시 값은 0.5 ms(인간)에서 2.0 4.1 ms(개)까지이며 이는 8.2/1 비율이다. 지름이 큰 마이애미티드 액손은 50~100µs, 30~200µs의 시간대를 가지며, 뉴런 세포체 및 덴드라이트는 1~10ms 또는 심지어 30ms의 시간대를 갖는다고 보고되었다. 회백질의 연대기는 380 +/- 191 ms, 200 ± 700 ms로 보고되었다. 연대기 시간의 해석은 추가 요인에 의해 더욱 혼동된다. 소마와 덴드라이트에 대해 보고된 크로낙시 시간은 세포 내 펄스를 사용하여 설정되었으며, 이는 세포 내 자극에 쉽게 추론할 수 없다. 문헌에 보고된 데이터는 인간의 생리적 한계치로서 운동 반응을 이용하거나 동물의 행동 잠재력 생성을 이용한다. 이것들은 주로 매크로 전극을 통한 자극에 바탕을 두고 있는데, 인간의 경우 1.5 X 1.2 mm DBS 전극이다. 미세 전극 자극과 감각 시상하부의 생리학적 매핑에서 도출된 데이터는 부족하다. 두 자극 방법은 유의하게 다른 결과를 초래할 수 있다. 얼얼함과 같이 주관적인 지각에 관여하는 신경 원소를 이해하는 것이 중요한 생리학적 영향을 미치기는 하지만, 만성적인 시간을 감각 지각과 연관시키려는 연구는 거의 없다.[5] 측정은 다른 유형의 전극과 알 수 없는 출력 임피던스를 가진 자극기로 수행되었다. 인간의 팔 감각 신경에 대한 연대기 값은 0.35 ~ 1.17 ms로 3.3의 비율이다. 변동성의 원인을 규명하기에 불충분한 정보로 그 값을 얻었다. 인간 탈구골격근에 대한 연대기 값은 체온에서 9.5~30ms이며 3.16의 비율을 나타낸다. 연대표의 감소는 재신경절약 중에 발생한다. 크로낙시에 대해 발표된 값은 범위가 넓다. 크로낙시가 균질 조직 표본에서 조직 소비성을 가장 잘 설명하는 경우 알려진 온도에서 직사각형 음극 자극 파형을 제공하는 정전류 자극기로 결정해야 한다. 크로낙시는 전류의 강도 지속 곡선에서 도출되며 자극 지속시간이 크로낙시보다 짧을 경우, 어떤 유형이나 위치에 있든 알려진 출력 임피던스의 자극기가 있는 전극을 자극하기 위해 더 많은 전류가 필요하다는 것을 보여준다. 또한 연대기 값은 결정되더라도 최소 에너지의 펄스 지속시간을 식별한다. 게다가 크로낙시에 배달되는 요금은 아무리 결정되어도 최소 요금의 2배인 2배다. 따라서 삽입된 자극기에서 배터리 수명을 연장하기 위해 최소 충전 배달이 필요한 경우 측정된 크로낙시보다 작은 펄스 지속시간을 선택해야 한다. 10분의 1의 지속 시간은 최소 충전량보다 겨우 10% 높은 충전을 제공한다.[6]
자극
전기자극과 자기자극은 서로 다른 감각을 만들어냈다. 전기 자극의 경우 감각은 일반적으로 피부 표면의 전극 바로 아래에 국부적으로 표현되었다. 자력 자극의 경우, 감각은 일반적으로 손바닥과 손의 숫자 전체에 분포하는 것으로 설명되었다. 특히, 대부분의 피험자는 안쪽 또는 옆쪽 숫자로 감각을 보고하였다. 이러한 관찰은 전기 자극이 피하지방 신경섬유를 우선적으로 활성화할 수 있는 반면 자기 자극은 척골이나 중앙 신경과 같은 심층 신경을 우선적으로 활성화시킬 수 있음을 시사한다.
운동 대 감각
다른 연구에서는 팔과 다리의 근내신경섬유의 자기 활성화가 전기자극보다 낮은 문턱에서 발생한다는 것을 신경과 근육조직의 자극을 통해 입증된 전기자극과 자기자극을 이용한 감각과 운동섬유의 활성화를 비교하였다. 또한 감각섬유는 전기자극의 문턱이 낮은 것으로 나타났다. 손목의 전기 자극은 짧은 펄스를 사용할 때(200μs 미만) 운동 섬유가 더 쉽게 흥분하는 반면 긴 펄스 지속시간(1000μs 이상)의 경우 감각 섬유가 탈극화되기 쉽다고 판단한다. 이와 관련된 관찰은 전기 자극이 긴 펄스 지속에 대해서는 모터 섬유에 비해 감각 섬유를 우선적으로 활성화하고, 짧은 펄스 지속에 대해서는 반대로 활성화한다는 것이다. 자력 자극의 경우, 운동섬유 문턱이 감각섬유보다 낮았다.[7]
의의
크로낙시의 주요 가치는 동일한 표준을 사용하여 서로 다른 실험과 측정의 흥분성을 비교함으로써 데이터 비교를 더 쉽게 하는 것이다. 크로낙시에 기반한 전기 자극은 절연된 근육 섬유에서 myoD 유전자 발현을 조절할 수 있었다. 표면 전극을 이용한 전기 자극에 의해 유도되어 근육의 흥분성에 기초하여 격일간에 적용되는 20개의 근육 수축은 인간의 임상 재활에 사용되는 프로토콜과 유사하게 축적되는 것을 줄일 수 있었다. myoD 내 mRNA와 탈지근육의 atrogin-1, 이 표현들은 각각 근육 성장과 위축과 관련이 있다. 보존 후 myoD 레벨의 증가는 위성 셀의 활성화와 확산뿐만 아니라 셀 사이클의 조절과도 관련이 있을 수 있다. 몇몇 연구들은 방전 유도 근면증의 기능이 방전에 의해 유도된 근육 위축을 예방하는 것일 수 있다고 제안했다.[8] 쇠약해진 다리 근육의 수축성을 평가하기 위해, 레호바제와 크로낙시는 표면 전기 자극과 다리 근육의 팰립에 의해 마취된 쥐에서 결정되었다. TA근육의 연대기 값은 비절제술 후 최대 9개월까지 측정되었다. 근육의 흥분성은 보존 후 일찍 감소하였다. 내측근에서 0.1~0.2ms였던 크로낙시는 보존 후 1~2일 이내에 0.5~1ms(즉, 월레리아식 신경 퇴화 후)로 바뀌었고, 그 다음 달에는 점차적으로 약 20ms로 증가했다. 크로낙시는 시 절제 후 6개월까지 이 수준을 유지했다(랫드 모델의 중간 보존 단계: 2개월에서 6개월까지). 그 후, 경련 수축은 의심의 여지없이 뚜렷해졌고 따라서 연대기는 훨씬 더 긴 값으로 증가하였다(50ms에서 인피니텀으로, 즉 근육 경련은 뚜렷하지 않았다). 이 3단계는 랫드 모델의 "장기 보존 단계"로 정의된다. 즉, 6개월 이상의 보존 시간). 36개 다리 근육 중 3개에서 재신경전이 자연발생적으로 발생했고 크로낙시는 정상 내측근의 가치인 0.1ms로 단축됐다.
의료용
크로낙시 및 호기성 값의 의료적 적용은 골격근에서 발생하는 전기적 활동을 평가하고 기록하는 기술인 전기자기술이다. Rheobase가 반드시 선택의 전류는 아닐 수도 있다. 전자기술은 신경병, 근병, 신경근육 접합 질환을 진단하는 데 사용된다.
SCI에 영향을 받은 사람들은 근육 영양/기능을 유지하거나 향상시키기 위해 FES로 치료될 수 있기 때문에 장기적 변위 근육에서 흥분성 근육 섬유의 존재는 FES로 치료하는 데 매우 중요할 수 있다. 물론 장기 환자의 풀은 매년 새로운 환자 수를 초과하며, 척수 손상 후 오랜 기간이라도 시작할 수 있는 옵션, 즉 표면 또는 근육 내 전극에 의한 직접적인 전기 자극에 의해 기계적인 근육의 결함을 감지할 수 없고 시작 선택과 동기 부여를 강력하게 지원할 수 있는 시점에 발생한다.이러한 중요한 과목에서 평생 FES 운동 활동을 수행하는 방법.[9][10]
질병.
크로낙시는 저포파성 항진증의 테타니에서 증가한다. 단, 전기 반응의 x.c.에 해당하는 rheobase이며 확실한 감소를 보여주는 rheobase임을 기억해야 한다. 로보아제는 자극된 운동점의 소비성 상태뿐만 아니라 두 전극 사이의 전기 저항성에 대한 값에 따라 달라지며, 따라서 테타니의 로보아제 감소는 피부의 전기 저항 감소 이상을 의미하지 않을 수 있다. 그러나 이러한 반응이 자기 기만신경을 통한 반사작용이라는 것이 아니라면 그러한 저항의 변화가 어떻게 기계적 자극에 대한 흥분성을 증가시킬 수 있는지 알기는 어렵다. 반면 크로낙시는 신경저항이 아니라 흥분과정의 시간관계에 따라 달라지며, 크로낙시가 증가하면 부갑상선 절제술에서와 같이 로백제의 2배 강도는 정상보다 긴 기간 동안 조직에 작용해야 흥분과정이 진행된다는 것을 의미한다..[11]
약물 상호작용 및 독소
알드린으로 쥐를 급성 중독시키면 만성피폭은 감소하는 반면, 이 염소화 탄화수소 살충제에 만성피폭은 역효과를 낸다. 쥐를 에폭시드와 밀접한 관련이 있는 데질린에 만성적으로 노출시키는 것은 작업 운동을 할 때 그들의 근육 효율을 감소시키는 것이 제안되었다. Dieldrin은 한때 농작물 보호와 보존에 널리 사용되었던 염소 처리된 탄화수소 살충제다. 도취로 인한 다양한 증상으로는 근육 경련이 있는데, 의식 상실로 간질성 경련까지 심해진다. 척추 활동 거점이 있는 스트라이치닌은 생쥐에게 강장성 뒷다리 확장을 유발하는데, 이는 확장근육으로 가는 신경통로에 대한 억제성 내부동맥류의 효과가 제거되었기 때문인 것으로 생각된다. 반면 렙타졸은 주로 뇌 구조물에 대한 흥분 작용에 의해 유사한 강장제 연장을 만들어 낸다. 디페닐하이드란토인은 렙타졸의 문턱 경련선량을 선택적으로 증가시켰지만 스트리치닌 염산염의 문턱 경련선량은 증가시키지 않았으며, 이는 렙타졸의 주요 활동 거점과 뒷다리 사이의 신경 경로에서 항경련성 활성을 나타낸다.[12]
참고 항목
참조
- ^ Irnich W (1980). "The Chronaxie Time and Its Practical Importance". Pacing and Clinical Electrophysiology. 3 (3): 292–301. doi:10.1111/j.1540-8159.1980.tb05236.x. PMID 6160523.
- ^ Irnich W (2010). "The Terms "Chronaxie" and "Rheobase" are 100 Years Old". Pacing and Clinical Electrophysiology. 33 (4): 491–496. doi:10.1111/j.1540-8159.2009.02666.x. PMID 20132498.
- ^ Dijkstra B, Dirken MN (1939). "The effect of forced breathing on the motor chronaxie". J. Physiol. 96 (2): 109–17. doi:10.1113/jphysiol.1939.sp003761. PMC 1393855. PMID 16995119.
- ^ Lapicque L (1931). "Has the muscular substance a longer chronaxie than the nervous substance?". The Journal of Physiology. 73 (2): 189–214. doi:10.1113/jphysiol.1931.sp002806. PMC 1394320. PMID 16994237.
- ^ Anderson; et al. (2003). "Neural substrates of microstimulation-evoked tingling: a chronaxie study in human somatosensory thalamus" (PDF). European Journal of Neuroscience. 18 (3): 728–732. doi:10.1046/j.1460-9568.2003.02793.x. PMID 12911770.
- ^ Geddes L. A. (2004). "Accuracy Limitations of Chronaxie Values" (PDF). IEEE Transactions on Biomedical Engineering. 51 (1): 176–181. doi:10.1109/tbme.2003.820340. PMID 14723507.[영구적 데드링크]
- ^ 크로닉, B. A., 레코스키, B. J., 숄, T. J. (2009) 자기장 자극과 전기장 자극을 사용하여 측정한 인간 말초신경 크로네시 시간 사이의 불일치: MRI 그라데이션 코일 안전과의 관련성. 물리. 메드. 비올. 54: 5965–5979. http://www.imaging.robarts.ca/scholl/sites/imaging.robarts.ca.scholl/files/2.pdf에서 검색됨 웨이백 머신에 보관된 2014-02-07
- ^ Freria; et al. (2007). "Electrical stimulation based on chronaxie reduces atrogin-1 and myod gene expression in denervated rat muscle". Muscle Nerve. 35 (1): 87–97. doi:10.1002/mus.20668. PMID 17034040.
- ^ 아다미 외 (2007) 쌍방편절제술 후 랫드 티비알리스 전방의 영구보존: 최대 1년까지 위축이 진행되는 동안 표면 전극 자극에 의한 연대기 측정. 기본 Apple Myol 17(6): 237-243. http://www.bio.unipd.it/bam/PDF/17-6/Adami.pdf에서 검색됨
- ^ Kern H, Carraro U, Adami N, Biral D, Hofer C, Forstner C, Mödlin M, Vogelauer M, Pond A, Boncompagni S, Paolini C, Mayr W, Protasi F, Zampieri S (Oct 2010). "Home-based functional electrical stimulation rescues permanently denervated muscles in paraplegic patients with complete lower motor neuron lesion". Neurorehabil Neural Repair. 24 (8): 709–21. doi:10.1177/1545968310366129. PMID 20460493. S2CID 5963094.
- ^ Buchanan D. N.; Garven H. S. D. (1926). "Chronaxie in tetany. The effect on the chronaxie of thyreoparathyreoidectomy, the administration of guanidin and of di-methyl guanidin". J Physiol. 62 (1): 115–128. doi:10.1113/jphysiol.1926.sp002343. PMC 1514884. PMID 16993824.
- ^ 나토프 L., 레이프, B. (1967) 쥐와 생쥐의 크로낙시 및 경련 임계값에 대한 데드린(heod)의 영향. J. 약리학 화학요법 31: 197-204 http://onlinelibrary.wiley.com/doi/10.1111/j.1476-5381.1967.tb01990.x/pdf에서 검색됨


 (는) 막 시간 상수 - 1차 선형 막 모델에서:
(는) 막 시간 상수 - 1차 선형 막 모델에서: 





