체모스타트
Chemostat| 체모스타트 | |
|---|---|
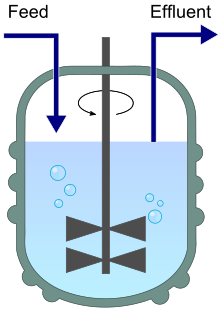 유입(피드) 및 유출(유출)이 특징인 체모스타트 다이어그램. | |
| 산업 | 생물 공학 |
| 어플 | 조사 및 산업 |

체모스타트(화학환경이 정적인 것)는 신선한 배지를 연속적으로 첨가하고, 영양소, 대사 최종물 및 미생물을 포함한 배양액을 동일한 속도로 연속적으로 제거하여 배양량을 [2][3]일정하게 유지하는 생물반응기이다.생물반응기에 배지를 첨가하는 속도를 변경함으로써 미생물의 비증식률을 제한 범위 내에서 쉽게 제어할 수 있다.
작동
정상 상태
체모스트랫의 가장 중요한 특징 중 하나는 미생물이 일정한 환경 조건하에서 생리적으로 안정된 상태로 자랄 수 있다는 것이다.이 정상 상태에서 성장은 일정한 특정 성장률로 이루어지며 모든 배양 매개 변수(배양 부피, 용존 산소 농도, 영양소 및 제품 농도, pH, 세포 밀도 등)는 일정하게 유지됩니다.또한 환경조건은 [4]실험자에 의해 제어될 수 있습니다.체외에서 자라는 미생물은 보통 성장률과 영양소 소비 사이의 부정적인 피드백 때문에 안정된 상태에 도달한다: 만약 적은 수의 세포가 생물반응기에 존재한다면, 세포는 그들이 영양소를 거의 소비하지 않기 때문에 희석 속도보다 더 높은 성장 속도로 성장할 수 있기 때문에 제한의 추가에 의해 성장이 덜 제한된다. 신선한 배지를 주입한 영양소.제한 영양소는 성장에 필수적인 영양소로, 제한 농도로 배지에 존재합니다(다른 모든 영양소는 보통 잉여로 공급됩니다).그러나 세포수가 많을수록 영양소 섭취량이 많아져 제한영양소 농도는 낮아진다.이것은 세포들의 특정 성장률을 감소시켜 세포들이 유출과 함께 시스템에서 계속 제거되기 때문에 세포들의 수가 감소하게 될 것이다.그 결과, 안정된 상태가 됩니다.자율조절 덕분에 안정된 상태를 유지할 수 있습니다.이를 통해 실험자는 신선한 배지를 용기에 공급하는 펌프의 속도를 변경하여 미생물의 비증식 속도를 조절할 수 있다.
잘 혼합된
체모스타트와 다른 연속 배양 시스템의 또 다른 중요한 특징은 그것들이 잘 섞여서 환경 조건이 균일하거나 균일하고 미생물이 랜덤하게 분산되어 서로 랜덤하게 마주친다는 것이다.따라서 경쟁과 체모스타트의 다른 상호작용은 바이오 필름과 대조적으로 글로벌하다.
희석률
영양소 교환 속도는 희석 속도 D로 표현된다.정상상태에서 미생물의 비증식속도μ는 희석속도D와 같다.희석 속도는 생물반응기의 배양 부피 V에 대한 시간 단위당 배지 흐름 F로 정의된다.
최대 성장률 및 임계 희석률
비증가율 μ은 바이오매스가 두 배로 증가하는 데 걸리는 시간과 반비례합니다(배증시간d t라고 함).
따라서 두 배 시간d t는 정상 상태에서 희석 속도 D의 함수가 됩니다.
특정 기질에서 자라는 각 미생물은 최대 비성장률max μ(생장이 외부 영양소가 아닌 내부 제약에 의해 제한될 경우 관찰되는 성장률)을 가진다.μ보다 높은max 희석율을 선택하면 세포가 제거되는 속도만큼 빠르게 성장할 수 없기 때문에 배양물이 생물반응기에서 지속되지 못하고 씻겨 나간다.
그러나 체모스타트의 제한영양소 농도는 사료의 농도를 초과할 수 없기 때문에 체모스타트에서 세포가 도달할 수 있는 비성장률은 보통 최대 비성장률보다 약간 낮습니다. 왜냐하면 보통 키네에 의해 설명되는 영양소 농도와 함께 증가하기 때문입니다.모노드 방정식의 [citation needed]틱스.세포가 얻을 수 있는 가장 높은 비성장률(μmax)은 임계희석률(D')c과 같다.
여기서 S는 체모스타트의 기질 또는 영양소S 농도이고 K는 반포화 상수이다(이 방정식은 모노드 역학을 가정한다.
적용들
조사.
연구의 체모스타트는 균일한 세포나 단백질의 대량 공급원으로서 세포 생물학 연구에 사용된다.체모스타트는 종종 유기체의 신진대사 과정과 관련된 수학적 모델을 생성하기 위해 유기체에 대한 정상 상태 데이터를 수집하는데 사용됩니다.체모스타트는 생태학이나 [7][8][9][10]진화생물학에서도[5][6] 소장으로 사용된다.한 가지 경우에는 돌연변이/선택이 성가신 경우이고, 다른 경우에는 연구 중인 바람직한 공정입니다.체모스타트는 또한 보조영양이나 추가적인 과학적 [11]연구를 위해 항생제나 박테리오파지에 내성이 있는 배양 내 특정 유형의 박테리아 돌연변이를 풍부하게 하기 위해 사용될 수 있습니다.희석률의 변화는 생물이 다른 [12][13]성장률로 추구하는 대사 전략을 연구할 수 있게 한다.
단일 및 다중 자원의 경쟁, 자원 획득 및 이용 경로의 진화, 교차 공급/상징,[14][15] 적대감, 포식자 간의 경쟁은 모두 체모스타트를 [16][17][18]사용한 생태학 및 진화 생물학에서 연구되어 왔다.
산업
체모스타트는 에탄올의 산업 제조에 자주 사용됩니다.이 경우, 여러 개의 체모스타트가 연속적으로 사용되며, 각 체모스타트는 설탕 [citation needed]농도를 낮추도록 유지됩니다.체모스타트는 또한 생명공학 [13]산업에서 연속적인 세포 배양에 대한 실험 모델 역할을 한다.
기술적인 문제
- 거품은 액체의 부피가 일정하지 않은 상태로 넘치게 됩니다.
- 몇몇 매우 약한 세포들은 교반과 통기 중에 파열된다.
- 세포는 벽에서 자라거나 다른 [19]표면에 부착될 수 있으며, 이는 용기의 유리 벽을 소수성으로 만들기 위해 실란으로 처리함으로써 극복할 수 있습니다.단, 벽에 부착할 셀은 시스템에서 제거되지 않으므로 벽에 부착할 셀이 선택됩니다.생체막을 형성하는 벽에 단단히 달라붙는 박테리아는 체외 조건에서 연구하기 어렵다.
- 혼합은 실제로 균일하지 않을 수 있으며, 체모스타트의 "정적" 특성을 손상시킬 수 있습니다.
- 미디어를 챔버에 떨어뜨리는 것은 실제로 작은 영양소 펄스를 발생시켜 농도의 진동을 일으켜 체모스타트의 "정적" 특성을 다시 악화시킵니다.
- 박테리아는 꽤 쉽게 상류로 이동한다.배지가 공기를 통해 낙하하는 공기 차단으로 인해 액체 경로가 중단되지 않는 한 배지는 신속하게 멸균 배지의 저장고에 도달합니다.
각각의 결함을 고치려는 지속적인 노력은 매우 정기적으로 기본 체형에 변화를 가져옵니다.문헌의 예는 많다.
- 거품을 억제하기 위해 발포방지제를 사용한다.
- 교반과 통기는 부드럽게 할 수 있다.
- 벽의[20][21] 성장을 줄이기 위해 많은 접근법이 취해졌습니다.
- 다양한 응용 프로그램에서 패들, 버블링 또는 기타 혼합 메커니즘을[22] 사용합니다.
- 작은 방울과 큰 용기 부피로 액체 방울을 덜 거칠게 만들 수 있습니다.
- 많은 개선 사항이 오염의 위협을 목표로 한다.
실험 설계 고려 사항
이 섹션은 대부분 또는 전체적으로 단일 소스에 의존합니다.: · · · JSTOR (2019년 12월) |
파라미터 선택 및 설정
- 체모스타트에서 제한 기질의 정상 상태 농도는 유입 농도와 무관하다.유입 농도는 세포 농도에 영향을 미쳐 정상 상태 OD에 영향을 미칩니다.
- 체모스타트 내의 제한기판 농도는 통상 매우 낮고 이산적인 고농도 유입 펄스에 의해 유지되지만 실제로는 체모스타트 내의 농도의 시간적 변동은 작기 때문에 (수%이하) 준안정상태로 볼 수 있다.
- 세포 밀도(OD)가 정상 상태 값(오버슈트/언더슈트)으로 수렴하는 데 걸리는 시간은 특히 초기 접종이 클 때 종종 긴 시간(복수 체모스타트 턴오버)이 될 것이다.그러나 적절한 파라미터 선택으로 시간을 최소화할 수 있습니다.
안정된 성장
- 체모스타트는 안정된 상태로 보일 수 있지만 OD나 제품 농도와 같은 매크로 스케일 매개변수를 모니터링하여 검출할 수 없음에도 돌연변이 변형률 테이크오버가 지속적으로 발생할 수 있습니다.
- 제한 기질은 보통 농도가 너무 낮아 검출할 수 없습니다.그 결과 OD의 변화가 너무 작아 검출할 수 없는 경우에도 서로 다른 균주가 모집단을 차지하기 때문에 제한기판의 농도는 시간에 따라 크게 변화할 수 있다(백분율적으로).
- "펄스" 체모스타트(매우 큰 유입 펄스를 가진)는 제한 조건에서의 적합성이 향상된 돌연변이 균주의 경우 표준 준연속 체모스타트보다 상당히 낮은 선택 용량을 가진다.
- 유입제한 기판농도를 갑자기 낮춤으로써 체모스타트가 정상상태(희석속도 D의 시간순서)로 다시 안정될 때까지 일시적으로 세포에 비교적 가혹한 조건을 가할 수 있다.
돌연변이
- 돌연변이 균주의 일부는 빠르게 나타납니다.
- 다른 유형의 돌연변이 균주(예: 작은 표적 크기를 가진 두 개의 SNP, 더 많은 SNP 또는 더 작은 체모스타트)가 나타날 가능성은 매우 낮다.
- 이러한 다른 돌연변이는 건강상의 이점을 가진 돌연변이들의 연속적인 소탕을 통해서만 예상될 수 있다.각각의 돌연변이가 독립적으로 유익할 경우에만 여러 돌연변이가 발생할 것으로 예상할 수 있으며, 돌연변이가 개별적으로 중립적인 경우는 아니지만 함께 유리하다.연속적인 인수합병만이 진화를 위한 유일한 확실한 방법이다.
- 극단적으로 보이는 시나리오에서는 가능한 모든 SNP가 적어도1회 공존해야 합니다.큰 체모스타트가 이 상태에 도달할 가능성이 매우 높습니다.
- 유리한 돌연변이가 발생할 때까지의 예상 시간이 큰 체모스타트 회전 시간 정도인 경우.이 시간은 보통 유리한 균주가 체모스타트 집단을 인수하는 시간보다 상당히 짧습니다.이것은 작은 옷장에서 반드시 그렇지는 않다.
- 위의 점은 다른 무성 생식 종(대장균, 세레비시아 등)에 걸쳐 동일할 것으로 예상된다.
- 또한 돌연변이 출현까지의 시간은 게놈 크기에 의존하지 않지만 BP당 돌연변이율에 의존합니다.
- 특징적으로 큰 체스트의 경우, 과도한 변이 변형은 사용을 보증하기에 충분한 이점을 제공하지 않습니다.또한, 그것은 무작위 돌연변이를 통해 항상 나타나서 체모스타트를 차지할 것으로 예상할 만큼 선택적인 이점을 충분히 가지고 있지 않다.
단일 테이크오버
- 테이크오버 시간은 관련 변형률 매개변수를 고려할 때 예측할 수 있습니다.
- 다른 희석 속도는 다른 돌연변이 균주가 존재하는 경우 선택적으로 체모스타트 집단을 인수하는 데 유리하다.예를 들어 다음과 같습니다.
- 빠른 희석 속도는 최대 성장률이 높아진 돌연변이 균주에 대한 선택 압력을 생성한다.
- 중간 희석 속도는 제한 기질에 대한 친화력이 높은 돌연변이 균주에 대한 선택 압력을 생성한다.
- 느린 희석 속도는 (아마도 배지에 존재하는 다른 기판을 소비함으로써) 제한 기판이 없는 배지에서 성장할 수 있는 돌연변이 균주의 선택 압력을 생성한다.
- 상위 돌연변이의 테이크오버 시간은 다양한 동작 파라미터에 걸쳐 매우 일정합니다.특징적인 작동 값의 경우 인수 시간은 며칠에서 몇 주 정도입니다.
연속 인수
- 조건이 적절할 때(충분히 큰 개체군, 그리고 단순하게 유리한 돌연변이를 위한 게놈의 여러 표적) 여러 변종이 연속적으로 개체군을 흡수하고, 비교적 시간적, 페이싱 방식으로 그렇게 할 것으로 예상된다.타이밍은 돌연변이의 유형에 따라 달라집니다.
- 인수 승계에서는 각 균주의 선택적 개선이 일정하게 유지되더라도(예: 각각의 새로운 균주가 이전 균주보다 일정하게 개선됨), 인수율은 일정하게 유지되지 않고 오히려 변형률에서 변형률로 감소합니다.
- 대립 유전자의 빈도를 조사해도 균주를 구별하기 어려울 정도로 연속적인 테이크오버가 빠르게 일어나는 경우가 있습니다.따라서 연속된 균주의 다중 인수 계통은 돌연변이 코호트와 함께 단일 균주의 인수 계보로 나타날 수 있다.
바리에이션
체모스타트와 밀접하게 관련된 발효 설정은 터보스타트, 보조스타트 및 레텐토스타트이다.레텐토스타트에서는 배양액도 생물반응기에서 제거되지만 필터가 바이오매스를 유지한다.이 경우 바이오매스 유지에 필요한 영양소가 소비 가능한 제한 영양소의 양과 같아질 때까지 바이오매스 농도는 증가한다.
「 」를 참조해 주세요.
레퍼런스
- ^ Madigan, Michael (2015). Brock Biology of Microorganisms. Pearson. pp. 152–153. ISBN 978-0-321-89739-8.
- ^ Novick A, Szilard L (1950). "Description of the Chemostat". Science. 112 (2920): 715–6. Bibcode:1950Sci...112..715N. doi:10.1126/science.112.2920.715. PMID 14787503.
- ^ James TW (1961). "Continuous Culture of Microorganisms". Annual Review of Microbiology. 15: 27–46. doi:10.1146/annurev.mi.15.100161.000331.
- ^ D Herbert; R Elsworth; RC Telling (1956). "The continuous culture of bacteria; a theoretical and experimental study". J. Gen. Microbiol. 14 (3): 601–622. doi:10.1099/00221287-14-3-601. PMID 13346021.
- ^ Becks L, Hilker FM, Malchow H, Jürgens K, Arndt H (2005). "Experimental demonstration of chaos in a microbial food web". Nature. 435 (7046): 1226–9. Bibcode:2005Natur.435.1226B. doi:10.1038/nature03627. PMID 15988524. S2CID 4380653.
- ^ Pavlou S, Kevrekidis IG (1992). "Microbial predation in a periodically operated chemostat: a global study of the interaction between natural and externally imposed frequencies". Math Biosci. 108 (1): 1–55. doi:10.1016/0025-5564(92)90002-E. PMID 1550993.
- ^ Wichman HA, Millstein J, Bull JJ (2005). "Adaptive Molecular Evolution for 13,000 Phage Generations: A Possible Arms Race". Genetics. 170 (1): 19–31. doi:10.1534/genetics.104.034488. PMC 1449705. PMID 15687276.
- ^ Dykhuizen DE, Dean AM (2004). "Evolution of specialists in an experimental microcosm". Genetics. 167 (4): 2015–26. doi:10.1534/genetics.103.025205. PMC 1470984. PMID 15342537.
- ^ Wick LM, Weilenmann H, Egli T (2002). "The apparent clock-like evolution of Escherichia coli in glucose-limited chemostats is reproducible at large but not at small population sizes and can be explained with Monod kinetics". Microbiology. 148 (Pt 9): 2889–902. doi:10.1099/00221287-148-9-2889. PMID 12213934.
- ^ Jones LE, Ellner SP (2007). "Effects of rapid prey evolution on predator-prey cycles". J Math Biol. 55 (4): 541–73. arXiv:q-bio/0609032. doi:10.1007/s00285-007-0094-6. PMID 17483952. S2CID 16927689.
- ^ Schlegel HG, Jannasch HW (1967). "Enrichment cultures". Annu. Rev. Microbiol. 21: 49–70. doi:10.1146/annurev.mi.21.100167.000405. PMID 4860267.
- ^ Varma, A.; Palsson, B. O. (1994-10-01). "Stoichiometric flux balance models quantitatively predict growth and metabolic by-product secretion in wild-type Escherichia coli W3110". Applied and Environmental Microbiology. 60 (10): 3724–3731. Bibcode:1994ApEnM..60.3724V. doi:10.1128/aem.60.10.3724-3731.1994. ISSN 0099-2240. PMC 201879. PMID 7986045.
- ^ a b Fernandez-de-Cossio-Diaz, Jorge; Leon, Kalet; Mulet, Roberto (2017-11-13). "Characterizing steady states of genome-scale metabolic networks in continuous cell cultures". PLOS Computational Biology. 13 (11): e1005835. arXiv:1705.09708. Bibcode:2017PLSCB..13E5835F. doi:10.1371/journal.pcbi.1005835. ISSN 1553-7358. PMC 5703580. PMID 29131817.
- ^ Daughton CG, Hsieh DP (1977). "Parathion utilization by bacterial symbionts in a chemostat". Appl. Environ. Microbiol. 34 (2): 175–84. Bibcode:1977ApEnM..34..175D. doi:10.1128/aem.34.2.175-184.1977. PMC 242618. PMID 410368.
- ^ Pfeiffer T, Bonhoeffer S (2004). "Evolution of cross-feeding in microbial populations". Am. Nat. 163 (6): E126–35. doi:10.1086/383593. PMID 15266392. S2CID 31110741.
- ^ G. J. Butler; G. S. K. Wolkowicz (July 1986). "Predator-mediated competition in the chemostat". J Math Biol. 24 (2): 67–191. doi:10.1007/BF00275997. S2CID 120858390.
- ^ Dykhuizen DE, Hartl DL (June 1983). "Selection in chemostats". Microbiol. Rev. 47 (2): 150–68. doi:10.1128/mr.47.2.150-168.1983. PMC 281569. PMID 6308409.
- ^ Dykhuizen DE, Hartl DL (May 1981). "Evolution of Competitive Ability in Escherichia coli". Evolution. 35 (3): 581–94. doi:10.2307/2408204. JSTOR 2408204. PMID 28563589.
- ^ Bonomi A, Fredrickson AG (1976). "Protozoan feeding and bacterial wall growth". Biotechnol. Bioeng. 18 (2): 239–52. doi:10.1002/bit.260180209. PMID 1267931. S2CID 41343643.
- ^ de Crécy E, Metzgar D, Allen C, Pénicaud M, Lyons B, Hansen CJ, de Crécy-Lagard V (2007). "Development of a novel continuous culture device for experimental evolution of bacterial populations". Appl. Microbiol. Biotechnol. 77 (2): 489–96. doi:10.1007/s00253-007-1168-5. PMID 17896105. S2CID 25787277.
- ^ Zhang Z, Boccazzi P, Choi HG, Perozziello G, Sinskey AJ, Jensen KF (2006). "Microchemostat-microbial continuous culture in a polymer-based, instrumented microbioreactor". Lab Chip. 6 (7): 906–13. doi:10.1039/b518396k. PMID 16804595.
- ^ Van Hulle SW, Van Den Broeck S, Maertens J, Villez K, Schelstraete G, Volcke EI, Vanrolleghem PA (2003). "Practical experiences with start-up and operation of a continuously aerated lab-scale SHARON reactor". Commun. Agric. Appl. Biol. Sci. 68 (2 Pt A): 77–84. PMID 15296140.
- ^ a b c d e Wides A, Milo R (2018). "Understanding the Dynamics and Optimizing the Performance of Chemostat Selection Experiments". arXiv:1806.00272 [q-bio.PE].






