아민 산화효소(코퍼 함유)
Amine oxidase (copper-containing)| 아민 산화효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| EC 번호 | 1.4.3.6 | ||||||||
| CAS 번호. | 9001-53-0 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 입력 | ||||||||
| 엑스퍼시 | 나이스자이메 뷰 | ||||||||
| 케그 | KEG 입력 | ||||||||
| 메타사이크 | 대사통로 | ||||||||
| 프리암 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBsum | ||||||||
| 진 온톨로지 | 아미고 / 퀵고 | ||||||||
| |||||||||
| 구리아민산화효소, 효소영역 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 한세눌라 폴리모르파에서 나오는 구리 함유 벤질아민 산화효소의 결정구조.[1] | |||||||||
| 식별자 | |||||||||
| 기호 | Cu_amine_oxid | ||||||||
| Pfam | PF01179 | ||||||||
| 인터프로 | IPR015798 | ||||||||
| 프로사이트 | PDOC00895 | ||||||||
| SCOP2 | 1oac / SCOPe / SUPFAM | ||||||||
| 멤브라노메 | 252 | ||||||||
| |||||||||
| 구리 아민 산화효소 N단자 영역 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 베타-콜리아민 산화효소 혐기성 감소 e.콜리아민 산화효소의 결정구조 | |||||||||
| 식별자 | |||||||||
| 기호 | Cu_amine_oxidN1 | ||||||||
| Pfam | PF07833 | ||||||||
| 인터프로 | IPR012854 | ||||||||
| SCOP2 | 1spu / SCOPe / SUPFAM | ||||||||
| |||||||||
| 구리 아민 산화효소, N2 도메인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 2.2a 분해능에서 진핵(pea seedling) 구리-아민 산화효소의 결정 구조 | |||||||||
| 식별자 | |||||||||
| 기호 | Cu_amine_oxidN2 | ||||||||
| Pfam | PF02727 | ||||||||
| Pfam 씨 | CL0047 | ||||||||
| 인터프로 | IPR015800 | ||||||||
| 프로사이트 | PDOC00895 | ||||||||
| SCOP2 | 1oac / SCOPe / SUPFAM | ||||||||
| |||||||||
| 구리 아민 산화효소, N3 도메인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
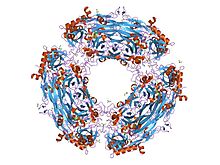 xe~1.6 앵스트롬을 가진 복합체의 한세눌라 폴리모르파 아민 산화효소의 결정 구조 | |||||||||
| 식별자 | |||||||||
| 기호 | Cu_amine_oxidN3 | ||||||||
| Pfam | PF02728 | ||||||||
| Pfam 씨 | CL0047 | ||||||||
| 인터프로 | IPR015802 | ||||||||
| 프로사이트 | PDOC00895 | ||||||||
| SCOP2 | 1oac / SCOPe / SUPFAM | ||||||||
| |||||||||
Amine oxidase (copper-containing) (AOC) (EC 1.4.3.21 and EC 1.4.3.22; formerly EC 1.4.3.6) is a family of amine oxidase enzymes which includes both primary-amine oxidase and diamine oxidase; these enzymes catalyze the oxidation of a wide range of biogenic amines including many neurotransmitters, histamine and xenobiotic amines.그들은 불협화음과 연관된 호모디머의 역할을 한다.그들은 알데히드에 대한 일차 아민의 산화를 촉진하며, 이후 암모니아와 과산화수소가 방출되는데, 이는 서브유닛당 1개의 구리 이온과 토파퀴논을 공동 인자로서 필요로 한다.[2]
- RCHNH22 + HO2 + O2 RCHO + NH3 + HO22
이 효소의 3가지 기질은 1차 아민(RCH2NH2)과 HO2, O인데2 반해 3가지 제품은 RCHO, NH3, HO이다22.
구리 함유 아민 산화는 박테리아, 곰팡이, 식물, 동물에서 발견된다.원핵생물에서 효소는 다양한 아민 기판을 탄소 및 질소의 공급원으로 사용할 수 있게 한다.[3][4]
이 효소는 특히 산소를 수용체로 하는 CH-NH2 기증자 그룹에 작용하는 산화효소에 속한다.이 효소 등급의 체계적 명칭은 아민:oxygen 산화효소(탈염화) (코퍼 함유)이다.이 효소는 8가지 대사 경로에 참여한다: 요소 순환과 아미노 그룹의 대사, 글리신, 세린과 트레오닌 대사, 히스티딘 대사, 티로신 대사, 페닐알라닌 대사, 트립토판 대사, 베타-알라닌 대사, 알칼로이드 생합성 Ⅱ.그것은 구리와 PQQ의 두 가지 공동 요소를 가지고 있다.
구조
구리 아민 산화효소 3차원 구조는 X선 결정학을 통해 결정되었다.[1]구리 아민 산화는 구리 이온과 공칭 레독스 공동 인자인 토파퀴논(TPQ)을 포함하는 각 모노머인 70-95 kDa의 버섯모양 호모디머로 발생한다.TPQ는 보존된 티로신 잔여물의 변환 후 수정으로 형성된다.구리 이온은 일그러진 사각 피라미드 기하학에서 히스티딘 잔여물 3종과 물 분자 2종으로 조정되며, 카탈루션과 TPQ 생물 발생에 이중 기능을 가지고 있다.촉매영역은 구리 아민 산화에서 발견되는 3-4개 영역 중 가장 큰 영역으로, 2장에 18 가닥의 베타 샌드위치로 구성된다.활성 부위는 매립되며 기질에 접근할 수 있도록 순응적인 변경이 필요하다.
N2 및 N3 N-단자 영역은 그 중심부가 알파베타(4)로 구성되는 공통 구조 접이 부분을 공유하며, 여기서 나선은 코일링된 반병렬 베타 시트에 대해 포장을 한다.일부 구리 아민 산화물의 N-단자뿐 아니라 세포벽 하이드롤라아제, N-아세틸무라모일-L-알라닌 아미다제 등 관련 단백질에서도 추가 영역이 발견된다.이 영역은 알파 나선 주위에 꼬인 5줄의 대타렐 베타 시트로 구성되어 있다.[5][6]
함수
진핵생물에서는 세포 분화와 성장, 상처 치유,[1] 해독 및 세포 신호 전달을 포함한 광범위한 기능을 가지고 있다. 일부 [7]포유류 조직에서 하나의 AOC 효소(AOC3)가 혈관 접착 단백질(VAP-1) 역할을 한다.
이 영역을 포함하는 인간 단백질
참고 항목
참조
- ^ a b c PDB: 3LOY;Chang CM, Klema VJ, Johnson BJ, Mure M, Klinman JP, Wilmot CM (March 2010). "Kinetic and structural analysis of substrate specificity in two copper amine oxidases from Hansenula polymorpha". Biochemistry. 49 (11): 2540–50. doi:10.1021/bi901933d. PMC 2851405. PMID 20155950.
- ^ Convery MA, Phillips SE, McPherson MJ, Yadav KD, Knowles PF, Parsons MR, Wilmot CM, Blakeley V, Corner AS (1995). "Crystal structure of a quinoenzyme: copper amine oxidase of Escherichia coli at 2 A resolution". Structure. 3 (11): 1171–1184. doi:10.1016/s0969-2126(01)00253-2. PMID 8591028.
- ^ Murray JM, Convery MA, Phillips SE, McPherson MJ, Knowles PF, Parsons MR, Wilmot CM, Blakeley V, Corner AS, Alton G, Palcic MM (1997). "Catalytic mechanism of the quinoenzyme amine oxidase from Escherichia coli: exploring the reductive half-reaction". Biochemistry. 36 (7): 1608–1620. doi:10.1021/bi962205j. PMID 9048544.
- ^ Tanizawa K, Guss JM, Freeman HC, Yamaguchi H, Wilce MC, Dooley DM, Matsunami H, Mcintire WS, Ruggiero CE (1997). "Crystal structures of the copper-containing amine oxidase from Arthrobacter globiformis in the holo and apo forms: implications for the biogenesis of topaquinone". Biochemistry. 36 (51): 16116–16133. doi:10.1021/bi971797i. PMID 9405045.
- ^ Parsons MR, Convery MA, Wilmot CM, Yadav KD, Blakeley V, Corner AS, Phillips SE, McPherson MJ, Knowles PF (November 1995). "Crystal structure of a quinoenzyme: copper amine oxidase of Escherichia coli at 2 A resolution". Structure. 3 (11): 1171–84. doi:10.1016/s0969-2126(01)00253-2. PMID 8591028.
- ^ Wilmot CM, Hajdu J, McPherson MJ, Knowles PF, Phillips SE (November 1999). "Visualization of dioxygen bound to copper during enzyme catalysis". Science. 286 (5445): 1724–8. doi:10.1126/science.286.5445.1724. PMID 10576737.
- ^ Guss JM, Freeman HC, Kumar V, Wilce MC, Dooley DM, Harvey I, Mcguirl MA, Zubak VM (1996). "Crystal structure of a eukaryotic (pea seedling) copper-containing amine oxidase at 2.2 A resolution". Structure. 4 (8): 943–955. doi:10.1016/s0969-2126(96)00101-3. PMID 8805580.
추가 읽기
- Ameyama M, Hayashi M, Matsushita K, Shinagawa E, Adachi O (1984). "Microbial-production of pyrroloquinoline quinone". Agric. Biol. Chem. 48 (2): 561–565. doi:10.1271/bbb1961.48.561.
- Augustinsson KB, Olsson B (1959). "Esterases in the milk and blood plasma of swine. I. Substrate specificity and electrophoresis studies". Biochem. J. 71 (3): 477–84. doi:10.1042/bj0710477. PMC 1196820. PMID 13638253.
- Boyer, P.D., Lardy, H. and Myrback, K. (Eds.) The Efficios, 2차 Edd, 8권, Academic Press, 1963년, 페이지 337-351.
- Buffoni F, Blaschko H (1964). "Benzylamine oxidase and histaminase: purification and crystallization of an enzyme from pig plasma". Proceedings of the Royal Society B. 161 (983): 153–67. Bibcode:1964RSPSB.161..153B. doi:10.1098/rspb.1964.0086. PMID 14224405. S2CID 43432156.
- Haywood GW, Large PJ (1981). "Microbial oxidation of amines. Distribution, purification and properties of two primary-amine oxidases from the yeast Candida boidinii grown on amines as sole nitrogen source". Biochem. J. 199 (1): 187–201. doi:10.1042/bj1990187. PMC 1163349. PMID 7337701.
- McEwen CM Jr (1965). "Human plasma monoamine oxidase. 1. Purification and identification". J. Biol. Chem. 240 (5): 2003–10. PMID 5888801.
- Mondovi B, Costa MT, Agro AF, Rotilio G (1967). "Pyridoxal phosphate as a prosthetic group of pig kidney diamine oxidase". Arch. Biochem. Biophys. 119 (1): 373–81. doi:10.1016/0003-9861(67)90468-7. PMID 4964016.
- Yamada H, Adachi O, Ogata K (1965). "Amine oxidases of microorganisms. Part II. Purification and crystallisation of amine oxidase of Aspergillus niger". Agric. Biol. Chem. 29: 649–654. doi:10.1271/bbb1961.29.649.
- Yamada H, Adachi O, Ogata K (1965). "Amine oxidases of microorganisms. Part III. Properties of amine oxidase of Aspergillus niger". Agric. Biol. Chem. 29: 864–869. doi:10.1271/bbb1961.29.864.
- Yamada H, Adachi O, Ogata K (1965). "Amine oxidases of microorganisms. Part IV. Further properties of amine oxidase of Aspergillus niger". Agric. Biol. Chem. 29: 912–917. doi:10.1271/bbb1961.29.912.
- Boyer, P.D., Lardy, H. and Myrback, K. (Eds.) The Efficios, 2차 Edd, 8권, Academic Press, 1963년, 페이지 313-335.