변종 표면 당단백질
Variant surface glycoprotein| 가변 표면 당단백질 | |
|---|---|
| 식별자 | |
| 유기체 | |
| 기호 | Tb927.5.4730 |
| Alt. 기호 | Tb05.26C7.380 |
| 엔트레스 | 3657576 |
| 기타자료 | |
| 염색체 | 5: 1.41 - 1.41Mb |
| 변형 표면 당단백질 MITAT 1.2 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 유기체 | |||||||
| 기호 | 해당 없음 | ||||||
| Alt. 기호 | VSG 221 | ||||||
| 유니프로트 | P26332 | ||||||
| |||||||
변종표면 당단백질(VSG)은 트라이파노소마속(Trypanosoma)에 속하는 원생동물들의 세포 표면을 촘촘히 포장하는 약 60kDa 단백질이다.이 속은 세포 표면 단백질로 유명하다.그들은 조지 크로스에 의해 1975년에 트라이파노소마 브루시로부터 처음 격리되었다.[1]VSG는 광범위한 항원적 변동에 의해 포유류 숙주의 면역체계를 회피하는 트라이파노소마티드 기생충을 허용한다.12~15nm의 표면 코트를 형성한다.VSG 조광기, 모든 세포 표면 단백질의 90%까지또한 총 세포단백질의 최대 10%를 차지한다.이러한 이유로, 이러한 단백질은 면역력이 매우 높으며 특정 VSG 코트에 대해 제기된 면역 반응은 이 변종을 나타내는 트라이파노솜을 빠르게 죽일 것이다.그러나 각 세포분열과 함께 자손이 발현 중인 VSG를 변화시키기 위해 발현을 전환할 가능성이 있다.VSG는 규정된 생화학적 활성화가 없다.
기생충은 항원적으로 구별되는 큰 세포 레퍼토리인 VSGs(약 1,500/2000년[citation needed] 완성과 부분적(시료생성))를 가지고 있으며, 텔로메릭과 하위텔로메릭 배열(메가베이스 염색체 또는 미니크로모솜에 있음)에 위치한다.VSG는 다른 ES 관련 유전자(ESAG)와 함께 RNA 중합효소 I(리보솜형 촉진제)에 의해 폴리시스트론의 혈류 발현 부위(BES, ES)에서 발현되며, 그 중 트랜스퍼린 수용체(Tfr: ESAG6, ESAG7)가 하나이다.한 번에 하나의 VSG 유전자만 발현되는데, 이는 ~15개의 ES 중 하나만 세포에서 활동하기 때문이다.VSG 표현은 어레이(호몰리학에 의해 지시됨)의 무성 기본 복사 유전자를 활성 단층 배치 표현 사이트로 호몰로 재결합하여 '전환'된다.[2]이 전환 중에 트라이패노솜은 프리스위치 VSG와 포스트스위치 VSG를 동시에 표면에 표시한다.이 코팅 교체 프로세스는 초기 VSG가 증가하는 호스트 Ab 응답의 대상으로 남아 있기 때문에 최근에 전환된 셀의 생존에 매우 중요하다.모자이크 VSG 유전자는 배열에서 나온 부분 VSG 유전자의 호몰로 재조합에 의해 생성될 수 있다.이 부분 유전자는 상주하는 VSG 유전자의 어떤 부분을 대체할 수 있으며, 새로운 모자이크 VSG 반감기 측정을 통해 초기 VSG가 유전적으로 교환된 트라이패노솜 표면에서 며칠 동안 지속될 수 있음을 시사한다.VSG 전환 규제가 순수하게 확률적인지, 환경 자극이 전환 주파수에 영향을 미치는지는 여전히 불확실하다.체외에서 스위칭이 일어난다는 사실은 그 과정에 적어도 호스트 독립적이고 확률적인 요소가 있다는 것을 시사한다.
항원적 변화는 기생충의 순환파를 유발하는데, 이는 인간아프리카 트라이파노소미아스의 특징 중 하나이다.순환 과정은 5~8일이 걸린다.이는 트라이파노솜 집단에 의해 표현되는 다양한 범위의 외투는 면역체계가 항상 한 발 뒤처져 있다는 것을 의미하기 때문에 발생한다: 주어진 VSG에 대한 면역반응이 발달하는데 수일이 걸리고, 개인이 추가적인 전환사건을 겪으면서 모집단이 다양화하는 데 시간이 주어진다.이 과정이 반복되면 감염되는 트라이파노섬 개체군의 멸종을 막아 숙주 내 기생충의 만성적인 지속성을 허용하고 전염 기회를 높인다.
트라이파노소마 브루시
트라이파노소마 브루시(Trypanosoma bruisi)에서 세포 표면은 전체 세포 표면 단백질의 최대 90%인 [3]5 x 106 VSG 조광기의 밀도 코팅으로 덮여 있다.또한 총 세포단백질의 최대 10%를 차지한다.
면역 탈피를 가능하게 하는 VSG 코트의 특성은 다음과 같다.
- 차폐 – VSG 코팅(VSG 단백질 팩 숄더 대 어깨)의 밀도 있는 성질은 포유류 숙주의 면역 시스템이 플라스마 막이나 다른 기생 불변성 표면 상피(이온 채널, 전달체, 수용체 등)에 접근하지 못하게 한다.이 코트는 동일한 분자의 수백만 장으로 이루어진 균일하다. 따라서 VSG는 면역체계가 인식할 수 있는 유일한 시험판이다.[4]
- 주기적인 항원 변화 - VSG 코트는 확률론적 유전자 변형('전환')을 자주 겪으며, 새로운 VSG 코트를 표현하는 변종이 이전 코트에 대해 제기된 특정 면역 반응을 피할 수 있도록 한다.이러한 항원적 변화는 인간아프리카 트라이파노소미아스의 특징인 기생충의 순환파를 생성한다.[5]
- 항원 '세척'과 VSG 재활용—VSG는 트라이파노솜 플라젤라 포켓을 통해 효율적으로 재활용되어 다시 세포막에 재합성하기 전에 VSG에서 항체를 '세척'할 수 있다.중요한 것은, 항체에 의해 인식되고 결합되는 VSG는 미식별 VSG보다 빠른 속도로 플랜젤라 포켓 쪽으로 선택적으로 밀리고, 이 시나리오에서 항체는 '사일'의 역할을 하여 VSG가 재활용 영역에 유입되는 과정을 촉진시킨다.[6]
T. bruisi의 VSG는 GPI 발란스 가설에서 예측한 바와 같이 ER에서 막에 통합하기 위한 평판 주머니까지 전방 트래킹을 지시하는 2개의 글리코실-인산염리노시톨(GPI당 1개) 앵커에 공밸런트 부착을 통해 플라스마 막에 부착된다.[7][8][9]
VSG는 기생충이 세체플라이 미드굿에서 프로사이클릭 형태로 구별될 때 똑같이 촘촘한 프로사이클린 코트로 대체된다.온도가 내려가자마자 일어나는 VSG 유전자 전사의 매우 빠른 억제가 있다.[10]
표현
감염 중의 VSG 변동성의 근원은 T. bruisi 게놈에 존재하는 VSG 유전자의 큰 '아카이브'이다.이들 중 일부는 완전하고 온전한 유전자들이고, 다른 일부는 유사 유전자들이다.[11]항원적으로 다른 VSG의 표현은 단순히 표현 사이트 전환(ES가 활성화된 전환)에 의해 다른 전체 길이 VSG 유전자로 전환함으로써 발생할 수 있다.또 하나 이상의 무성 VSG 유전자의 분절들을 결합하여 치메릭 또는 '모자이크' VSG 유전자를 생성할 수 있다.모자이크 VSG의 형성은 VSG 아카이브의 주요 부분을 구성할 수 있고 항원적 변동에 직접 기여할 수 있는 (부분적) 가성 VSG의 발현을 가능하게 하여 트라이파노좀의 면역 회피 능력을 크게 증가시키고 백신 개발에 큰 문제를 제기한다.[12]
VSG 유전자는 아무 때나 조용히 있을 수 있고 켜질 수 있다.표현된 VSG는 항상 표현 현장(ES)에 위치하며, 이는 큰 염색체와 중간 염색체의 일부 말단체에서 발견되는 전문 표현 위치다.각 ES는 폴리시스트로닉 장치로, 활성 VSG와 함께 모두 발현된 다수의 발현 부위 연관 유전자(ESAG)를 포함하고 있다.여러 개의 ES가 존재하지만, 한 번에 하나의 ES만 활성화된다.이 과정에 여러 메커니즘이 관여하고 있는 것으로 보이지만 정확한 침묵의 성질은 여전히 불분명하다.[13]
표현된 VSG는 다른 표현 사이트를 활성화하거나(따라서 해당 사이트에서 VSG를 표현하도록 변경), 활성 사이트의 VSG 유전자를 다른 변종으로 변경하여 전환할 수 있다.게놈은 염색체 내부의 반복적인 부분과 미니크로모솜에 모두 VSG 유전자의 많은 복제품을 포함하고 있다.이러한 것들은 일반적으로 침묵하며, 일반적으로 생략된 부분이나 조기 정지 코돈과 함께 존재하지만, 새로운 VSG 유전자의 진화에 중요하다.그것은 티브루체 게놈의 10%가 VSG 유전자나 유사유전자로 구성되어 있을 것으로 추정된다.이 유전자들 중 어떤 것이든 발현을 위해 재조합함으로써 활성 부위로 옮겨질 수 있다.다시 말하지만, 이것을 제어하는 정확한 메커니즘은 불분명하지만, 그 과정은 DNA 수리 기계와 동음이의 재조합 과정에 의존하는 것처럼 보인다.[14]
혈류 표현 사이트(BES), 즉 말단 표현 사이트는 숙주의 혈류에서 보완 시스템을 벗어나기 위해 변형 표면 당단백질을 교환하는 데 사용된다.BES는 크기와 구조상 다형성이지만 광범위한 재조합의 맥락에서 놀랍도록 보존된 아키텍처를 보여준다.매우 작은 BES가 존재하며 많은 기능 BES는 표현 부위 관련 유전자(ESAG)의 완전한 보완을 포함하지 않는다.[15]20-30개 정도로 추정되는 사이트들이 한 번에 하나씩 활동하고 있다.[16]활성 VSG 표현 사이트는 핵물질이 고갈되어 있다.[17]
T. bruisi의 유전자 레퍼토리는 변종 특이화되기 시작했다.[18]
T. bruisi의 변형 표면 당단백질 유전자는 유전자가 발현될 때 중복이 관찰되는지 여부에 따라 두 그룹으로 분류되어 왔다.[19]
밀매
트라이파노소마는 단일 ER, 리소솜, 골기 기구로 구성된 단순 편광막 이송 시스템을 가지고 있다.
VSG는 처음에는 폴리시스트론(polycistron)으로 표기된 후 폴리피리미딘트레이트가 지시하는 트라이파노소마티드 특유의 폴리아데닐화(polypyrimididation)을 거친다.전사 제어 기능이 없기 때문에 VSG 3'UTR은 RNA 안정성(가장 중요한 8mer와 14mer)에 중요하다.VSG는 멤브레인 결합 폴리솜에 기록되며, N단자 신호 시퀀스의 외관은 VSG를 ER로 유도한다.따라서 VSG는 변환 반응(C-항 소수성 17 또는 23A GPI 고정 시퀀스의 제거)에 의해 ER 루멘, 급속 N-글리코실레이트(asn-xser/thr 사이트) 및 Ω 사이트에 고정된 GPI로 동시 전달된다.Ω 부위는 항상 Ser(일반적으로 17a 신호 시퀀스 펩타이드), Asp(일반적으로 23a 신호 시퀀스 펩타이드) 또는 Asn이다.또한 VSG당 N-glycosylation 사이트의 수는 다를 수 있다(일반적으로 1-3 N-glycans).VSG MITat.1.5는 세 개의 잠재적 N-glycosylation 부위에서 모두 글리코실화된다.[20]
VSG는 이후 칼레티쿨린/칼네신 접이 사이클(트라이파노소마 브루시에는 칼네신이 없음)을 거치며, 여기서 일시적으로는 단색루코실화 및 탈색루코실화되며, 올바르게 접히기 위해 BiP와 같은 다양한 ER 체퍼론 단백질과 상호작용한다.VSG는 효율적으로 접고 어둡게 하며(본질적으로 유리한 접힘을 암시함) 골기를 통해 평판 주머니로 운반되어 세포막에 통합된다.
중요한 것은, 세포막에 통합한 후, VSG는 나중에 평판 주머니를 통해 재활용되어 세포 표면으로 다시 정렬될 수 있다는 것이다.VSG는 라이소솜 또는 프로테아솜 표준 분해 경로에 의해 뒤집히지 않고,[21] 대신 GPI 고유 PLC에 의해 GPI 앵커의 특정 분할에 의해 셀로부터 손실된다.
구조
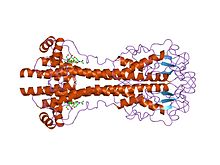
VSG 유전자 크게 시퀀스(일차)수준에 있었지만, 변형들 강하게 구조(삼차)기능 보존된 것으로 생각된다, 2차원 연속 모티브의 두 결정했다 3차원 structures[22]과 보존(는 이합 체화 인터페이스를 구성하고는 하강하고 상행 alpha-helices)에 기초한 그들 p. 수 있도록 가변erform 유사한 차폐 기능.[23]VSG는 낮은 염기서열 호몰로지(13~30% ID)를 가진 약 300~350개의 아미노산의 N 단자 영역과 100개 이하의 아미노산의 보존도가 높은 C단자 영역으로 구성되며, N단자 영역은 시스테인 패턴에 따라 A-C 등급으로 분류된다.C-항 도메인은 완전한 VSG를 형성하기 위해 어떤 N-항 클래스와 결합할 수 있는지에 대한 제한 없이 시퀀스 호몰로 분류된다.조광화를 위해 VSG N 단자 영역은 소수성 상호작용에 의해 지시된 네 개의 알파 나선형 묶음을 형성하며, 그 둘레에는 더 작은 구조적 특징(더 작은 나선형 5개와 베타 시트 3개)이 걸려 있다.
VSG는 글리코포스포티디리노시톨(GPI) 닻을 통해 세포막에 고정되는데, 이는 C-terminus에서 ER에서 멤브레인까지 전방 밀매를 지시하는 비균등 연결이다.This GPI anchor is specifically cleaved by GPI Phospholipase C, cleaving the membrane-form VSG, and allowing VSG protein and portion of the GPI anchor to be lost into the extracellular milieu as soluble VSG (sVSG, which is can be recognized as Cross-Reacting Determinant, or CRD), while retaining the two 1,2-dimyristolglycerol chains in the membrane
항원변동
VSG는 면역력이 매우 높으며, 특정 VSG 코트에 대해 제기된 면역 반응은 이 변종을 나타내는 트라이파노솜을 빠르게 죽일 것이다.항체 매개 트라이파노섬 살인은 또한 보완 매개 용해 검사를 통해 체외에서 관찰될 수 있다.그러나 각 세포분열과 함께 하나 또는 둘 다 표현되고 있는 VSG를 변화시키기 위해 표현을 전환할 가능성이 있다.VSG 전환 빈도는 배양과 체내 전환 빈도는 다르지만,[24] 분할 당 약 0.1%로 측정되었다.T. bruisi 개체수는 호스트[25] 내에서 10의11 크기로 최고조에 달할 수 있기 때문에 이 빠른 전환 속도는 기생충 개체군이 지속적으로 다양함을 보장한다.트라이파노섬 집단에 의해 표현된 다양한 범위의 외투는 면역체계가 항상 한 발 뒤처져 있다는 것을 의미한다: 주어진 VSG에 대한 면역반응이 발달하는 데 며칠이 걸리고, 개인이 추가적인 전환사건을 겪으면서 모집단이 다양화하는 데 시간이 주어진다.이 과정을 반복하면 감염되는 트라이파노섬 개체군의 멸종을 막아 숙주 내 기생충의 만성적인 지속성을 허용해 전염 기회를 높일 수 있다.이 주기의 임상 효과는 기생충(혈액 속의 트라이파노솜)의 연속적인 '파동'이다.[3]
다른 트라이파노솜에서
가변 표면 당단백질은 다른 트라이파노소마 종에서도 발견된다.
말들의 위장병을 유발하는 기생충인 트라이파노소마 에퀴페르디움에서, 이 단백질들은 기생충이 숙주 동물의 면역체계를 효율적으로 피하도록 한다.[26]이러한 VSG는 유기체가 단백질의 표면 구조를 끊임없이 조작하고 변화시킬 수 있게 해주는데, 이는 새로운 이질적인 유기체로서 면역체계에 지속적으로 제시되고 있다는 것을 의미하며 이는 인체가 질병을 근절할 수 있을 만큼 충분한 면역반응을 일으키지 못하게 한다.[26]이런 의미에서 트라이파노소마 등나무는 매우 효율적인 유기체다. 다른 질병에 비해 적은 종을 감염시킬 수도 있지만, 지정된 숙주 내에서 매우 효율적으로 감염되고 생존한다.T. Equiperdum의 VSG 단백질도 인산염이다.[27]
동물에게 서라의 형태를 일으키는 기생충인 트라이파노소마 에반시의 VSG 유전자가 대장균에서 복제됐다.표현된 단백질은 모든 세라 조합과 함께 면역성이 있다.전세포 라이산염 또는 재조합 단백질로 면역된 동물은 ELISA(Enzyme 연계 면역항암제 검사)와 CATT(Trypanosomiasis에 대한 카드 응고 검사)에서 항체 반응이 유사하다.[28]가변 표면 당단백질 RoTat 1.2 PCR는 T. 에반시 감염 감지를 위한 특정 진단 도구로 사용할 수 있다.[29]
현재까지 발견된 가장 작은 VSG 단백질(크기 40kDa)은 탄수화물이 거의 함유되지 않는 트라이파노소마 비비락스(Trypanosoma vivax)에서 발견됐다.[30]
Trypanosoma congolense에서 당분해효소 후 통합 당분에 대한 체외 분석 결과, 글루코사민과 마노오스가 탄수화물 모이성의 생합성에 직접 활용되는 반면 갈락토오스는 항원에 통합되기 전에 다른 매개체로 전환되었을 가능성이 있다.분자량 47kDa의 비합리화 VSG는 크기 이질성을 완전히 상실했다.[31]
참고 항목
- 코팅 단백질(동음이의)
- 글리코칼릭스
- MeSH 코드 목록(D23)
- MeSH 코드 목록(D12.776.395)
- MeSH 코드 목록(D12.776.543)
- 아마스틴, trypanosomatid 기생충에[32] 있는 또 다른 표면(트랜스-membrane) 당단백질
참조
- ^ Cross GA (1975). "Identification, purification and properties of clone-specific glycoprotein antigens constituting the surface coat of Trypanosoma brucei". Parasitology. 71 (3): 393–417. doi:10.1017/s003118200004717x. PMID 645.
- ^ Buck GA, Jacquemot C, Baltz T, Eisen H (December 1984). "Re-expression of an inactivated variable surface glycoprotein gene in Trypanosoma equiperdum". Gene. 32 (3): 329–36. doi:10.1016/0378-1119(84)90008-8. PMID 6530143.
- ^ a b Barry JD, McCulloch R (2001). "Antigenic variation in trypanosomes: enhanced phenotypic variation in a eukaryotic parasite". Advances in Parasitology Volume 49. Advances in Parasitology. Vol. 49. pp. 1–70. doi:10.1016/S0065-308X(01)49037-3. ISBN 978-0-12-031749-3. PMID 11461029.
- ^ Overath P, Chaudhri M, Steverding D, Ziegelbauer K (February 1994). "Invariant surface proteins in bloodstream forms of Trypanosoma brucei". Parasitology Today. 10 (2): 53–8. doi:10.1016/0169-4758(94)90393-X. PMID 15275499.
- ^ Ross R, Thomson D (June 1910). "A Case of Sleeping Sickness showing Regular Periodical Increase of the Parasites Disclosed". British Medical Journal. 1 (2582): 1544–5. doi:10.1136/bmj.1.2582.1544. PMC 2331906. PMID 20765166.
- ^ Rudenko G (2011-10-24). "African trypanosomes: the genome and adaptations for immune evasion". Essays in Biochemistry. 51: 47–62. doi:10.1042/bse0510047. PMID 22023441.
- ^ Grab DJ, Verjee Y. "Localization of a Variable Surface Glycoprotein Phosphatidylinositol-Specific Phospholipase-C in Trypanosoma brucei brucei". FAO Corporate document depository. Food and Agricultural Organization of the United Nations.
- ^ Triggs VP, Bangs JD (February 2003). "Glycosylphosphatidylinositol-dependent protein trafficking in bloodstream stage Trypanosoma brucei". Eukaryotic Cell. 2 (1): 76–83. doi:10.1128/ec.2.1.76-83.2003. PMC 141176. PMID 12582124.
- ^ Schwartz KJ, Peck RF, Tazeh NN, Bangs JD (December 2005). "GPI valence and the fate of secretory membrane proteins in African trypanosomes". Journal of Cell Science. 118 (Pt 23): 5499–511. doi:10.1242/jcs.02667. PMID 16291721.
- ^ Pays E, Coquelet H, Pays A, Tebabi P, Steinert M (September 1989). "Trypanosoma brucei: posttranscriptional control of the variable surface glycoprotein gene expression site". Molecular and Cellular Biology. 9 (9): 4018–21. doi:10.1128/mcb.9.9.4018. PMC 362464. PMID 2779574.
- ^ Marcello L, Barry JD (September 2007). "Analysis of the VSG gene silent archive in Trypanosoma brucei reveals that mosaic gene expression is prominent in antigenic variation and is favored by archive substructure". Genome Research. 17 (9): 1344–52. doi:10.1101/gr.6421207. PMC 1950903. PMID 17652423.
- ^ Barbour AG, Restrepo BI (2000). "Antigenic variation in vector-borne pathogens". Emerging Infectious Diseases. 6 (5): 449–57. doi:10.3201/eid0605.000502. PMC 2627965. PMID 10998374.
- ^ Pays E (November 2005). "Regulation of antigen gene expression in Trypanosoma brucei". Trends in Parasitology. 21 (11): 517–20. doi:10.1016/j.pt.2005.08.016. PMID 16126458.
- ^ Morrison LJ, Marcello L, McCulloch R (December 2009). "Antigenic variation in the African trypanosome: molecular mechanisms and phenotypic complexity" (PDF). Cellular Microbiology. 11 (12): 1724–34. doi:10.1111/j.1462-5822.2009.01383.x. PMID 19751359. S2CID 26552797.
- ^ Hertz-Fowler C, Figueiredo LM, Quail MA, Becker M, Jackson A, Bason N, Brooks K, Churcher C, Fahkro S, Goodhead I, Heath P, Kartvelishvili M, Mungall K, Harris D, Hauser H, Sanders M, Saunders D, Seeger K, Sharp S, Taylor JE, Walker D, White B, Young R, Cross GA, Rudenko G, Barry JD, Louis EJ, Berriman M (2008). "Telomeric expression sites are highly conserved in Trypanosoma brucei". PLOS ONE. 3 (10): e3527. Bibcode:2008PLoSO...3.3527H. doi:10.1371/journal.pone.0003527. PMC 2567434. PMID 18953401.
- ^ Vanhamme L, Lecordier L, Pays E (May 2001). "Control and function of the bloodstream variant surface glycoprotein expression sites in Trypanosoma brucei". International Journal for Parasitology. 31 (5–6): 523–31. doi:10.1016/S0020-7519(01)00143-6. PMID 11334937.
- ^ Stanne TM, Rudenko G (January 2010). "Active VSG expression sites in Trypanosoma brucei are depleted of nucleosomes". Eukaryotic Cell. 9 (1): 136–47. doi:10.1128/EC.00281-09. PMC 2805301. PMID 19915073.
- ^ Hutchinson OC, Picozzi K, Jones NG, Mott H, Sharma R, Welburn SC, Carrington M (July 2007). "Variant Surface Glycoprotein gene repertoires in Trypanosoma brucei have diverged to become strain-specific". BMC Genomics. 8: 234. doi:10.1186/1471-2164-8-234. PMC 1934917. PMID 17629915.
- ^ Young JR, Turner MJ, Williams RO (1984). "The role of duplication in the expression of a variable surface glycoprotein gene of Trypanosoma brucei". Journal of Cellular Biochemistry. 24 (3): 287–95. doi:10.1002/jcb.240240309. PMID 6736139. S2CID 73535.
- ^ Mehlert A, Bond CS, Ferguson MA (October 2002). "The glycoforms of a Trypanosoma brucei variant surface glycoprotein and molecular modeling of a glycosylated surface coat". Glycobiology. 12 (10): 607–12. doi:10.1093/glycob/cwf079. PMID 12244073.
- ^ Tiengwe C, Muratore KA, Bangs JD (November 2016). "Surface proteins, ERAD and antigenic variation in Trypanosoma brucei". Cellular Microbiology. 18 (11): 1673–1688. doi:10.1111/cmi.12605. PMC 5575760. PMID 27110662.
- ^ Freymann D, Down J, Carrington M, Roditi I, Turner M, Wiley D (1990). "2.9 Å resolution structure of the N-terminal domain of a variant surface glycoprotein from Trypanosoma brucei". Journal of Molecular Biology. 216 (1): 141–60. doi:10.1016/S0022-2836(05)80066-X. PMID 2231728.
- ^ Blum ML, Down JA, Gurnett AM, Carrington M, Turner MJ, Wiley DC (April 1993). "A structural motif in the variant surface glycoproteins of Trypanosoma brucei". Nature. 362 (6421): 603–9. Bibcode:1993Natur.362..603B. doi:10.1038/362603a0. PMID 8464512. S2CID 4370099.
- ^ Turner CM (August 1997). "The rate of antigenic variation in fly-transmitted and syringe-passaged infections of Trypanosoma brucei". FEMS Microbiology Letters. 153 (1): 227–31. doi:10.1111/j.1574-6968.1997.tb10486.x. PMID 9252591.
- ^ Barry JD, Hall JP, Plenderleith L (September 2012). "Genome hyperevolution and the success of a parasite". Annals of the New York Academy of Sciences. 1267 (1): 11–7. Bibcode:2012NYASA1267...11B. doi:10.1111/j.1749-6632.2012.06654.x. PMC 3467770. PMID 22954210.
- ^ a b Raibaud A, Gaillard C, Longacre S, Hibner U, Buck G, Bernardi G, Eisen H (July 1983). "Genomic environment of variant surface antigen genes of Trypanosoma equiperdum". Proceedings of the National Academy of Sciences of the United States of America. 80 (14): 4306–10. Bibcode:1983PNAS...80.4306R. doi:10.1073/pnas.80.14.4306. PMC 384026. PMID 6308614.
- ^ Baltz T, Giroud C, Baltz D, Duvillier G, Degand P, Demaille J, Pautrizel R (1982). "The variable surface glycoproteins of Trypanosoma equiperdum are phosphorylated". The EMBO Journal. 1 (11): 1393–8. doi:10.1002/j.1460-2075.1982.tb01328.x. PMC 553222. PMID 6821334.
- ^ Sengupta PP, Balumahendiran M, Balamurugan V, Rudramurthy GR, Prabhudas K (June 2012). "Expressed truncated N-terminal variable surface glycoprotein (VSG) of Trypanosoma evansi in E. coli exhibits immuno-reactivity". Veterinary Parasitology. 187 (1–2): 1–8. doi:10.1016/j.vetpar.2012.01.012. PMID 22277627.
- ^ Claes F, Radwanska M, Urakawa T, Majiwa PA, Goddeeris B, Büscher P (September 2004). "Variable Surface Glycoprotein RoTat 1.2 PCR as a specific diagnostic tool for the detection of Trypanosoma evansi infections". Kinetoplastid Biology and Disease. 3 (1): 3. doi:10.1186/1475-9292-3-3. PMC 521498. PMID 15377385.
- ^ Gardiner PR, Nene V, Barry MM, Thatthi R, Burleigh B, Clarke MW (November 1996). "Characterization of a small variable surface glycoprotein from Trypanosoma vivax". Molecular and Biochemical Parasitology. 82 (1): 1–11. doi:10.1016/0166-6851(96)02687-4. PMID 8943146.
- ^ Reinwald E, Heidrich C, Risse HJ (May 1984). "In vitro studies on the biosynthesis of the surface glycoprotein of Trypanosoma congolense". The Journal of Protozoology. 31 (2): 300–6. doi:10.1111/j.1550-7408.1984.tb02966.x. PMID 6470988.
- ^ Jackson AP (January 2010). "The evolution of amastin surface glycoproteins in trypanosomatid parasites". Molecular Biology and Evolution. 27 (1): 33–45. doi:10.1093/molbev/msp214. PMC 2794310. PMID 19748930.
외부 링크
- 변형 표면 글리코프로틴, 미국 국립 의학 도서관의 트라이파노소마(Trypanosoma)
- www.icp.ucl.ac.be