염화디에틸알루미늄
Diethylaluminium chloride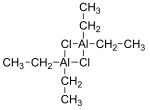 | |
| 이름 | |
|---|---|
| IUPAC 이름 클로로디에틸알루만 | |
| 기타 이름 클로로디에틸알루미늄 | |
| 식별자 | |
3D 모델(JSmol) | |
| 4123259 | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.002.253 |
| EC 번호 |
|
PubChem CID | |
| RTECS 번호 |
|
| 유니 | |
| UN 번호 | 3394 |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| C4H10알클론 | |
| 몰 질량 | 120.56 g/g−1/g |
| 외모 | 무색[1] 액체 |
| 밀도 | 0.96 g/cm3[1] |
| 녹는점 | -74 °C (-101 °F, 199 [1]K) |
| 비등점 | 125~126 °C (50 mmHg에서 257~259 °F, 398~399 K) |
| 반응[1] | |
| 증기압 | 3 mmHg (60 °C에서) |
| 위험 요소 | |
| GHS 라벨링: | |
  | |
| 위험. | |
| H225, , , , , | |
| P210, , , , , , , , , , , , , , , , , , , , , , ,, | |
| NFPA 704(파이어 다이아몬드) | |
| 플래시 포인트 | - 18 °C (0 °F, 255 K) |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
염화디에틸알루미늄(DEAC)은 유기알루미늄 화합물이다.보통 화학식(CH25)2AlCl이 주어지지만, 이합체로 [(CH25)2AlCl]2 폴리올레핀 생산에 사용되는 지글러-나타 촉매의 전구체이다.이 화합물은 또한 유기 합성에 유용한 루이스산이다.이 화합물은 무색의 왁시 고체이지만 일반적으로 탄화수소 용매에서 용액으로 취급됩니다.그것은 매우 반응적이고 심지어 발화성이 [2]있다.
구조.
실험식2 AlRCl(R = 알킬, 아릴)의 화합물은 식(2RAL2)(μ-Cl)2의 이합체로 존재한다.알루미늄은 사면체 [3][4]형상을 채택하고 있습니다.
생산.
염화디에틸알루미늄은 [5]세스키클로화 에틸알루미늄25(CH)3AlCl에서23 나트륨으로 환원하여 제조할 수 있습니다.
- 2 (CH25)3 AlCl23 + 3 Na → 3 (CH25)2 AlCl + Al + 3 NaCl
트리에틸알루미늄과 염산의 반응에서도 얻을 수 있습니다.
- (CH25)3Al + HCl → (CH25)2AlCl + CH26
재비례 반응도 사용할 수 있습니다.
- 2 (CH25)3 Al + AlCl3 → 3 (CH25)2 AlCl
- (CH25)3 AlCl23 + (CH25)3Al → 3 (CH25)2 AlCl
사용하다
염화디에틸알루미늄 및 기타 유기알루미늄화합물은 다양한 [6]알케인의 중합용 지글러-나타 촉매로서 전이금속화합물과 조합하여 사용된다.
루이스산으로서 염화디에틸알루미늄은 유기합성에도 사용된다.예를 들어 Diels-Alder 및 Ene 반응을 촉매하는 데 사용됩니다.또는 친핵체 또는 양성자 스캐빈저로 [2]반응할 수 있다.
안전.
염화 디에틸 알루미늄은 인화성뿐만 아니라 발화성입니다.
레퍼런스
- Hu, Y. J.; Jiang, H. L.; Wang, H. H., "아세나프테네디이미민 염화니켈/염화디에틸알미늄 촉매에 의한 고분기 폴리에틸렌 제조"중국고분자과학저널 2006, 24(5), 483~488.
- Yao, Y.M.; Qi, G. Z.; Shen, Q.; Hu, J.Y.; Lin, Y.H., "염화알루미늄에 의한 2가 사마륨 아릴옥시드의 반응성과 구조적 특성"중국과학보 2003, 48(20), 2164~2167.
- ^ a b c d John Rumble (June 18, 2018). CRC Handbook of Chemistry and Physics (99th ed.). CRC Press. pp. 4–40. ISBN 978-1138561632.
- ^ a b Snider, Barry B.; Ramazanov, Ilfir R.; Dzhemilev, Usein M. (2009). "Ethylaluminum Dichloride". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.re044.pub2. ISBN 978-0471936237.
- ^ Brendhaugen, Kristen; Haaland, Arne; Novak, David P.; Østvold, Terje; Bjørseth, Alf; Powell, D. L. (1974). "The Molecular Structure of Dimethylaluminium Chloride Dimer, [(CH3)2Al Cl]8, Redetermined by Gas Phase Electron Diffraction". Acta Chemica Scandinavica. 28a: 45–47. doi:10.3891/acta.chem.scand.28a-0045.
- ^ McMahon, C. Niamh; Francis, Julie A.; Barron, Andrew R. (1997). "Molecular structure of [(t Bu)2Al(μ-Cl)]2". Journal of Chemical Crystallography. 27 (3): 191–194. doi:10.1007/BF02575988. S2CID 195242291.
- ^ Krause, Michael J.; Orlandi, Frank; Saurage, Alfred T.; Zietz, Joseph R. (2000), "Aluminum Compounds, Organic", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, pp. 592–593, doi:10.1002/14356007.a01_543, ISBN 978-3-527-30673-2
- ^ Fisch, A. G. (2000). "Ziegler–Natta Catalysts". Kirk‐Othmer Encyclopedia of Chemical Technology. Wiley. pp. 1–22. doi:10.1002/0471238961.2609050703050303.a01.pub2. ISBN 978-0-471-48494-3. S2CID 213111515.
외부 링크
 위키미디어 커먼스의 염화디에틸알루미늄 관련 매체
위키미디어 커먼스의 염화디에틸알루미늄 관련 매체



