휴뮬론
Humulone | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 (6S)-3,5,6-트리히드록시-2-(3-메틸부타노일)-4,6-bis(3-메틸부타-2-엔-1-yl)사이클로헥사-2,4-dien-1-1[1] | |
| 기타 이름 α-루풀산; α-비터산 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.043.371 |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C21H30O5 | |
| 어금질량 | 362.466 g·16−1 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
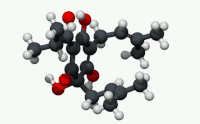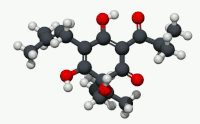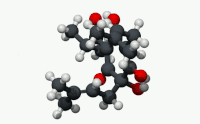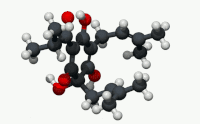
유기산의 빈민성형인 휴물론(α-루풀산)은 숙성 홉(Humulus Lupulus)의 수지에서 발견되는 쓴맛을 내는 화학 화합물이다.[2]휴뮬론은 알파산으로 알려진 화합물 종류 중 널리 쓰이는 성분으로, 호핑맥주 특유의 쓴 맛을 집단적으로 낸다.
화학
구조적으로 볼 때 휴뮬론은 이소프로노이드 사이드체인이 3개인 프롤로글루시놀 유도체다.두 개의 사이드 체인은 태아 그룹이고 한 개는 이소발레릴 그룹이다.산으로 지정되는 링 에놀 모이에티스의 산성도는 링 및 사이드 체인 카보닐 기능 그룹과의 비니로거스 관계에 있다.[citation needed]
이소후물론
양조하는 과정에서 우뮬론은 시스-와 트랜스-이소훌론(trans-isohumulone)으로 분해된다.[1]이러한 "알파산"은 수많은 산화 유도체들이 생산되지만 끓는 과정에서 살아남는다.[3]이소 알파산은 양조 공정에서 일반적으로 나타나는 pH 수준에서 우뮬론보다 훨씬 더 용해성이 높다.[4]
실험실 합성
휴뮬론은 벤젠-1,2,3,5-테트롤과 이소발레릴 염화물을 혼합하여 2,3,4,6-테트라하이드록시소발레로페논을 투여함으로써 합성될 수 있다.이 단계는 1-브로모-3-메틸-2-부틴으로 태교에 이어 휴뮬론을 투여한다.[5]
생합성
INPITY 2D NMR에 의해 결정되었듯이, Humulus lupulus에서 휴뮬론의 생합성은 Phlorovalophenone synthase에 의해 촉매된 이소발레릴-CoA 단위와 3 malonyl-CoA 단위로 시작한다.이 변환은 벤제노이드 3-메틸-1-2(2,4,6-트리히드록시페닐)부탄-1-1을 산출한다.그런 다음 디메틸알릴 피로인산염은 벤제노이드의 혼전이 발생하여 우뮬론이 발생하는 디옥시릴룰로오스 경로에서 얻는다.[6]
- isovaleryl-CoA + 3 malonyl-CoA → 4 coASH + 3 co2 + 3-methyl-1-2(2,4,6-트리히드록시페닐)부탄-1-1-1
- 3-메틸-1-(2,4,6-트리히드록시페닐)부탄-1-1+2DMAPP →CHO21305
리서치
휴뮬론은 가능한 GABAA 수용체 활성이나[7][8] 항균 효과와 같은 생물학적 성질을 가지고 있는지를 확인하기 위해 체외 연구와 함께 기초 연구를 하고 있다.[9]
참조
- ^ a b Urban, Jan; Dahlberg, Clinton; Carroll, Brian; Kaminsky, Werner (2013). "Absolute Configuration of Beer's Bitter Compounds". Angew. Chem. Int. Ed. 52 (5): 1553–1555. doi:10.1002/anie.201208450. PMC 3563212. PMID 23239507.
- ^ De Keukeleire, J; Ooms, G; Heyerick, A; Roldan-Ruiz, I; Van Bockstaele, E; De Keukeleire, D (2003). "Formation and accumulation of alpha-acids, beta-acids, desmethylxanthohumol, and xanthohumol during flowering of hops (Humulus lupulus L.)". Journal of Agricultural and Food Chemistry. 51 (15): 4436–41. doi:10.1021/jf034263z. PMID 12848522.
- ^ Blanco, C. A.; Rojas, A; Caballero, P. A.; Ronda, F; Gomez, M; Caballero, I., “A better control of beer properties by predicting acidity of hop iso-α-acids”, Trends in Food Science & Technology, Volume 17, Issue 7, July 2006, Pages 373-377, ISSN 0924-2244, doi:10.1016/j.tifs.2005.11.012.
- ^ 에슬링거, H. M.과 나르지스, L. 2003."비어" 울만의 산업 화학 백과사전Wiley-VCH Verlag GmbH & Co. KGAA, 2009 doi:10.1002/14356007.a03_421
- ^ Obara; et al. (1989). "A Synthetic Route to (±)-humulone". Bull. Chem. Soc. Jpn. 62 (9): 3034–3035. doi:10.1246/bcsj.62.3034.
- ^ M. Goese; K. Kammhuber; A. Bacher; M. H. Zenk; W. Eisenreich (1999). "Biosynthesis of bitter acids in hops. A (13)C-NMR and (2)H-NMR study on the building blocks of humulone". FEBS Journal. 263 (2): 447–454. doi:10.1046/j.1432-1327.1999.00518.x. PMID 10406953.
- ^ Benkherouf, Ali Y.; Eerola, Kim; Soini, Sanna L.; Uusi-Oukari, Mikko (2020). "Humulone Modulation of GABAA Receptors and Its Role in Hops Sleep-Promoting Activity". Frontiers in Neuroscience. 14: 594708. doi:10.3389/fnins.2020.594708. ISSN 1662-453X. PMC 7591795. PMID 33177986.
- ^ Benkherouf, Ali Y.; Logrén, Nora; Somborac, Tamara; Kortesniemi, Maaria; Soini, Sanna L.; Yang, Baoru; Salo-Ahen, Outi M.H.; Laaksonen, Oskar; Uusi-Oukari, Mikko (2020-04-01). "Hops compounds modulatory effects and 6-prenylnaringenin dual mode of action on GABAA receptors". European Journal of Pharmacology. 873: 172962. doi:10.1016/j.ejphar.2020.172962. PMID 32001220.
- ^ Yamaguchi, N; Satoh-Yamaguchi, K; Ono, M (2009). "In vitro evaluation of antibacterial, anticollagenase, and antioxidant activities of hop components (Humulus lupulus) addressing acne vulgaris". Phytomedicine. 16 (4): 369–76. doi:10.1016/j.phymed.2008.12.021. PMID 19201179.




