HLA-A
HLA-A| MHC 클래스 I, A | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| (수평자) | ||||||||||
 HLA-A의 삽화 | ||||||||||
| 단백질형 | 트랜섬브레인단백질 | |||||||||
| 함수 | 면역인식을 위한 펩타이드 프리젠테이션 | |||||||||
| ||||||||||
HLA-A는 인간 염색체 6p21.3에 위치한 HLA-A 로쿠스에 의해 암호화된 인간 백혈구 항원(HLA)의 그룹이다.[1]HLA는 인간 특유의 주요 조직적합성 복합체(MHC) 항원이다.HLA-A는 인간 MHC 등급 I transmbrane 단백질의 세 가지 주요 유형 중 하나이다.다른 이들은 HLA-B와 HLA-C이다.[2]단백질은 헤테로디머로, 무거운 α 사슬과 더 작은 β 사슬로 구성되어 있다.α 체인은 변종 HLA-A 유전자에 의해 인코딩되며, β 체인(β-마이크로글로불린2)은 불변성 β2 마이크로글로불린 분자다.[3]β2 마이크로글로불린 단백질은 인간의 15q21.1 염색체에 위치한 [4]B2M 유전자에 의해 암호화된다.[5]
HLA-A와 같은 MHC Class I 분자는 면역체계에 짧은 폴리펩타이드 성분을 나타내는 과정의 일부다.이 폴리펩타이드들은 일반적으로 길이가 7-11인 아미노산이며 세포에 의해 발현되는 단백질에서 유래한다.HLA 단백질에 의해 발현될 수 있는 폴리펩타이드에는 세포(자체)에 의해 발현되어야 하는 것과 외국 유도(비자체)의 두 가지 등급이 있다.[6]정상적인 상태에서는 보통 혈액 속의 몸을 순시하는 세포독성 T세포가 콤플렉스에 의해 제시된 펩타이드의 "읽기"를 한다.T세포는 제대로 기능하면 비자체 펩타이드에만 결합한다.구속력이 발생하면 일련의 사건이 시작되어 세포 사멸을 통해 최고조에 이른다.[7]이렇게 해서 인체는 바이러스에 감염되거나 해서는 안 되는 단백질(예: 암세포)을 발현하는 어떤 세포도 제거한다.
대부분의 포유류 개체군에서와 마찬가지로 인간에게 있어 MHC Class I 분자는 1차 구조에서 매우 가변적이며, HLA-A는 가장 빠르게 진화하는 코딩 시퀀스로 인간의 유전자 중 한 곳에 랭크되어 있다.2013년 12월 현재, 알려진 HLA-A 알레르기는 1740개의 활성 단백질과 117개의 무효 단백질에 대한 코딩이 있다.[2]기증자와 호스트 사이의 임의 이식이 HLA-A, B 또는 C 항원의 일치로 이어질 가능성이 낮기 때문에 MHC Class I에 대한 이러한 수준의 변동은 이식 거부의 주요 원인이다.진화 생물학자들은 또한 HLAs의 광범위한 변화는 상충하는 병원성 압력 사이의 균형 작용의 결과라고 믿는다.HLA의 다양성은 특정 개체가 각 병원체에 대한 내성이 강하기 때문에 단일 병원체에 의해 전체 개체군이 소실될 확률을 감소시킨다.[6]HLA-A 변형이 HIV/AIDS 진행에 미치는 영향은 아래에 설명되어 있다.
HLA-A유전자
HLA-A 유전자는 6번 염색체의 짧은 팔에 위치하며 HLA-A의 구성 요소인 더 큰 α-체인(α-chain)을 인코딩한다. HLA-A α-체인의 변형은 HLA 기능의 핵심이다.이러한 변화는 인구의 유전적 다양성을 촉진한다.각 HLA는 특정 구조물의 펩타이드에 대한 친화력이 다르기 때문에 HLA의 다양성이 크다는 것은 세포 표면에 '표시'될 항원이 더 다양하다는 것을 의미하며, 이는 인구의 일부가 주어진 외래 침입자에 내성을 가질 가능성을 높여준다.이것은 단일 병원체가 전체 인구를 소탕할 수 있는 능력을 가지고 있을 가능성을 감소시킨다.
각 개인은 HLA-A의 두 종류까지 표현할 수 있으며, 각 부모로부터 한 종류씩이다.일부 개인은 양부모로부터 동일한 HLA-A를 상속받아 개인의 HLA 다양성을 감소시키지만, 개인 대다수는 HLA-A를 두 부씩 받게 된다.이 같은 패턴은 모든 HLA 그룹에 적용된다.[12]즉, 모든 사람은 알려진 2432개의 HLA-A 주장 중 한 두 개만 표현할 수 있다.
알레르스
모든 HLA에는 세계보건기구(WHO) HLA 시스템 요인에 대한 명명위원회가 이름을 할당한다.이 명칭은 명칭을 가능한 한 짧게 유지하면서 특정 대립에 대한 가장 많은 정보를 제공하기 위해 구성되었다.HLA 이름은 다음과 같이 보인다.
HLA-A*02:01:01:02L
모든 알레르기는 최소 4자리수 분류(HLA-A*02:12)를 받는다.A는 알레르기가 어떤 HLA 유전자에 속하는지 나타낸다.HLA-A 알레르기가 많아 세로타입에 의한 분류가 단순화된다.다음 한 쌍의 숫자는 이 할당을 나타낸다.예를 들어 HLA-A*02:02, HLA-A*02:04, HLA-A*02:324는 모두 A2 세로타입( *02 접두사 지정)의 멤버다.[2]이 그룹은 HLA 호환성을 담당하는 주요 요인이다.이 이후의 모든 숫자는 세로타입으로 결정할 수 없으며 유전자 염기서열을 통해 지정된다.두 번째 자릿수는 HLA 단백질이 생성되는 것을 나타낸다.이러한 단백질은 발견 순서대로 할당되며, 2013년 12월 현재 456개의 서로 다른 HLA-A*02:01 - HLA-A*02:456개의 단백질이 알려져 있다(할당명 HLA-A*02:456가장 짧은 HLA 이름에는 이 두 가지 세부사항이 모두 포함되어 있다.[1]그 이상의 각 확장은 코딩 영역 내의 동의어 돌연변이와 코딩 영역 밖의 돌연변이를 의미한다.확장자의 해석은 현재의 HLA 명명 시스템에서 더 자세히 다룬다.
단백질
HLA-A 유전자에 의해 암호화된 단백질은 길이 365개의 아미노산이고 무게는 약 41,000 Da(Da)이다.[13]그것은 8개의 엑손들을 포함하고 있다.[14]
| 엑손 | 단백질 세그먼트 |
|---|---|
| 1 | 시그널 펩타이드 |
| 2 | α1 영역 |
| 3 | α2 영역 |
| 4 | α3 영역 |
| 5 | 트랜스엠브레인 지역 |
| 6 | 세포질 꼬리 |
| 7 | 세포질 꼬리 |
| 8 | 지정되지 않음 |
HLA-A 신호 펩타이드란 단백질의 N단자에 존재하는 소수성 아미노산의 시리즈로, 나머지 7개 영역이 번역되는 소포체 망막으로 유도한다.[13][14][15]3 α 도메인은 CD8+ t-cells에 표시할 펩타이드를 고정하는 결합 홈을 형성한다.트랜섬브레인 영역은 ER 루멘을 둘러싸고 있는 인지질 빌레이어에 내장된 영역이다.[14]HLA-A 단백질은 단일 패스 투과성 단백질이다.[13]즉 단백질의 처음 4개 영역은 ER 루멘 내부에 있는 반면 마지막 3개 영역은 루멘 외부에 있어 단백질에게 적절한 기능에 필요한 방향을 부여한다.단백질의 마지막 세 영역은 세포의 세포질에 남아 있는 주로 β-시트의 꼬리를 형성한다.[14]
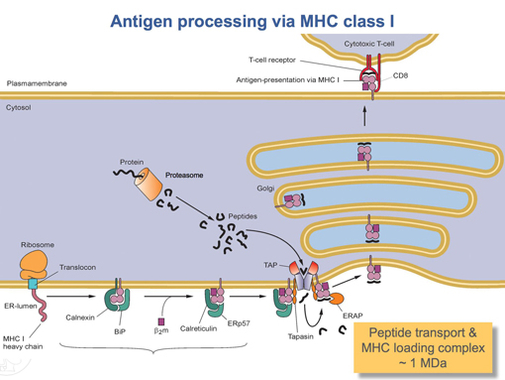
HLA-A 단백질이 완전히 번역되면 반드시 적절한 모양으로 접어야 한다.칼넥신이라는 분자 체세포 단백질과 ERP57이라는 효소가 접히는 과정을 돕는다.칼넥신은 HLA-A 헤비 체인을, 에르프57은 헤비 체인과 가벼운 β-마이크로글로불린2 체인의 이황화 결합을 촉매로 한다.이 결합은 무거운 체인에 순응적인 변화를 유도하여 결합 홈을 형성한다.그런 다음 칼넥신은 현재 펩타이드 로드 콤플렉스로 불리는 복합체와 분리되며, 또 다른 샤페론 단백질인 칼레티쿨린으로 대체된다.짧은 펩타이드들은 TAP라고 불리는 특별한 운반 단백질에 의해 세포주위에서 ER 루멘으로 지속적으로 운반된다.그런 다음 TAP는 타파신이라는 또 다른 단백질과 함께 펩타이드 로드 콤플렉스에 결합한다.이 때 펩타이드 하중 복합체는 HLA-A(헤비 체인), β-마이크로글로불린2(라이트 체인), ERP57 효소, 칼레티쿨린 샤페론 단백질, TAP(결합 펩타이드 파편 포함), 타파신 등으로 구성된다.타파신은 전체 펩타이드 하중 복합체를 안정시키는 것 외에도 TAP의 안정성을 높인다.이 때 TAP는 ER 루멘으로 운반된 펩타이드 성분을 방출한다.TAP에 HLA-A 결합 홈의 근접성은 펩타이드 하중 복합체에 의해 보장된다.이것은 펩타이드의 홈을 찾을 가능성을 증가시킨다.HLA-A 단백질에 대한 펩타이드의 친화력이 충분히 좋으면 홈에 결합한다.[17]연구 결과 타파신이 TAP의 펩타이드들을 HLA-A 콤플렉스에 능동적으로 적재하는 동시에 고친화성 펩타이드의 결합이 될 때까지 ER 루멘의 I급 분자를 보유할 수 있다고 한다.[18]
충분히 친화력이 높은 펩타이드가 클래스 I MHC에 접착된 후 칼레티쿨린, ERP57, TAP, 타파신이 분자를 방출한다.[17]이 때 I등급 콤플렉스는 β-마이크로글로불린에2 결합된 HLA-A 단백질과 짧은 펩타이드로 구성된다.그것은 여전히 트랜섬브레인 영역에 의해 ER 막에 고정되어 있다.어느 순간 ER이 신호를 수신하고 콤플렉스를 고정하는 막의 부분이 싹을 틔워 골지 본체로 이송되어 추가 처리를 하게 된다.골지체에서, 콤플렉스는 다시 베시클 수송을 통해 세포막으로 운반된다.앞서 언급한 방향성이 중요해지는 시점이다.펩타이드 함유 HLA-A 복합체의 부분은 세포막의 외부 표면에 있어야 한다.이것은 세포막과 vesicle 융합에 의해 이루어진다.[15]
함수
자연함수
MHC Class I 분자는 면역체계에 일반적으로 7-10개의 아미노산인 작은 펩타이드들을 나타낸다.CD8이라고 불리는 당단백질은 HLA-A의 α3 영역의 223-229 잔류물에 결합되며, 이 당단백질은 세포독성(CD8+) T-림프세포와 등급 I MHC의 t세포 수용체 사이의 상호작용을 안정시킨다.[19]T-세포 수용체는 또한 MHC에 의해 제시되는 펩타이드에 결합할 수 있는 잠재력을 가지고 있다.제대로 기능하는 면역 체계에서는 자기 펩타이드를 결합하지 않는 T세포만이 흉선 밖으로 나올 수 있으므로, T세포가 펩타이드에 결합하면 반드시 외래 또는 비정상 펩타이드여야 한다.그리고 나서 T세포는 세포사멸 또는 프로그램된 세포사멸을 개시한다.이 과정은 비록 일반적으로 죽음이 명백해지는데 몇 시간이 걸리지만, 초기 외국 항원 발표 후 5분 정도 빠르게 일어날 수 있다.[20]이 과정은 후천성 면역의 기초가 되며 바이러스와 다른 세포내 병원균에 대한 일차적인 방어 역할을 한다.
기타 활동
1960년대에 이르러 기증된 장기와 조직의 요인들이 숙주의 면역체계에 의해 기증된 조직의 파괴를 초래하는 경우가 종종 있다는 것이 명백해졌다.MHC는 원래 이러한 관찰의 결과로 발견되었다(자세한 내용은 HLA의 이력 참조).[6]펩타이드 프리젠테이션 콤플렉스는 클래스 I과 클래스 II MHC 두 종류가 있다.이들 각각은 여러 개의 HLA 유전자를 가지고 있으며, 그 중 HLA-A는 한 개에 불과하다.기증자와 수혜자 사이에 일치해야 하는 주요 HLA는 3가지다.그들은 HLA-A, HLA-B, (둘 다 클래스 I MHC)와 HLA-DR (클래스 II MHC)이다.[12]두 조직이 이 세 HLA에 대해 동일한 유전자 코딩을 갖는다면, 거부반응의 가능성과 심각성을 최소화한다.[21]
질병에서의 역할
| 연관병 | 세로타입스 | ||
| 안키로싱스폰딜리스 | A24 | ||
| 당뇨병, 제1형[22] | A1 | A24 | |
| 혈색소증(하위 CD8+세포) | A3 | ||
| 마이스테니아 그라비스 | A3 | A24 | A30 |
| 백혈병, T세포, 성인 | A26 | A68년 | |
| 다발성 경화증 | A3 | ||
| 유두종 바이러스 수셉트. | A11 | ||
| 자연낙태 | A2 | ||
HLAs는 면역 체계와 세포 안에서 일어나는 일들 사이의 유일한 연결고리 역할을 한다.따라서 특정 펩타이드에 대한 결합을 감소시키거나 특정 펩타이드에 대한 결합을 증가시키더라도 HLA 부분의 변화는 각각 질병에 대한 민감성 증가 또는 질병에 대한 민감성 감소로 표현된다.즉, 특정 HLA는 병원성 단백질의 단백질 분해에 의해 생성된 짧은 펩타이드 중 어떤 것도 결합할 수 없다.이런 경우라면 면역체계가 세포가 감염됐다는 사실을 알 길이 없다.따라서 감염은 대부분 억제되지 않은 채 증식할 수 있다.그것은 반대로 작용하기도 한다.일부 HLA는 병원성 펩타이드 파편을 매우 높은 친화력으로 결합한다.이것은 본질적으로 그 특정한 병원체에 관한 그들의 면역체계를 "과대하게" 하여 그들이 그렇지 않으면 파괴적일 수 있는 감염을 관리할 수 있게 한다.[6]
HIV/에이즈
병원체의 차등 면역 조절에 대한 가장 연구된 예들 중 하나는 인간 면역 결핍 바이러스다.HIV는 RNA 바이러스이기 때문에 엄청나게 빨리 변이된다.이것은 단백질분해를 통해 생성된 펩타이드들을 변화시키고, 이것은 감염된 세포의 MHC에 의해 면역체계에 나타날 수 있는 펩타이드들을 변화시킨다.특정 HLA에 대한 친화력이 높은 펩타이드를 생성하는 돌연변이를 가진 바이러스는 면역체계에 의해 빠르게 죽임을 당하기 때문에 생존하지 못하고 그 친화력이 높은 펩타이드가 더 이상 생성되지 않는다.그러나, HIV 조차도 게놈에 보존된 부분이 있고, HLA가 보존된 지역에서 생산되는 펩타이드에 결합할 수 있다면, 면역 발견과 파괴를 피하기 위해 HIV가 할 수 있는 일은 거의 없다는 것이 밝혀졌다.[6]이것은 HLA 매개 차등 HIV 부하에 대한 원칙이다.
2000개가 넘는 HLA-A 코드화된 MHC의 변화로, 모든 변형이 HIV 부하에 미치는 영향을 판단하기는 어렵다.그러나 몇몇 선택받은 사람들이 연루되었다.HLA-A*30은 바이러스 부하가 상당히 낮은 것으로 간주되는 1만 부/큐빅 밀리미터 미만으로 감소하는 것으로 나타났다.반면 HLA-A*02는 HLA-B*45와 관련되었을 때 높은 바이러스 부하(10만 부/큐빅 밀리미터 이상)에 관련되었다.또한 HLA-A*23-C*07 및 HLA-A*02-C*16의 형태는 일반적으로 잠비아인의 표본 모집단 내에서 증가된 바이러스 부하를 나타냈다.HIV를 억제하는 가장 효과적인 하플로타입 중 하나는 HLA-A*30-C*03이었고, 가장 덜 효과적인 것 중 하나는 HLA-A*23*B*14였다.요약하자면, HLA-A*23은 표본 모집단 중 HIV 부하 증가와 높은 상관관계를 보였지만, 민족이 다른 표본에 걸쳐 이러한 상관관계가 유의해야 한다.[23]
개별 HLA 유전자의 영향과 HIV 존재에 대한 논쟁의 분류는 어렵지만, 여전히 몇 가지 강력한 결론을 내릴 수 있다.하나 이상의 클래스 I HLA 유전자에 동질성이 있는 개인은 전형적으로 이질성보다 훨씬 더 빠르게 에이즈로 발전한다.일부 동란체 개인에서는 진행률이 이단체보다 두 배나 높다.이 차등 진행은 이질성의 정도와 상당히 밀접하게 연관되어 있다.[24]요약하면, 특정 HLA-A 알레르기는 HIV 감염 환자의 다른 바이러스 부하와 연관되어 있다. 그러나, 이들 알레르기의 다양성 때문에, 에이즈의 면역 규제에 대한 알레르기의 모든 영향을 분류하는 것은 어렵다.그럼에도 불구하고 HLA-A의 주장에서 이질성을 에이즈 진행률 감소와 연관시킬 수 있다.
특정 HLA에 대한 저항력 증가 또는 감소만을 처방할 뿐만 아니라 HIV는 HLA 표현을 바꿀 수 있으며, 선택적으로 자연 킬러 세포(NK 세포)에 의한 제거 감소로 이어진다.연구는 HIV가 감염된 세포의 1급 MHC 발현을 규제한다는 것을 보여주었다.그러나 무분별하게 그렇게 함으로써 NK세포가 HLA-C와 HLA-E의 하향규제에 반응하기 때문에 NK세포에 의한 공격의 기회를 열게 된다. 분명히, 이 메커니즘은 HIV 바이러스에 선택적인 압력을 가했다.따라서, HIV는 HLA-C과 HLA-E.[25]의는 단백질에 HIV게놈, 부정적인 조절 인자(네프), 코딩이 적용되는 한편 여전히 소포체로나 가끔에 있어서 MHC은 계급의 세포질 꼬리에 묶음으로써 이 변화를 유도의 표현을 방해하지 않고 HLA-A과 HLA-B downregulate 능력 발전해 왔다.wh골지 시체를 통한 인신매매의 초기 단계에 있다.MHC와 Nef의 이 복합체는 MHC가 정상적으로 기능하는 세포막 대신 분해하기 위해 어댑터 단백질 1(AP-1)을 리소솜으로 유도한다.[26]선택적 HLA 하향조정 외에도 음성 규제인자(Nef)를 통해 HIV가 CD4와 CD8을 하향조정할 수 있다.이러한 당단백질은 각각 MHC에 대한 도우미 t-세포와 세포독성 t-세포 결합에 필수적이다.이러한 공작용제가 없다면, HLA가 HIV 유도(비자체) 펩타이드를 발현하더라도, 두 종류의 t세포는 HLA에 결합하여 세포사멸을 일으킬 가능성이 낮다.이 두 단백질은 또한 세포질 꼬리 영역을 대상으로 한다.[26]이러한 능력들의 조합은 면역체계에 의한 발견을 피하는 HIV의 능력을 크게 향상시킨다.
요약
HLA-A는 인간 클래스 I MHC의 특정 그룹이다.그것은 수백 개의 다른 유전자와 수천 개의 변형된 대립으로 구성되어 있다.HLA-A는 바이러스와 다른 세포 내 병원체에 대한 세포독성 t세포 제어 면역 반응에 매우 중요하다.각 HLA-A 유전자는 약간 다른 펩타이드에 대한 친화력이 높기 때문에 특정 HLA-As는 위험 증가, 더 빠른 진행 및/또는 많은 질병의 심각도 증가와 관련이 있다.유사한 이유로 HLA-A 매칭은 성공적인 조직 이식에 필수적이다.
참조
- ^ a b "HLA Nomenclature @ hla.alleles.org". Anthony Nolan Research Institute. 10 Nov 2013. Retrieved 8 Dec 2013.
- ^ a b c "Statistics". European Bioinformatics Institute (EBI) / European Molecular Biology Laboratory (EMBL). Retrieved 13 Dec 2013.
- ^ Delves PJ (Aug 2013). "Human Leukocyte Antigen (HLA) System: Biology of the Immune System". Merck Manual Professional. Merck Sharp & Dohme Corp. Retrieved 14 Dec 2013.
- ^ "B2M Gene". GeneCards. Weizmann Institute of Science. 7 Nov 2013. Retrieved 14 Dec 2013.
- ^ "OMIM Entry - * 109700 - BETA-2-MICROGLOBULIN;B2M". Online Mendelian Inheritance in Man. Johns Hopkins University. 5 Aug 2016. Retrieved 14 May 2021.
- ^ a b c d e Daniel M. Davis (2014). The Compatibility Gene. How Our Bodies Fight Disease, Attract Others, and Define Our Selves. Oxford: Oxford University Press. ISBN 978-0-19-931641-0.
- ^ Accorsi D (14 Sep 2012). "MHC class I assembly and presentation". YouTube. Retrieved 8 Dec 2013.
- ^ a b c ENSG00000224320, ENSG00000206503, ENSG00000223980, ENSG00000229215, ENSG00000227715, ENSG00000235657, ENSG00000231834 GRCh38: Ensembl release 89: ENSG00000206505, ENSG00000224320, ENSG00000206503, ENSG00000223980, ENSG00000229215, ENSG00000227715, ENSG00000235657, ENSG00000231834 - Ensembl, May 2017
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000091705 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b Fix M (1998). "HLA Matching, Antibodies, and You". Kidney Transplantation: Past, Present, and Future. University of Michigan Medical Center/Stanford University. Retrieved 14 Dec 2013.
- ^ a b c "Major Histocompatibility Complex, Class I, A". Gene Cards. Weizmann Institute of Science. 7 November 2013. Retrieved 16 December 2013.
- ^ a b c d "HLA-A major histocompatibility complex, class I, A [Homo sapiens (human)]". National Center for Biotechnology Information. U.S. National Library of Medicine. 12 December 2013. Retrieved 16 December 2013.
- ^ a b Alberts, Bruce (2010). Essential Cell Biology (Third ed.). Garland Science. ISBN 9780815341291.
- ^ Tampé, Robert. "P16 Translocation mechanism and viral inhibition of the MHC I peptide-loading complex". Molecular Understanding of Transmembrane Processes. Institute of Biochemistry Biocenter. Retrieved 16 December 2013.
- ^ a b Accorsi, Diego (14 September 2012). "MHC class I assembly and presentation". Immunology Toronto. Department of Immunology and Biochemistry and Biomedical Communications at the University of Toronto. Retrieved 16 December 2013.
- ^ Grandea AG, Van Kaer L (April 2001). "Tapasin: an ER chaperone that controls MHC class I assembly with peptide". Trends in Immunology. 22 (4): 194–9. doi:10.1016/S1471-4906(01)01861-0. PMID 11274924.
- ^ "CD8". T-cell Modulation Group. tcells.org. 2009. Archived from the original on 18 February 2013. Retrieved 17 December 2013.
- ^ Janeway, Charles A. (2001). "8". Immunobiology the immune system health & disease (5. ed.). New York: Garland. ISBN 978-0815336426. Retrieved 17 December 2013.
- ^ Solomon S, Pitossi F, Rao MS (February 2015). "Banking on iPSC--is it doable and is it worthwhile". Stem Cell Reviews. 11 (1): 1–10. doi:10.1007/s12015-014-9574-4. PMC 4333229. PMID 25516409.
- ^ Noble JA, Valdes AM, Bugawan TL, Apple RJ, Thomson G, Erlich HA (August 2002). "The HLA class I A locus affects susceptibility to type 1 diabetes". Human Immunology. 63 (8): 657–64. doi:10.1016/S0198-8859(02)00421-4. PMC 4049513. PMID 12121673.
- ^ Tang J, Tang S, Lobashevsky E, Myracle AD, Fideli U, Aldrovandi G, Allen S, Musonda R, Kaslow RA (August 2002). "Favorable and unfavorable HLA class I alleles and haplotypes in Zambians predominantly infected with clade C human immunodeficiency virus type 1". Journal of Virology. 76 (16): 8276–84. doi:10.1128/JVI.76.16.8276-8284.2002. PMC 155130. PMID 12134033.
- ^ Carrington M, Nelson GW, Martin MP, Kissner T, Vlahov D, Goedert JJ, Kaslow R, Buchbinder S, Hoots K, O'Brien SJ (March 1999). "HLA and HIV-1: heterozygote advantage and B*35-Cw*04 disadvantage". Science. 283 (5408): 1748–52. Bibcode:1999Sci...283.1748C. doi:10.1126/science.283.5408.1748. PMID 10073943.
- ^ Cohen GB, Gandhi RT, Davis DM, Mandelboim O, Chen BK, Strominger JL, Baltimore D (June 1999). "The selective downregulation of class I major histocompatibility complex proteins by HIV-1 protects HIV-infected cells from NK cells". Immunity. 10 (6): 661–71. doi:10.1016/S1074-7613(00)80065-5. PMID 10403641.
- ^ a b Leonard JA, Filzen T, Carter CC, Schaefer M, Collins KL (July 2011). "HIV-1 Nef disrupts intracellular trafficking of major histocompatibility complex class I, CD4, CD8, and CD28 by distinct pathways that share common elements". Journal of Virology. 85 (14): 6867–81. doi:10.1128/JVI.00229-11. PMC 3126561. PMID 21543478.
외부 링크
- 분자인류학 야후 그룹
- HLA 알레르 및 Happlotype 주파수 데이터베이스
- HLA 명명법 I급 단백질 전체 목록
- PDB에서 UniProt: P04439(HLA 클래스 I 조직적합성 항원, A 알파 체인)에 대해 PDB에서 사용할 수 있는 모든 구조 정보의 개요.