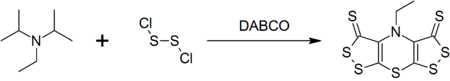N,N-다이소프로필틸아민
N,N-Diisopropylethylamine | |||
 | |||
| | |||
| 이름 | |||
|---|---|---|---|
| 선호 IUPAC 이름 N-에틸-N-(프로판-2-yl)프로판-2-아민 | |||
기타 이름
| |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 켐스파이더 | |||
| ECHA InfoCard | 100.027.629 | ||
| EC 번호 |
| ||
| 메슈 | N,N-다이소프로필틸아민 | ||
펍켐 CID | |||
| 유니 | |||
| UN 번호 | 2733 | ||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| C8H19N | |||
| 어금질량 | 129.247 g·190−1 | ||
| 외관 | 무색액 | ||
| 냄새 | 비린, 암모니아칼 | ||
| 밀도 | 0.742 g mL−1 | ||
| 녹는점 | -50 ~ -46°C(-58 ~ -51°F, 223 ~ 227K) | ||
| 비등점 | 126.6°C, 259.8°F, 399.7K | ||
| 4.01 g/L(20°C에서) | |||
| 증기압 | 4.1 kPa(37.70 °C) | ||
굴절률(nD) | 1.414 | ||
| 위험 | |||
| GHS 라벨 표시: | |||
   | |||
| 위험 | |||
| H225, H301, H314, H412 | |||
| P210, P273, P280, P301+P310, P305+P351+P338, P310 | |||
| 플래시 포인트 | 10°C(50°F, 283K) | ||
| 폭발 한계 | 0.7–6.3% | ||
| 치사량 또는 농도(LD, LC): | |||
LD50(중간 선량) | 200–500 mg kg−1(도덕, 랫드) | ||
| 관련 화합물 | |||
관련아민 | |||
관련 화합물 | |||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
N, N-Diosopropyletylamine 또는 Hünig의 베이스는 유기 화합물이며 아민이다. 독일의 화학자 지그프리드 후니그의 이름을 따서 지은 것이다. 유기화학에 베이스로 쓰인다. 일반적으로 DIPEA, DEA 또는 i-PrNEt로2 약칭된다.
구조
DIPEA는 에틸 그룹과 2개의 이소프로필 그룹에 결합되는 중앙 질소로 구성된다. 한 쌍의 전자가 질소 원자에 존재하는데, 질소 원자는 전기영양체와 반응할 수 있다. 그러나 두 이소프로필 그룹과 에틸 그룹이 질소를 둘러싼 공간의 상당 부분을 차지하기 때문에 양성자와 같은 작은 전기소체만이 질소 단독쌍과 반응할 수 있다.
발생 및 준비
DIPEA는 상업적으로 이용 가능하다. 전통적으로 디에틸 황산염과 함께 디이소프로필아민 알키플레이션에 의해 준비된다.[1]
순수 DIPEA는 비록 상업용 샘플은 약간 노란색이 될 수 있지만 무색의 액체로 존재한다. 필요한 경우 수산화칼륨이나[2] 수산화칼슘에서 증류하여 화합물을 정제할 수 있다.[3]
사용 및 반응
DIPEA는 일반적으로 양성자 스캐빈저로 사용되는, 강직적으로 방해를 받는 유기적 기반이다. 따라서 2,2,6,6-테트라메틸피페리딘과 트리에틸아민처럼 DIPEA는 염기성은 좋으나 핵포화성이 좋지 않아 상업적 과정에서는 용해성이 매우 낮아 상업적 과정에서는 매우 쉽게 회복되어 유용한 유기 시약이 된다.[4]
아미드 결합
그것은 일반적으로 카르복실산(예를 들어, 아래 그림과 같이 염화산으로서 일반적으로 활성화됨)과 핵포실 아민 사이의 아미드 결합 반응에서 방해된 기저로 사용된다.[5] DIPEA는 방해받고 핵소독성이 떨어지기 때문에 결합 반응에서 핵소독 아민과 경쟁하지 않는다.
알킬링스
DIPEA는 2차 아민에서 3차 아민까지 알킬 할로겐화물에 의한 알킬화 시약에 선택적 시약으로 사용한 것으로 조사되었다. 이것은 종종 2차 암모늄 소금을 형성하는 원치 않는 멘슈트킨 반응에 의해 방해되지만, DIPEA가 존재할 때는 없다.[6]
전이 금속은 교차 결합 반응 촉매
DIPEA는 Heck 커플링과 Sonogashira 커플링(아래 그림 참조)[7]과 같은 다수의 전환 금속 촉매 교차 결합 반응의 베이스로 사용될 수 있다.
스웨른 산화
트리에틸아민은 전통적으로 스웨른 산화의 방해를 받는 베이스로 사용되지만, 구조적으로 유사한 DIPEA를 대신 사용할 수 있다(아래 예시).[8]
기질로 사용되는 DIPEA의 예
DIPEA는 DABCO에 의해 1-pot 합성으로 촉매되는 이황 디클로로이드와의 반응으로 스콜피온(bis,[1,2]디티올로)-[1,4]티아진)이라는 복합 헤테로사이클릭 화합물을 형성한다.[9]
트리에틸아민과의 비교
DIPEA와 트리에틸아민은 구조적으로 매우 유사하며, 두 화합물 모두 유기 염기에 방해가 되는 것으로 간주된다. 구조 유사성 때문에 DIPEA와 트리에틸아민은 대부분의 용도에서 서로 교환하여 사용할 수 있다. DIPEA의 질소 원자는 트리에틸아민에 있는 질소 원자보다 더 차폐되어 있다. 그러나 트리에틸아민은 DIPEA보다 약간 강한 염기인데, 황산화 디메틸의 각 결합산의 pK는a 각각 9.0과 8.5이다.[10]
참조
- ^ Hünig, S.; Kiessel, M. (1958). "Spezifische Protonenacceptoren als Hilfsbasen bei Alkylierungs- und Dehydrohalogenierungsreaktionen". Chemische Berichte. 91 (2): 380–392. doi:10.1002/cber.19580910223.
- ^ Armarego, W. L. F. (2012-10-17). Purification of Laboratory Chemicals. Chai, Christina Li Lin (Seventh ed.). Amsterdam. ISBN 9780123821621. OCLC 820853648.
- ^ Keiper, Sonja; Vyle, Joseph S. (2006-05-12). "Reversible Photocontrol of Deoxyribozyme-Catalyzed RNA Cleavage under Multiple-Turnover Conditions". Angewandte Chemie International Edition. 45 (20): 3306–3309. doi:10.1002/anie.200600164. ISSN 1433-7851. PMID 16619331.
- ^ Sorgi, K. L. (2001). "Diisopropylethylamine". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rd254. ISBN 978-0471936237.
- ^ Dunetz, Joshua R.; Magano, Javier; Weisenburger, Gerald A. (2016-02-05). "Large-Scale Applications of Amide Coupling Reagents for the Synthesis of Pharmaceuticals". Organic Process Research & Development. 20 (2): 140–177. doi:10.1021/op500305s. ISSN 1083-6160.
- ^ Moore, J. L.; Taylor, S. M.; Soloshonok, V. A. (2005). "An efficient and operationally convenient general synthesis of tertiary amines by direct alkylation of secondary amines with alkyl halides in the presence of Huenig's base". Arkivoc. 2005 (part vi): 287–292. doi:10.3998/ark.5550190.0006.624. EJ-1549C. Archived from the original on 2008-03-04. Retrieved 2006-06-16.
- ^ Chinchilla, Rafael; Nájera, Carmen (2011). "Recent advances in Sonogashira reactions". Chemical Society Reviews. 40 (10): 5084–5121. doi:10.1039/c1cs15071e. ISSN 0306-0012. PMID 21655588.
- ^ Walba, David M.; Thurmes, William N.; Haltiwanger, R. Curtis (1988). "A highly stereocontrolled route to the monensin spiroketal ring system". The Journal of Organic Chemistry. 53 (5): 1046–1056. doi:10.1021/jo00240a022. ISSN 0022-3263.
- ^ Rees, W.; Marcos, C. F.; Polo, C.; Torroba, T.; Rakitin O. A. (1997). "From Hünig's Base to Bis([1,2]dithiolo)-[1,4]thiazines in One Pot: The Fast Route to Highly Sulfurated Heterocycles". Angewandte Chemie International Edition. 36 (3): 281–283. doi:10.1002/anie.199702811.
- ^ Lepore, Salvatore D.; Khoram, Anita; Bromfield, Deborah C.; Cohn, Pamela; Jairaj, Vinod; Silvestri, Maximilian A. (2005). "Studies on the Manganese-Mediated Isomerization of Alkynyl Carbonyls to Allenyl Carbonyls". The Journal of Organic Chemistry. 70 (18): 7443–7446. doi:10.1021/jo051040u. ISSN 0022-3263. PMID 16122274.