신코펜
Cinchophen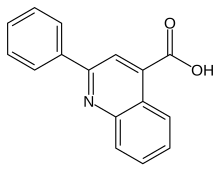 | |
| 임상자료 | |
|---|---|
| AHFS/Drugs.com | 국제 마약 이름 |
| ATC 코드 | |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 켐벨 | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.004.608 |
| 화학 및 물리적 데이터 | |
| 공식 | C16H11NO2 |
| 어금질량 | 249.269 g·1911−1 |
| 3D 모델(JSmol) | |
| |
| |
| (iii) | |
신코펜(무역명 아토판, 퀴노판, 페나킨)은 1887년 둠브너&기스켈이 처음 생산한 진통제로 통풍 치료제로 1908년 상업적으로 도입됐다.이 약은 여전히 동물들의 관절염을 치료하기 위해 수의사들이 프레드니솔론과 결합하여 사용하고 있다.절대 에탄올에 들어있는 아닐린, 벤잘데히드, 피루빅산부터 준비할 수 있다.[1]이 약은 신코펜이 심각한 간 손상을 일으킬 수 있다는 발견으로 인해 1930년대에 사용이 중단되었다.[2]그것이 C-Fos를 자극한다는 증거가 있다.[3]
역사
신초펜은 1908년 '아토판'으로 처음 소개되어 통풍과 관절염 치료에 사용되었다.[4]요산의 축적을 줄이는 데 효과가 있어 인기 있는 약이 되었다.1911년과 1912년의 추가 연구는 신코펜의 대사물을 인간의 소변으로부터 격리시키는 데 성공했다.1920년대에 간 손상과 간경변과 같은 심각한 부작용의 사례가 임상적으로 관찰되었다; 황달의 첫 경우는 1923년에 기록되었고 첫 번째 치사율은 1925년에 발생했다.전체 환자의 약 절반은 독성 효과를 경험했고 1932년까지 신코펜이나 그 유도체를 활성 성분으로 함유한 32개의 약을 사용할 수 있었으며,[5] 약물 약리학을 결정하기 위한 실험을 실시했지만 약물 유발 간 손상의 메커니즘은 불분명했다.신코펜은 대부분의 나라에서 인간이 사용하기에는 너무 위험하다고 여겨졌지만 개 골관절염 치료제로 수의학에 응용하고 있다.
사용 가능한 양식
신코펜은 구강 형태로 또는 정맥주사로 액상 형태로 투여할 수 있다.[7]
독성 및 부작용
신코펜 독성은 투여 후 6시간에서 12시간 후에 나타날 수 있다.증상으로는 과호흡, 온열(열), 위장병, 설사, 설사, 벌집, 구토, 망상, 간염,[8] 황달, 거식증, 경련, 혼수, 사망 등이 있을 수 있다.[7]심장과 신장의 지방 퇴화, 간장의 황색 위축 외에 간세포의 괴사 등이 부검결과에 기록돼 있다.
치료
신코펜 행정은 증상이 나타나면 즉각 중단해야 한다.급성 신코펜 중독에 대한 치료법은 없지만 조기 진단과 증상 치료가 효과적일 수 있다.젖산칼슘은 벌집을 치료하는데 사용될 수 있고 구강이나 정맥 포도당은 위장 증상을 완화시킬 수 있다.포도당이 투여되면 간을 더 이상의 손상으로부터 보호하기 위해 인슐린이 필요할 수 있다.경구 알칼리 치료는 산성화와 싸울 수 있으며, 메스꺼움과 구토를 관리하기 위해 항이산화제가 필요할 수 있다.[8]
수의학
신코펜은 개의 골관절염 치료에 사용되는 약물인 프레드노루코트로핀(PLT)의 주요 활성 성분이다.[10]PLT는 더 높은 용량에서 진통 및 항피레틱 효과를 발생시킬 수 있다.PLT로 처리된 골관절 개들은 관절 이동성, 강직성, 적층도 및 체중 지지 능력의 현저한 향상을 보였다.[11]정확히 투여했을 때 PLT는 페닐부타존과 유사한 임상 효능을 보였다.개에 대한 PLT 독성의 영향은 인간의 신코펜 독성과 유사하며 간독성, 위궤양 등이 포함된다.
참조
- ^ Ahluwalia VK (2005). Intermediates for Organic Synthesis. I. K. International. p. 262. ISBN 978-81-88-237-33-3.
- ^ Cutrín Prieto C, Nieto Pol E, Batalla Eiras A, Casal Iglesias L, Pérez Becerra E, Lorenzo Zúñiga V (June 1991). "[Toxic hepatitis from cinchophen: report of 3 cases]". Medicina Clinica (in Spanish). 97 (3): 104–6. PMID 1679861.
- ^ Takayama K, Xiong Y, Miura M (May 1994). "Neuronal expression of Fos protein in the paraventricular nucleus of the hypothalamus after i.p. injection of ulcergenic cinchophen". Neuroscience Letters. 172 (1–2): 55–8. doi:10.1016/0304-3940(94)90661-0. PMID 7916144. S2CID 22824054.
- ^ Lutwak-Mann C (December 1942). "The effect of salicylate and cinchophen on enzymes and metabolic processes". The Biochemical Journal. 36 (10–12): 706–28. doi:10.1042/bj0360706. PMC 1266862. PMID 16747500.
- ^ Palmer, Walter Lincoln; Woodall, Paul S. (1936-09-05). "Cinchophen—Is There a Safe Method of Administration?". Journal of the American Medical Association. 107 (10): 760–764. doi:10.1001/jama.1936.02770360006003. ISSN 0002-9955.
- ^ Reichle HS (1932-02-01). "Cinchophen Poisoning: An Attempt to Produce Toxic Cirrhosis of the Liver in Rats". Archives of Internal Medicine. 49 (2): 215–220. doi:10.1001/archinte.1932.00150090045005. ISSN 0730-188X.
- ^ a b Stevens, Serita (2007). Book of poisons : a guide for writers. Bannon, Anne. Cincinnati, Ohio: Writer's Digest Books. ISBN 9781599634401. OCLC 756774729.
- ^ a b Winfield GA (February 1932). "TOXIC HEPATITIS DUE TO CINCHOPHEN: A REPORT OF THREE CASES". Canadian Medical Association Journal. 26 (2): 170–4. PMC 402197. PMID 20318604.
- ^ Parsons L, Harding WG (July 1932). "Cinchophen Administration – Jaundice as an Untoward Effect: Report of Cases". California and Western Medicine. 37 (1): 30–3. PMC 1658375. PMID 18742180.
- ^ Murrell, Jo (2014). "Chronic pain: what are the options when NSAID treatment is inadequate?". Companion Animal. 19 (4): 212–217. doi:10.12968/coan.2014.19.4.212. ISSN 2053-0889.
- ^ McKellar, Q. A.; Pearson, T.; Galbraith, E. A.; Boyle, J.; Bell, G. (1991). "Pharmacokinetics and clinical efficacy of a cinchophen and prednisolone combination in the dog". Journal of Small Animal Practice. 32 (2): 53–58. doi:10.1111/j.1748-5827.1991.tb00913.x. ISSN 0022-4510.


