붕소 이온
Boranylium ions화학에서 붕소 이온은 화학식이+
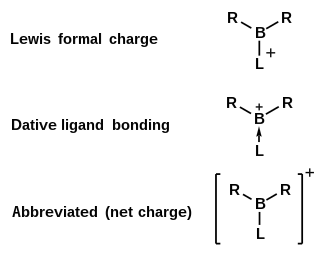
2 BR인 무기 양이온이며, 여기서 R은 비특이 치환기를 나타낸다.붕소 이온은 전자 결핍이기 때문에 루이스 염기와 부가물을 형성합니다.보라늄 이온은 배위 배위자의 [1]수에 따라 다음과 같은 역사적 이름을 가지고 있습니다.
- [BR
2]+
: 붕소 - [BRL
2]+
: 보레늄 - [BRL
2
2]+
: 보로늄
보레늄 이온
보레늄 이온은 화학식이 [BRL
2]+
인 무기 양이온이다.이러한 종류의 분자에서 전자결핍 붕소 중심은 2개의 리간드와 시그마 결합에 관여하는 2개의 원자가 전자를 가지며, 3번째 리간드는 복합체의 전체 전하가 +[1]1인 2개의 전자공여체이다.중심 붕소 주변의 리간드의 성질에 따라, 이 양전하는 붕소 중심에서 국부화되거나 분자 [3]전체에 걸쳐 국부화 될 수 있습니다.보레늄 이온은 다양한 방법으로 생성될 수 있으며 유기 합성 및 촉매 [2]작용에 응용될 때 관심이 있습니다.
합성
할로겐화물 추상화, 친핵성 해리 및 아미노보란에 대한 프로틴 첨가를 포함한 보렌 이온을 조제하는 합성방법.
할로겐화물 또는 수소화물 추상화
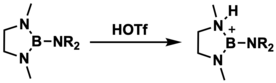
보레늄 이온은 할로겐화붕소의 테트라코어급 루이스산염기 부가물로부터 만들어질 수 있다.이 방법에서는 AlCl3 등의 루이스산에 의한 할로겐화물 추상화에 의해 보레늄 양이온과 AlCl4− 음이온이 [1][5]발생한다.1970년 Ryschkewitsch와 Wiggins가 이 [4]방법을 사용하여 최초로 분리 및 특성화 된 보레늄 이온을 만들었습니다.그들은 염화알루미늄이 4-메틸피리딘과 BCl의3 부가물 존재 하에서 디클로로메탄에 용해된다는 것을 발견했다.그 후, 붕소에 대한 양전하가 양성자 NMR 분광법에서 추론되었다.
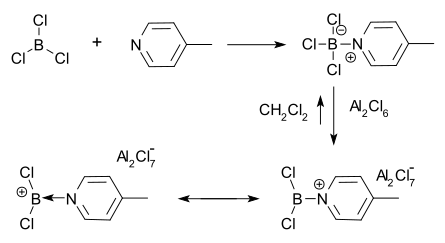
할로겐화물 추출법과 마찬가지로 4상 붕소 [6]착화체로부터 수소화물을 추출함으로써 보레늄 이온을 만들 수 있다.
친핵성 해리

피리딘 등의 중성 공여자에 의한 중성 삼등 할로겐화붕소로부터의 배위자의 치환으로 인해 보레늄 양이온이 [1]발생한다.이 반응이 원하는 보레늄 양이온을 생성하기 위해서는 리간드가 좋은 이탈기여야 하며, 경쟁 [7]실험에서 입증되었듯이 중성 BR3 시작 물질과의 루이스 산염기 부가물 형성보다 중성 공여체가 유리할 만큼 충분히 입체적 부피가 있어야 한다.
아미노보란에 대한 프로틱 첨가
아미노보란은 다양한 산에 의해 양성자화되어 보레늄 이온을 만들 수 있다.이 합성 방법은 1983년 트립산을 사용하여 1,3-디메틸-2-(디메틸아미노)-1,3,2-디아자보리딘을 양성자로 만든 나룰라와 노트에 의해 개발되었지만, 그들은 이 특정 양이온을 [7]결정화 및 구조적으로 특징 지을 수 없었다.
비루이스 산성 옥사자볼리딘의 양성자화는 에난티오선택성 디엘-알데르 촉매로 사용될 수 있는 보레늄 이온을 생성한다.이러한 N-양성자 보레늄 종은 [8]NMR에 의해 특징지어져 왔다.
기타 방법
보레늄 이온은 디코올리드 보리늄 이온에 염기를 첨가하거나 Ag[Al[OC(CF3)]34 또는 Li[Al[OC(CF3)]34[1][9]와 같이 음이온이 약하게 배위하는 소금과 메타세스를 통해 생성될 수도 있다.
구조 및 전자기기
많은 보레늄 이온이 X선 결정학을 통해 구조적으로 특징지어졌습니다.보레늄 이온의 구조는 일반적으로 두 개의 짧은 결합과 하나의 긴 결합을 가지고 있는데, 이는 날짜 결합의 특징입니다.많은 보레늄 이온의 붕소 중심부의 전자 결핍 특성은 계산 및 실험 연구를 통해 확인되었습니다.많은 보레늄 이온에 대한 자연 인구 분석 처리 결과 붕소 중심은 실제로 상당한 양의 전하를 가지고 있는 것으로 나타났습니다.예를 들어, BHNH23+ 양이온은 [10]붕소에서 +0.687의 자연 전하를 가집니다.
| 보레늄 이온 | B의 자연 전하 | B2p 오비탈 점유율 |
|---|---|---|
| BH2NH3+ | +0.687 | 0.023 |
| BCLNH23+ | +0.566 | 0.460 |
| B(CH3)2NH3+ | +1.087 | 0.167 |
| BF2NH3+ | +1.412 | 0.289 |
중심 붕소 주변의 리간드의 성질에 따라, 이 양전하는 붕소 중심에서 국부화되거나 분자 전체에 걸쳐 국부화 될 수 있습니다.경우에 따라서는 붕소의 빈 p 오비탈 평면에 배치된 파이 기증 리간드가 붕소의 전자 결핍을 안정시키는 작용을 할 수 있다.분리 가능한 보레늄 이온의 밀도 함수 이론(DFT) 계산 결과 루이스 산성 붕소는 피리딘과 [6]같은 방향족 치환기로부터의 파이 기증에 의해 안정화될 수 있습니다.
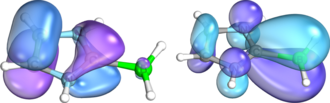
N-헤테로사이클릭 카르벤(NHCs)은 중성 [12]N-공여체보다 약한 파이 공여체로 작용하지만 pi-공합을 통해 보레늄 이온을 안정시키는 데도 사용될 수 있다.BH 단편과2+ 다양한 NHC 사이의 상호작용 에너지는 화학적 원자가(NOCV) 이론과 결합된 에너지 분해 분석을 위한 확장된 전이 상태 방법을 사용하여 계산되었다.이 분석 결과 NHC 리간드의 순파이 기증 효과가 나타났다. 이 경우, 양전하가 [11]붕소에 국소화되지 않고 전체 파이 시스템에 걸쳐 국소화된다.
다른 경우 스테릭 크라우딩으로 인해 날짜 배위자가 BR3 평면에서 비틀려 나오는 것이 관찰되었습니다.이러한 비평면 형상은 붕소 중심으로의 파이 기부를 감소시켜 붕소 중심은 더욱 전자적으로 [1]결핍됩니다.붕소에 대한 전하 국산화 증가는 붕소의 루이스 산도를 증가시키는 것으로 밝혀졌다.구트만-베켓 방법은 이러한 [12]양이온의 루이스 산성도를 벤치마킹하기 위해 이 분야의 많은 연구자들에 의해 사용되어 왔다.
보레늄 양이온의 초기 결정 구조는 대응하는 음이온이 [7]비배위임을 나타냅니다.추가 연구 결과 붕소의 반응성은 반대 이온의 정체성과 매우 관련이 있는 것으로 나타났습니다.촉매 적용에서는 음이온이 약하게 조정되어 가장 활성적인 보레늄 촉매가 가능해졌습니다.보레늄 양이온에 일반적으로 사용되는 대항 이온은 테트라키스(펜타플루오로페닐) 붕산염, B(CF65)4−이지만 AlCl4−, 할로겐화물, 트리플레이트 등의 다른 대항 이온도 가능하다.[1][12]보레늄 이온의 합성 생존가능성은 종종 그것의 대항체에 대한 반응성에 의해 결정된다.할로겐화물은 종종 보레늄 이온을 안정시킬 수 없고, 대신 붕소 중심에 맞춰 4상위 종족을 만드는 것을 선호한다.NHC-디콜로보렌늄 이온의 합성가능성에 대한 대항효과에 대한 체계적인 평가는 2013년 [13]무타야와 동료들에 의해 수행되었다.
반응성 및 응용 프로그램
보레늄 이온은 루이스 산성이 강하다.그들의 루이스 산도는 붕소 원자의 리간드의 전자적이고 입체적인 효과에 의해 결정된다.
수소활성화 및 FLP화학
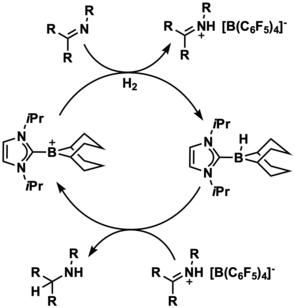
N-헤테로사이클릭카르벤(NHC) 안정화 보레늄 이온은 금속이2 없는 H활성화 및 수소화 촉매인 것으로 증명되었다.이러한 유형의 좌절된 루이스 쌍(FLP) 화학에서 전형적으로 사용되는 중성 붕소와 달리, 보레늄 이온은 본질적으로 친전자성이며 이러한 소분자 활성화를 수행하기 위해 전자 인출 리간드를 필요로 하지 않습니다.수소화 촉매 작용 중에 전자 인출 치환기가 수소화 전달을 방해할 수 있기 때문에, 보레늄 이온은 효과적인 수소화 공여체이기 때문에 중성 붕소 종보다 더 강력한 촉매가 될 수 있습니다.실제로 2012년 Stephan과 동료들은 포스핀이 [14]존재하는 상태에서 화학적으로 H를 활성화시킬2 수 있는 보레늄 기반 FLP 시스템을 개발할 수 있었다.
2015년 Devillard 외 연구진은 Mgiamil 배위자의 수소 분해와 함께 H를 활성화2 할 수 있는 나프틸 가교 분자 내 보레늄 함유 FLP를 합성했다.H 활성화와 관련된2 이 반응에서 중간체의 자연 결합 궤도(NBO)의 2차 섭동이론 분석은 H의2 시그마 결합과 양이온 붕소의 [15]2p 궤도 사이의 281.8 kcal/mol 상호작용을 보여주었다.
보레늄 이온은 또한 다양한 수소화에 촉매적으로 사용되어 왔다.Stephan과 동료들은 보레늄 이온 촉매를 사용하여 촉매적으로 H를 활성화시켜2 이민 수소화에 [14]사용할 수 있었다.유사한 NHC 안정화 보레늄 이온이 케티민의 에난티오선택적 환원 촉매를 위해 사용되었다.이 예에서 에난티오선택성은 [16]키랄 NHC 배위자의 사용을 통해 제공되었다.
이러한 보레늄 촉매에 사용되는 NHC 리간드의 입체적 및 전자적 특성은 촉매 활성에 매우 중요한 것으로 나타났다. 즉, 부피가 너무 큰 NHC는 분자간 하이드라이드 전달을 방지하고 전자성이 높은 리간드는 보레늄 양이온의 루이스산 [12]역할을 하는 능력을 약화시켰다.
에난티오 선택적 촉매 작용
보레늄 이온은 많은 유기 변형을 위한 무금속 에난티오 선택적 촉매로 사용되어 왔다.그 초기 예는 Corey-Itsuno 감소이다.이러한 항안티오선택적 감소를 위한 하나의 제안된 메커니즘은 BH를 루이스산으로 [17]사용하는3 보레늄 유사 종의 현장 생성을 포함한다.
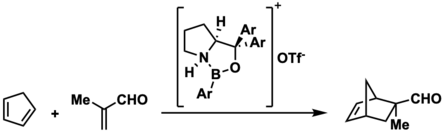
중성 옥사자보롤리딘에서 생성된 보레늄 이온에 대한 추가 연구는 그들의 적용 범위를 넓혔다.2002년 E. J. Corey와 동료들은 비루이스 산성 옥사자보롤리딘의 N-양성자가 보레늄 이온을 발생시켜 1,3-디엔의 반선택적 디엘-알데르 반응을 2-메타클린 또는 2-브라모롤과 촉매할 수 있다고 보고하였다.이 특정 보레늄 이온은 중성 옥사자보리딘을 트리플산으로 양성화함으로써 제 자리에서 만들어질 수 있다.Corey와 동료들은 이 반응의 입체선택성이 입체선택성을 [8]지배하는 전이 전 상태에서 알데히드-촉매 결합의 결과라고 주장한다.2017년 [18]Matuszek 등에 의해 Diels-Alder 촉매로서의 보레늄 이온의 사용은 Diels-Alder 반응을 위한 촉매로서의 보레늄 이온 액체의 사용으로 더욱 확대되었다.
친전자성 방향족 보릴화
보레늄 이온은 또한 친전자성 방향족 보릴화 [2]반응의 중간체로 관여되어 왔다.이 반응의 많은 예에서 촉매는 보란을 활성화하기 위해 사용되며, 고반응성 보레늄 이온을 생성한다.이 높은 친전자성 종의 형성은 친전자성 방향족 첨가 메커니즘의 핵심 단계인 윌랜드 중간체의 형성을 촉진한다.w 2013년 Stahl et al.루테늄을 사용했다.(II)질소함유 헤테로사이클의 [19]직접 보릴화를 일으킬 수 있는 보레늄 이온을 생성하기 위한 티올레이트 촉매.
2017년, Oestreich와 동료들은 이러한 변화를 위한 무금속 방법을 개발했습니다.이들의 연구에서 B(CH)3는65 카테콜보란을 활성화하기 위해 사용되어 다양한 전자 다량 복소환을 [20]보릴화할 수 있는 보레늄 이온을 생성했다.
하이드로보레이션
보레늄 이온의 친전성은 알킨의 수소화를 촉진할 수 있다.2016년 McGough 등은 보레늄 이온 일렉트로파일과 B(CF65)3를 [21]촉매로 사용하여 다양한 아릴아세틸렌 기질로 무금속 트랜스 하이드로보레이션을 성공적으로 달성할 수 있었다.

중합 촉매 작용
보레늄 이온은 폴리알파올레핀(PAO)의 중합을 촉매할 수 있는 이온성 액체를 형성하는 것으로 나타났다.이 기술은 아직 업계에서 널리 채택되지는 않았지만 PAO의 [22]산업적 합성에서 독성 및 부식성 가스인 BF를3 사용할 수 있는 대안을 제공할 수 있다.
보리니움 양이온
붕소 이온의 공식은 [BX]+[23]입니다2.여기서− X는 보통 부피가 큰 아미드(RN2−)입니다.그들은 붕소에서 선형 기하학을 가지고 있고, 좌표적으로 불포화이다.
보로늄 양이온
보로늄 이온은 [LBR]+ (L22 = Lewis 염기)라는 식이다.붕소 이온은 사면체이며 배위적으로 포화된다.
잘 알려진 예는 [(HN3)2BH]2+입니다.디보란과 암모니아는 주로 [HB2(NH3)](2+BH)4−[24][25]를 생성한다.
관련 붕소 양이온
다른 비고전 붕소 양이온은 [26]단핵 붕소 이온과 삼중 양이온으로 각각 공식은 [LBX3],2+ [LB4]3+이다.
보고된 다른 붕소 양이온에는 디보라 양이온(bis(borenium) dictions)이 있으며,[27][28] 몇 가지 예는 다음과 같다.
레퍼런스
- ^ a b c d e f g h Koelle, P.; Noeth, H. (1985-10-01). "The chemistry of borinium and borenium ions". Chemical Reviews. 85 (5): 399–418. doi:10.1021/cr00069a004. ISSN 0009-2665.
- ^ a b c De Vries, Timothy S.; Prokofjevs, Aleksandrs; Vedejs, Edwin (2012-07-11). "Cationic Tricoordinate Boron Intermediates: Borenium Chemistry from the Organic Perspective". Chemical Reviews. 112 (7): 4246–4282. doi:10.1021/cr200133c. ISSN 0009-2665. PMC 3394883. PMID 22519545.
- ^ Lee, Kyounghoon; Kirkvold, Clara; Vlaisavljevich, Bess; Daly, Scott R. (2018-11-05). "Ligand-Centered Borenium Reactivity in Triaminoborane-Bridged Diphosphine Complexes". Inorganic Chemistry. 57 (21): 13188–13200. doi:10.1021/acs.inorgchem.8b01601. ISSN 0020-1669. PMID 30351072. S2CID 53036749.
- ^ a b c Ryschkewitsch, George E.; Wiggins, J. W. (1970-03-01). "Trigonal boron cation". Journal of the American Chemical Society. 92 (6): 1790–1791. doi:10.1021/ja00709a079. ISSN 0002-7863.
- ^ Clark, Ewan R.; Ingleson, Michael J. (2013-11-25). "[(acridine)BCl2]+: A Borenium Cation That Is a Strong Boron- and Carbon-Based Lewis Acid". Organometallics. 32 (22): 6712–6717. doi:10.1021/om400463r. ISSN 0276-7333.
- ^ a b Bentivegna, BriAnne; Mariani, Christine I.; Smith, Jason R.; Ma, Shuhua; Rheingold, Arnold L.; Brunker, Tim J. (2014-06-09). "Formation, Stability, and Structures of Borenium and Boronium Cations Derived from Pentamethylazaferrocene–Boranes by Hydride or Chloride Abstraction Reactions". Organometallics. 33 (11): 2820–2830. doi:10.1021/om500348u. ISSN 0276-7333.
- ^ a b c Narula, Chaitanya (1984). "Preparation and Characterization of Salts Containing Cations of Tricoordinate Boron". Inorganic Chemistry. 23 (25): 4147–4152. doi:10.1021/ic00193a009.
- ^ a b c Corey, E. J.; Shibata, Takanori; Lee, Thomas W. (2002-04-01). "Asymmetric Diels−Alder Reactions Catalyzed by a Triflic Acid Activated Chiral Oxazaborolidine". Journal of the American Chemical Society. 124 (15): 3808–3809. doi:10.1021/ja025848x. ISSN 0002-7863. PMID 11942799.
- ^ Chen, Jiawei; Lalancette, Roger A.; Jäkle, Frieder (2013-05-02). "Synthesis and Lewis acid properties of a ferrocene-based planar-chiral borenium cation". Chemical Communications. 49 (43): 4893–4895. doi:10.1039/C3CC41556B. ISSN 1364-548X. PMID 23571677.
- ^ a b Stojanović, Milovan; Baranac-Stojanović, Marija (2015-09-08). "A theoretical study on borenium ion affinities toward ammonia, formaldehyde and chloride anions". RSC Advances. 5 (93): 75895–75910. Bibcode:2015RSCAd...575895S. doi:10.1039/C5RA13825F. ISSN 2046-2069.
- ^ a b Rezabal, Elixabete; Frison, Gilles (2015). "Estimating π binding energy of N-Heterocyclic carbenes: The role of polarization" (PDF). Journal of Computational Chemistry. 36 (8): 564–572. doi:10.1002/jcc.23852. ISSN 1096-987X. PMID 25708019. S2CID 22398660.
- ^ a b c d Eisenberger, P.; Crudden, C. M. (2017-04-10). "Borocation catalysis". Dalton Transactions. 46 (15): 4874–4887. doi:10.1039/C6DT04232E. ISSN 1477-9234. PMID 28294211.
- ^ Muthaiah, Senthilkumar; Do, Dinh Cao Huan; Ganguly, Rakesh; Vidović, Dragoslav (2013-11-25). "Counterion Dependence on the Synthetic Viability of NHC-stabilized Dichloroborenium Cations". Organometallics. 32 (22): 6718–6724. doi:10.1021/om400541q. hdl:10356/98250. ISSN 0276-7333.
- ^ a b c Farrell, Jeffrey M.; Hatnean, Jillian A.; Stephan, Douglas W. (2012-09-13). "Activation of Hydrogen and Hydrogenation Catalysis by a Borenium Cation". Journal of the American Chemical Society. 134 (38): 15728–15731. doi:10.1021/ja307995f. ISSN 0002-7863. PMID 22931196.
- ^ Devillard, Marc; Brousses, Rémy; Miqueu, Karinne; Bouhadir, Ghenwa; Bourissou, Didier (2015-05-04). "A Stable but Highly Reactive Phosphine‐Coordinated Borenium: Metal‐free Dihydrogen Activation and Alkyne 1,2‐Carboboration". Angewandte Chemie International Edition. 54 (19): 5722–5726. doi:10.1002/anie.201500959. ISSN 1521-3773. PMID 25800957.
- ^ Mercea, Dan M.; Howlett, Michael G.; Piascik, Adam D.; Scott, Daniel J.; Steven, Alan; Ashley, Andrew E.; Fuchter, Matthew J. (2019-06-13). "Enantioselective reduction of N-alkyl ketimines with frustrated Lewis pair catalysis using chiral borenium ions". Chemical Communications. 55 (49): 7077–7080. doi:10.1039/C9CC02900A. hdl:10044/1/70396. ISSN 1364-548X. PMID 31149679. S2CID 206141629.
- ^ Corey, E. J.; Bakshi, Raman K.; Shibata, Saizo (1987-09-01). "Highly enantioselective borane reduction of ketones catalyzed by chiral oxazaborolidines. Mechanism and synthetic implications". Journal of the American Chemical Society. 109 (18): 5551–5553. doi:10.1021/ja00252a056. ISSN 0002-7863.
- ^ Matuszek, K.; Coffie, S.; Chrobok, A.; Swadźba-Kwaśny, M. (2017-03-06). "Borenium ionic liquids as catalysts for Diels–Alder reaction: tuneable Lewis superacids for catalytic applications". Catalysis Science & Technology. 7 (5): 1045–1049. doi:10.1039/C7CY00106A. ISSN 2044-4761.
- ^ Stahl, Timo; Müther, Kristine; Ohki, Yasuhiro; Tatsumi, Kazuyuki; Oestreich, Martin (2013-07-31). "Catalytic Generation of Borenium Ions by Cooperative B–H Bond Activation: The Elusive Direct Electrophilic Borylation of Nitrogen Heterocycles with Pinacolborane". Journal of the American Chemical Society. 135 (30): 10978–10981. doi:10.1021/ja405925w. ISSN 0002-7863. PMID 23855894.
- ^ Yin, Qin; Klare, Hendrik F. T.; Oestreich, Martin (2017). "Catalytic Friedel–Crafts C−H Borylation of Electron-Rich Arenes: Dramatic Rate Acceleration by Added Alkenes". Angewandte Chemie International Edition. 56 (13): 3712–3717. doi:10.1002/anie.201611536. ISSN 1521-3773. PMID 28244623.
- ^ a b McGough, John S.; Butler, Samuel M.; Cade, Ian A.; Ingleson, Michael J. (2016-04-26). "Highly selective catalytic trans-hydroboration of alkynes mediated by borenium cations and B(C6F5)3". Chemical Science. 7 (5): 3384–3389. doi:10.1039/C5SC04798F. ISSN 2041-6539. PMC 6006955. PMID 29997833.
- ^ Hogg, James M.; Ferrer-Ugalde, Albert; Coleman, Fergal; Swadźba-Kwaśny, Małgorzata (2019-08-08). "Borenium Ionic Liquids as Alternative to BF3 in Polyalphaolefins (PAOs) Synthesis" (PDF). ACS Sustainable Chemistry & Engineering. 7 (17): 15044–15052. doi:10.1021/acssuschemeng.9b03621. ISSN 2168-0485. S2CID 202069606.
- ^ Shoji, Yoshiaki; Tanaka, Naoki; Mikami, Koichiro; Uchiyama, Masanobu; Fukushima, Takanori (2014-05-11). "A two-coordinate boron cation featuring C–B+–C bonding". Nature Chemistry. 6 (6): 498–503. Bibcode:2014NatCh...6..498S. doi:10.1038/nchem.1948. ISSN 1755-4330. PMID 24848235.
- ^ De Vries, Timothy S.; Prokofjevs, Aleksandrs; Vedejs, Edwin (2012-04-20). "Cationic Tricoordinate Boron Intermediates: Borenium Chemistry from the Organic Perspective". Chemical Reviews. 112 (7): 4246–4282. doi:10.1021/cr200133c. ISSN 0009-2665. PMC 3394883. PMID 22519545.
- ^ Piers, Warren E.; Bourke, Sara C.; Conroy, Korey D. (2005). "Borinium, Borenium, and Boronium Ions: Synthesis, Reactivity, and Applications". Angewandte Chemie International Edition. 44 (32): 5016–5036. doi:10.1002/anie.200500402. PMID 16086441.
- ^ Vargas-Baca, Ignacio; Findlater, Michael; Powell, Adam; Vasudevan, Kalyan V.; Cowley, Alan H. (2008). "Boron di- and tri-cations". Dalton Transactions (45): 6421–6. doi:10.1039/b810575h. ISSN 1477-9226. PMID 19002329.
- ^ Prokofjevs, Aleksandrs; Kampf, Jeff W.; Solovyev, Andrey; Curran, Dennis P.; Vedejs, Edwin (2013-10-10). "Weakly Stabilized Primary Borenium Cations and Their Dicationic Dimers". Journal of the American Chemical Society. 135 (42): 15686–15689. doi:10.1021/ja407458k. ISSN 0002-7863. PMC 3857331. PMID 24087933.
- ^ Arnold, Nicole; Braunschweig, Holger; Dewhurst, Rian D.; Hupp, Florian; Radacki, Krzysztof; Trumpp, Alexandra (2016-08-12). "Desymmetrizing Electron-Deficient Diboranes(4): Diverse Products and Their Reactivity". Chemistry - A European Journal. 22 (39): 13927–13934. doi:10.1002/chem.201602805. ISSN 0947-6539. PMID 27514500.