카르보레인산
Carborane acid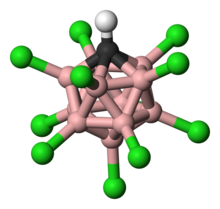 | |
| 식별자 | |
|---|---|
3D 모델(JSmol) | |
| |
| |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
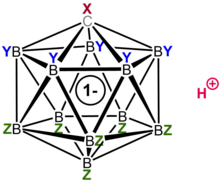
superacids,[1]에 따라 일부 적어도 백만배 100%순수한 황산보다 그들의Hammett 산도 함수 값과 토지 –20을 훨씬 밑돌고 계산된 pKa 값, 몇몇의 가장 강한 알려진로 설립(귀무가설 ≤ –18)의 관점에서 더 강해질 것으로 추정된다 Carborane 산 H(CXB11Y5Z6)(X, Y, Z=H, Alk, F, 당분이나 지방 말고도, Br, 세) 있는 클래스입니다.Brønsted 산. 가장 잘 연구된 예는 고도로 염소 처리된 파생상품 H(CHBCl
11
11)이다.[2][3][4] H(CHBCl
11
11)의 산도는 이전에 가장 강력한 분리 가능한 산으로 간주되었던 화합물인 소산, CFSOH
3
3, 비스트리플리미드(CFSO
3
2)
2NH를 훨씬 초과하는 것으로 밝혀졌다.
그들의 높은 산도는 Cl, F, CF와3 같은 전기 그룹에 의해 대개 더 안정화된 그들의 결합 기반인 카르보란산염1156– 음이온의 광범위한 소산화에서 기인한다. 산화 성질이 부족하고 특이하게 낮은 핵소독성과 이들의 결합 베이스의 높은 안정성으로 인해 C 풀레네를 분해하지60 않고 양성하는 것으로 알려진 유일한 초산성이다.[5][6] 또한 그들은 전기영양 방향족 대체 반응에서 마주치는 윌랜드 중간체의 모화합물인 양성 벤젠, CH와67+ 함께 안정적이고 격리 가능한 염분을 형성한다.
불소화 카르보레인산 H(CHBF
11
11)는 염소화 카르보레인산보다 더 강하다. 부탄을 양성하여 상온에서 테르트부틸 양이온을 형성할 수 있으며, 이산화 탄소를 양성하여 브리지드 양이온 [H(CO
2)]
2+
을 부여한 유일한 산으로 알려져 있어 가장 강력한 알려진 산일 가능성이 있다. 특히 CO는2 혼합초산물 HF-SbF5 또는 HSOF-SBF로35 처리했을 때 관찰 가능한 양성자를 거치지 않는다.[7][8][9][10]
한 종류로 카르보레인산은 잘 정의되고 격리될 수 있는 물질로 알려진 가장 산성적인 그룹을 형성하는데, 이것은 이전에 알려진 작은 산이나 과염소산과 같은 단일 성분 강산보다 훨씬 더 산성이다. 특정한 경우, 위에서 언급한 거의 과할로겐화 유도체들과 마찬가지로, 그들의 산성도는 마법산과 플루오로안티몬산 같은 전통적인 혼합 루이스-브뢰네스트 슈퍼아키드의 산성과 경쟁(그리고 아마도 상쇄될 수 있다)한다. (단, 두 종류의 산 모두에 적합한 산성의 측정치가 없기 때문에 지금까지 정면 비교가 가능하지 않았다: pKa 값은 화학적으로 복잡한 혼합산에 대해 잘못 정의되어 있는 반면 H 값은0 매우 높은 용융 카르보레인산에 대해 측정할 수 없다.)
산도

11
11)는 기체 단계에서 단조로운 것으로 나타났으며, 산성 양성자(빨간색으로 표시)는 Cl(12)에 묶여 있고, 2차적으로 Cl(7)에 결합되어 있었다. 모노메릭 형태는 응축될 때 측정이 가능하지만, 결국 중합되어 카르보레인 단위들 사이에 산성 양성자 브리징이 있는 구조를 갖게 된다.[11] (N.B: 카르보레인 코어의 탄소 원자와 붕소 원자의 선은 연결성을 보여주지만 단일 결합으로 해석해서는 안 된다. 전자결핍으로 인해 채권주문이 1개 미만이다.)
브뢰네스트-로리산의 강도는 수소 이온을 방출하는 능력과 일치한다. 산 강도의 집중되어 있는,superacidic 액체 미디어를 하나의 공통된 크기는 해밋 산도 함수, H0.양적으로 양자를 가하다 벤젠에 대한 능력에 기초하여, 염소 처리한 카르보란 산성 H(CHB11Cl11)보수적으로 −18거나 아래에서 귀무가설 가치를 일반의 주장에carborane은 유명한 것으로 추산되었다 적어도 m100% 황산(H0 = -12)보다 강한 환각 시간.[12][13] 그러나 H0 값은 액체 매체의 양성 능력을 측정하므로, 이들 산의 결정성과 높은 녹는 성질은 이 매개변수의 직접 측정을 배제한다. pKa, 산성도 약간 다른 조치 지정된 용질의 능력을 용매에 이온화를 받는 것으로 정의한 측면에서,carborane 산 −20 아래치 pKa 꼭(예를 들어, H(CHB11H11)완전히 fl −24),[14]의(는 아직 알려지지 않)과 pKa 것으로 추정되는 붕소 원자에 substituents 전자 구인성 없이 추정된다.uorinated 계산된 pK가a -46인 아날로그 H(CBF)
11
12[4] 불소가 1개 적은 알려진 산 H(CHBF
11
11)는 약간 약할 것으로 예상된다(pKa < -40).
가스 단계에서 H(CHBF
11
11)는 H(CHBCl
11
11)에 대해 실험적으로 결정된 산도가 241kcal/mol(계산값 230kcal/mol)인 것에 비해 계산된 산도는 216kcal/mol이다. 이와는 대조적으로6 HSbF(플루오로안티몬산에 양성자를 기증하는 종에 대한 단순화된 모델)는 계산된 가스상 산도가 255kcal/mol인 반면, 이전에 실험적으로 결정된 기록 보유자는 비스프리플리미드 화합물인 (CFSO492)2NH 291kcal/mol이었다. 따라서 H(CHBF
11
11)는 기체 위상 산도 측면에서 지금까지 대량으로 합성된 가장 산성 물질일 가능성이 높다. 특유의 반응성으로 볼 때 응축 국면(위 참조)에서 가장 산성 물질이 될 수 있다는 강력한 경쟁자이기도 하다. 가스 위상 산도가 200 kcal/mol일 정도로 더욱 강력한 산성의 파생상품이 예측되었다.[15][16]
카르보레인산은 한 가지 성분 물질이 잘 정의되어 있다는 점에서 기존의 슈퍼아키드와 다르다. 이와는 대조적으로, 고전적인 슈퍼아키드는 브뢰네스트 산과 루이스 산(예: HF/SbF5)의 혼합물이다.[17] 붕소계 카르보레인산은 가장 강한 산임에도 불구하고 더 이상의 부작용 없이 약하게 기초 물질을 깨끗하게 양성하는 '젠틀'로 묘사된다.[18] 기존의 슈퍼아키드는 루이스 산성 성분이 강하게 산화되기 때문에 풀레네를 분해하는 반면 카르보레인산은 실온에서 풀레네를 양성하여 분리 가능한 소금을 산출하는 능력이 있다.[19][20] 더욱이 양성자 전달의 결과로 형성되는 음이온은 거의 완전히 불활성이다. 이 성질은 다양한 불소성분(그것이 유리를 공격한 종)이 존재하거나 생성되지 않기 때문에 유리병에도 저장할 수 있는 혼합 슈퍼아키드와 산도가 비교 가능한 유일한 물질을 카르보레인산으로 만드는 것이다.[21][19]
역사
카르보레인산은 2004년 캘리포니아 리버사이드 대학에서 크리스토퍼 리드 교수와 그의 동료들에 의해 처음 발견되고 합성되었다.[20] 카르보레인산이 발견되기 전, 두 초산인 플루오르황산과 트리플루오르메탄네술폰산이 각각 -14와 -16의 pK로a "단일 고립성 화합물로 가장 강한 산"이라는 오랜 기록을 보유하고 있었다.[22] 카르보레인산이 파생되는 모분자인 이코사이드 카르보란산 음이온 HCBH는
11−
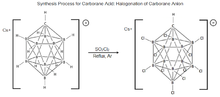
11 1967년 월터 노스에 의해 듀폰에서 처음 합성되었다. 이 분자의 성질에 대한 연구는 1980년대 중반 체코 붕소 과학자 그룹인 플레셰크, 슈티브르, 헤흐마넥이 카르보레인 분자의 할로겐화 과정을 개선하면서 중단되었다. 이러한 발견은 카르보레인산 합성을 위한 현재의 절차를 개발하는 데 중요한 역할을 했다.[19][22] 이 과정은 Cs+[HCBH1111]–를 SOCl로
2
2 처리하고 건조한 아르곤에서 역류하여 카르보레인산을 산출하는 분자를 완전히 염소화시키는 것으로 구성되지만, 이는 선택된 조건에서만 완전히 염소화되는 것으로 나타났다.[23][19][24]
2010년에 리드는 카르보레인산과 그 파생상품의 합성을 위한 상세한 절차를 제시하는 안내서를 발행했다.[25] 그럼에도 불구하고 카르보레인산의 합성은 장황하고 난해하며 잘 정비된 글러브 박스와 일부 전문 장비가 필요하다. 출발 물질은 독성이 강한 물질인 데카보레인(14)을 시판할 수 있다. 가장 잘 연구된 카르보레인산 H(CHBCl
11
11)가 13단계로 준비돼 있다. 마지막 몇 단계는 특히 민감하며, 벤젠이나 디클로로메탄처럼 약한 염기는 카르보레인 기반 전기영동체와 브뢰네스트 산과 반응하기 때문에 약한 기본 용제 증기가 없는 <1ppm HO의2 글로브 박스가 필요하다. 합성 마지막 단계는 휘발성 부산물에서 강력한 Si-Cl 및 H-H 결합의 형성에 의해 구동되는 과잉 액체, 무수 염화수소를 포함한 μ-수소칼륨 카르보란산염의 전치물이다.
- [EtSi3–H–Siet3][+HCB11Cl11]– + 2HCl →H(CHB
11Cl
11) + 2Et3SiCl + H2
- [EtSi3–H–Siet3][+HCB11Cl11]– + 2HCl →H(CHB
제품은 부산물의 증발에 의해 격리되었으며 적외선( ( = 3023CH cm−1)과 핵자기공명(액체 SO의2 Δ 4.55 (s, 1H, CH), 20.4 (s, 1H+, H) 스펙트럼(산성 양성자의 극저하 화학적 이동에 주목)이 특징이었다.[25] 합성에 사용되는 반응은 유사하지만, 보다 산성도가 높은 H(CHBF
11
11)의 순수한 샘플을 얻는 것은 훨씬 더 어려운 것으로 판명되어 약하게 기초적인 불순물의 흔적을 배제하기 위해서는 극히 엄격한 절차가 필요하다.[7]
구조
카르보레인산은 11개의 붕소 원자로 구성되어 있다; 각각의 붕소 원자는 염소 원자에 묶여 있다. 염소 원자는 산성도를 높이는 역할을 하며 성단 주위로 형성되는 강인한 방해물로 인해 외부로부터의 공격에 대한 방패 역할을 한다. 11개 붕소, 11개 클로린, 1개의 탄소 원자로 구성된 성단은 탄소 원자에 묶인 수소 원자와 쌍을 이룬다. 붕소 원자와 탄소 원자는 붕소의 3중 2 전자 결합을 형성하는 능력 때문에 6개의 결합을 형성할 수 있다.[22]
카르보레인산의 구조는 기존 산과 크게 다르지만 둘 다 전하와 안정성을 비슷한 방식으로 분배한다. 카르보란산 음이온은 12개의 케이지 원자 전체에 전자를 분산시켜 전하를 분산시킨다.[26] 이는 전자적 소산화를 암시하는 링의 헤테로사이클릭 부분에서 짧은 결합 길이를 밝혀내는 단일 결정 X선 회절 연구에서 밝혀졌다.[27]
염소 처리된 카르바-클로소-도-디케보제 음이온 HCBCl은
11−
11 이전에 "위헌적으로 불활성" B-Cl 정점이라고 설명했던 것과 함께 매우 안정적인 음이온이다.
설명자 클로징은 분자가 스토이치측정기의 붕소에서 (B-to-C+ 교체에 의해) 정식으로 파생되고 충전 [BHnn](2–알려진 카르보레인산의 경우 n = 12)임을 나타낸다.[28] 11개의 붕소 원자와 1개의 탄소 원자에 의해 형성된 케이지 같은 구조는 3D 케이지(카보레인 시스템의 특별한 안정화는 '탄소-자율성'이라고 불렸으며, 분자의 붕소 군집 부분을 교란하는 데 필요한 높은 에너지가 음이온에게 놀라운 찌르기를 부여한다.ty.[28] 음이온은 극히 안정적이기 때문에 안티몬 펜타플루오라이드와 같은 많은 초산성분의 루이스 산성 성분과는 달리, 산 자체는 완전히 산화되지 않은 상태에서 양성 기질을 향해 핵성분으로 작용하지 않을 것이다. 따라서 C와60 같은 민감한 분자는 분해 없이 양성될 수 있다.[29][30]
사용법
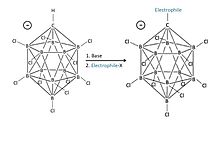
붕소 기반 카르보레인산에는 많은 제안이 있다. 예를 들어, 그것들은 탄화수소 균열과 n-alkanes의 이성질화를 위한 촉매로 제안되었다(예: 이소옥탄(isooxane)). 카르보레인산은 또한 정밀 화학 합성을 위해 강력하고 선택적인 브뢰네스트 산으로 사용될 수 있으며, 여기서 대항제의 낮은 핵소독성이 유리할 수 있다. 기계론적 유기 화학에서 그것들은 반응하는 양이온 매개체의 연구에 사용될 수 있다.[31] 무기체 합성에서는, 그들의 비할 데 없는 산성도가 양성자 제논의 소금과 같은 이국적인 종의 분리를 가능하게 할지도 모른다.[21][22][32]
참조
- ^ 산성의 양성자가 카보레인에 접합된 이미지가 아니라 반작용이라는 점에 유의하십시오.
- ^ Olah, G. A.; Prakash, G. K. S.; Sommer, J.; Molnar, A. (2009). Superacid Chemistry (2nd ed.). Wiley. p. 41. ISBN 978-0-471-59668-4.
- ^ 즉 액체라면 H의+ 활동으로 측정된 카보레인 초산염의 깔끔한 샘플의 양성 능력이 100% 황산보다 100만 배 이상 높을 것이다.
- ^ a b Lipping, Lauri; Leito, Ivo; Koppel, Ivar; Krossing, Ingo; Himmel, Daniel; Koppel, Ilmar A. (2015-01-14). "Superacidity of closo -Dodecaborate-Based Brønsted Acids: a DFT Study". The Journal of Physical Chemistry A. 119 (4): 735–743. Bibcode:2015JPCA..119..735L. doi:10.1021/jp506485x. PMID 25513897.
- ^ Juhasz, M.; Hoffmann, S.; Stoyanov, E.; Kim, K.-C.; Reed, C. A. (2004). "The Strongest Isolable Acid". Angewandte Chemie International Edition. 43 (40): 5352–5355. doi:10.1002/anie.200460005. PMID 15468064.
- ^ Reed, C. A. (2005). "Carborane acids. New "strong yet gentle" acids for organic and inorganic chemistry" (PDF). Chemical Communications. 2005 (13): 1669–1677. doi:10.1039/b415425h. PMID 15791295.
- ^ a b Nava Matthew (2013). "The Strongest Brønsted Acid: Protonation of Alkanes by H(CHB11F11) at Room Temperature". Angewandte Chemie International Edition. 53 (4): 1131–1134. doi:10.1002/anie.201308586. PMC 4993161. PMID 24339386.
- ^ Reed CA (2013). "Myths about the proton. The nature of H+ in condensed media". Acc. Chem. Res. 46 (11): 2567–75. doi:10.1021/ar400064q. PMC 3833890. PMID 23875729.
- ^ Reed CA (2013). "Myths about the proton. The nature of H+ in condensed media". Acc. Chem. Res. 46 (11): 2567–75. doi:10.1021/ar400064q. PMC 3833890. PMID 23875729.
- ^ Cummings, Steven; Hratchian, Hrant P.; Reed, Christopher A. (2016-01-22). "The Strongest Acid: Protonation of Carbon Dioxide". Angewandte Chemie International Edition. 55 (4): 1382–1386. doi:10.1002/anie.201509425. ISSN 1521-3773. PMID 26663640.
- ^ Stoyanov, Evgenii S.; Hoffmann, Stephan P.; Juhasz, Mark; Reed, Christopher A. (March 2006). "The Structure of the Strongest Brønsted Acid: The Carborane Acid H(CHB11Cl11)" (PDF). Journal of the American Chemical Society. 128 (10): 3160–3161. doi:10.1021/ja058581l. ISSN 0002-7863. PMID 16522093.
- ^ Reed, C. A. (October 2011). "The Strongest Acid". Chem. New Zealand. 75: 174–179. doi:10.1002/chin.201210266. S2CID 6226748.
- ^ Olah, G. A.; Prakash, G. K. S.Mommer, J.; Molnar, A. (2009) 초산 화학 (제2판) 와일리, 41페이지 ISBN 978-0-471-59668-4.
- ^ pKa 값은 1,2-디클로로에탄에 대해 용매로 계산되며, picric acid의 pK는a 편의를 위해 0으로 '앵커싱'한다. 피크릭산의 수성a pK는 0.4이므로, 이러한 계산된 값은 물에 있는 카보레인의 pK에a 대한 대략적인 추정치를 제공한다.
- ^ Meyer, Matthew M.; Wang, Xue-Bin; Reed, Christopher A.; Wang, Lai-Sheng; Kass, Steven R. (2009-12-23). "Investigating the weak to evaluate the strong: an experimental determination of the electron binding energy of carborane anions and the gas phase acidity of carborane acids". Journal of the American Chemical Society. 131 (50): 18050–18051. doi:10.1021/ja908964h. ISSN 1520-5126. PMID 19950932.
- ^ Lipping, Lauri; Leito, Ivo; Koppel, Ivar; Koppel, Ilmar A. (2009-11-19). "Gas-Phase Brønsted Superacidity of Some Derivatives of Monocarba-closo-Borates: a Computational Study". The Journal of Physical Chemistry A. 113 (46): 12972–12978. Bibcode:2009JPCA..11312972L. doi:10.1021/jp905449k. ISSN 1089-5639. PMID 19807147.
- ^ 리드, 크리스토퍼 "카보레인산. "유기화학과 이노그론 화학의 새로운 '강하지만 온화한' 산들." 선진화조항(2005년 2월) 2015년 2월 13일에 접속.
- ^ 리드, 크리스토퍼 A. "가장 강한 산성" 뉴질랜드 화학(2011년 10월) : 174-179. 2015년 2월 13일에 접속.
- ^ a b c d Juhasz M.; Hoffmann S.; Stoyanov E.; Kim K.-C.; Reed C. A. (2004). "The Strongest Isolable Acid". Angewandte Chemie International Edition. 43 (40): 5352–5355. doi:10.1002/anie.200460005. PMID 15468064.
- ^ a b Reed C. A. (2005). "Carborane acids. "New 'strong yet gentle' Acids For Organic and Inorganic Chemistry". Chemical Communications (Submitted manuscript). 2005 (13): 1669–1677. doi:10.1039/b415425h. PMID 15791295.
- ^ a b M. 호프킨(2004년 11월 1일). 세계에서 가장 강한 산이 만들어졌어. http://www.nature.com/news/2004/041115/full/news041115-5.html에서 2015년 3월 3일 검색
- ^ a b c d 사토 켄타로우 "세계 최강산" 유기화학 박물관. 2015년 2월 13일 접속
- ^ "Back matter". Chemical Communications. 46 (48): 9259. 2010-12-28. doi:10.1039/C0CC90142C. ISSN 1364-548X.
- ^ 구, W, 맥컬로치, 빌리 J, 레이벤스 피, 요셉, 올레그 V. (2010, 2월 1일) Chemical Communications, http://pubs.rsc.org/en/content/articlepdf/2010/cc/c001555e에서 2015년 3월 5일 회수
- ^ a b Reed, Christopher A. (2010-01-19). "H+, CH3+, and R3Si+Carborane Reagents: When Triflates Fail". Accounts of Chemical Research. 43 (1): 121–128. doi:10.1021/ar900159e. ISSN 0001-4842. PMC 2808449. PMID 19736934.
- ^ El-Hellani A.; Lavallo V. (2014). "Fusing N-Heterocyclic Carbenes with Carborane Anions". Angew. Chem. Int. Ed. 53 (17): 4489–4493. doi:10.1002/anie.201402445. PMID 24664969.
- ^ Allen L. Chan; Javier Fajardo, Jr.; James H. Wright, II; Matthew Asay; Vincent Lavallo (2013). "Observation of Room Temperature B–Cl Activation of the HCB11Cl11–Anion and Isolation of a Stable Anionic Carboranyl Phosphazide". Inorganic Chemistry. 52 (21): 12308–12310. doi:10.1021/ic402436w. PMID 24138749.
- ^ a b Reed Christopher A (1998). "Carboranes: A New Class of Weakly Coordinating Anions for Strong Electrophiles, Oxidants, and Superacids". Accounts of Chemical Research. 31 (3): 133–139. doi:10.1021/ar970230r.
- ^ Ramírez-Contreras Rodrigo (2012). "Convenient C-alkylation of the [HCB11Cl11]−carborane anion". Dalton Trans. 41 (26): 7842–7844. doi:10.1039/C2DT12431A. PMID 22705934.
- ^ 킨, 샘. 사라진 숟가락: 그리고 그 밖의 광기와 사랑 그리고 주기율표에서 나온 세계의 역사에 대한 진실된 이야기. 뉴욕: Back Bay Books, 2011. 인쇄하다
- ^ 러브킨 크리스. "강하지만 부드러우며, 산성 물질은 노출되지 않음" 리버사이드 캘리포니아 대학교. (2004년 11월). 2015년 2월 13일에 접속.
- ^ Stiles, D. (September 1, 2007). "Column: Bench monkey". Retrieved March 3, 2015.