폴리머의 광산화
Photo-oxidation of polymers폴리머 화학에서 광산화(가끔: 산화 광분해)는 빛과 산소의 결합 작용으로 인한 폴리머 표면의 열화다.[1] 그것은 플라스틱의 풍화작용에 있어서 가장 중요한 요인이다.[2] 광산화 작용으로 폴리머 체인이 파손(사슬 파열)되어 소재가 점점 깨지기 쉽다. 이것은 기계적 결함으로 이어지고, 발전된 단계에서 미세플라스틱의 형성으로 이어진다. 직물에서는 그 과정을 포토엔딩이라고 부른다.
이 과정을 가속화하고 억제하기 위한 기술이 개발되었다. 예를 들어, 문, 창틀, 거터 같은 플라스틱 건물 구성요소는 수십 년 동안 지속될 것으로 예상되며, 고급 UV 폴리머 안정제를 사용해야 한다. 반대로 1회용 플라스틱은 생분해성 첨가물로 처리하여 그 조각화를 가속화할 수 있다. 많은 색소와 염료는 비슷하게 UV 에너지를 흡수하는 능력 때문에 효과를 볼 수 있다.
취약한 중합체
광산화 민감성은 폴리머의 화학 구조에 따라 달라진다. 불소성 고분자, 폴리이미드, 실리콘, 특정 아크릴산 고분자 등 안정성이 뛰어난 재료도 있다. 그러나 전세계 중합체 생산은 플라스틱 쓰레기의 대부분을 차지하는 다양한 일반 플라스틱에 의해 지배되고 있다. 이 중 폴리에틸렌 테레프탈레이트(PET)는 자외선 저항성이 보통 수준이며 폴리스티렌, 폴리염화비닐(PVC), 폴리프로필렌(PP), 폴리에틸렌(PE)과 같은 폴리에틸렌(Polyololefin) 등이 모두 민감도가 높다.
광산화란 광분해성의 한 형태로 폴리머 체인에 활성산소가 형성되면서 시작되는데, 이는 연쇄반응에서 산소와 반응하기 시작한다. 많은 폴리머의 경우 일반 자가 산화 메커니즘은 기초 화학의 합리적인 근사치다. 이 과정은 자가 분석적이며, 점점 더 많은 수의 활성산소와 활성산소를 생성한다. 이러한 반응은 폴리머의 분자량(및 분자량 분포)에 변화를 가져오고, 그 결과 물질은 더욱 깨지기 쉽다. 일반적인 과정은 네 단계로 나눌 수 있다.
- 초기 자유 급진주의 생성 프로세스를 개시한다.
- 활성 종을 다른 종으로 변환 전파
- 둘 이상의 활성 종이 생성되면서 끝나는 체인 분기 단계. 수산화물의 광분해가 대표적이다.
- 예를 들어, 급격한 불균형에 의해 활성 종이 제거되는 종료 단계
광산화 작용은 열 저하와 같은 다른 과정과 동시에 발생할 수 있으며, 이들 각각은 다른 과정을 가속화할 수 있다.
폴리오레핀스
폴리에틸렌과 폴리프로필렌과 같은 폴리에틸렌은 광산화 작용에 취약하며, 전 세계적으로 생산된 경량 안정제의 약 70%가 보호에 사용되고 있다. 비록 폴리에틸렌과 폴리프로필렌은 전 세계 플라스틱 생산의 약 50%에 불과하지만 말이다.[1] 알리파 탄화수소는 파장이 ~250nm 이하인 고에너지 UV선만 흡착할 수 있지만, 지구의 대기와 오존층은 그러한 광선을 차단하고, 정상적인 최소 파장은 280-290nm이다.[3] 따라서 폴리머의 대부분은 광투과성이며 그 대신 제조 또는 가공 단계에서 유입되는 다양한 불순물이 존재하기 때문에 분해된다. 여기에는 촉매 잔류물과 같은 금속염뿐만 아니라 과산화수소, 카보닐 그룹도 포함된다.
이 모든 종들은 포토니시에이터 역할을 한다.[4] 유기 집단은 290nm 이상의 자외선을 흡수할 수 있으며, 이때 광분해를 통해 활성산소를 발생시킨다.[5] 금속 불순물은 광촉매제 역할을 하지만 그러한 반응은 복잡할 수 있다.[6][7][8] 폴리머-O2 충전환승 콤플렉스가 개입돼 있다는 제안도 나왔다.[9][10] 시작은 고분자 체인에 급진 탄화수소를 생성하며, 때로는 마크로라디칼(P•)이라고도 한다.
체인 개시
체인 전파
체인 분기
종료
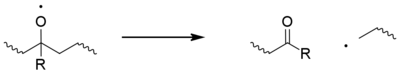
고전적으로 탄소 중심 매크로라디칼(P•)은 산소와 빠르게 반응하여 수산화물(POO•)을 형성하고, 이는 다시 폴리머 체인에서 H 원자를 추상화하여 수산화물(POOH)과 신선한 매크로라디칼을 준다. 수산화물은 쉽게 광분해를 거쳐 알코실 마크로라디칼 라디칼(PO•)과 히드록실 라디칼 라디칼(HO•)을 주는데, 이 두 가지 모두 수소 추상화를 통해 새로운 중합산소를 형성할 수 있다. 이러한 단계에 대한 비표준적인 대안이 제안되었다.[11] 알코실 라디칼도 베타 디시션을 겪을 수 있으며,[12] 아킬-케톤과 마크로라디칼을 생성한다. 이것이 폴리프로필렌의 체인 파손의 주요 원인으로 꼽힌다.[13]
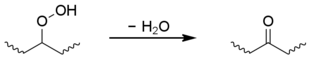
2차 수산화물도 분자 내 반응을 일으켜 케톤 그룹을 만들 수 있지만 폴리에틸렌에 국한된다.[1][14][15][16]
이러한 과정에서 발생하는 케톤은 훨씬 더 약하지만 그 자체로 광활성적이다. 주위 온도에서 그들은 체인 디시션에 대한 제2종 노르드리쉬 반응을 겪는다.[17] 그들은 또한 UV 에너지를 흡수할 수 있으며, UV 에너지를 O로2 전달하여 매우 반응성이 높은 트리플트 상태로 진입시킬 수 있다.[18] 트리플트 산소는 강력한 산화제로 더 많은 열화를 일으킬 수 있다.
폴리스티렌
폴리스티렌의 경우 광산화 메커니즘이 모두 동시에[19] 작동하고 입사광의 파장에 따라 다를 수 있기 때문에 여전히 논쟁의 여지가 있다.[20] 여하튼 주요 단계에는 합의가 돼 있다.[21]
순수 폴리스티렌은 파장이 ~280nm 이하인 빛을 흡수할 수 없어야 하며, 모두 정상 햇빛을 흡수할 수 있는 광-레이블 불순물(수소화합물)과 전하 전달 콤플렉스로 시작 설명을 하고 있다.[22][23] 산소와 폴리스티렌 페닐 그룹의 전하 전달 콤플렉스는 빛을 흡수해 싱클레트 산소를 형성해 급진적 이니시에이터 역할을 한다. [22] 중합체 내 카보닐 불순물(c.f. 아세토페논)도 자외선 범위(300~400nm)에 가까운 빛을 흡수해 중합체에서 수소 원자를 직접 추출할 수 있는 흥분 케톤을 형성한다.[23] 히로페라산화물은 광분해를 거쳐 히드록실 및 알록실산소를 형성한다.
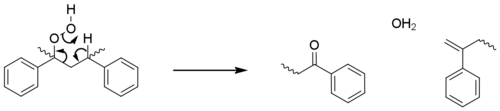
이러한 시작 단계는 3차 현장에서 마크로마디칼을 생성하는데, 이는 보다 안정화되기 때문이다. 전파 단계는 산화, 수소 추상화 및 광분해를 통해 베타 소멸 반응과 활성산소의 수가 증가하면서 폴리오레핀에 대해 관찰된 단계와 본질적으로 동일하다. 이러한 단계는 체인 파괴의 대부분을 차지하지만, 경미한 경로에서는 과산화수소가 중합체와 직접 반응하여 케톤군(아세토페논)과 말단 알켄을 형성하여 추가적인 활성산소가 형성되지 않는다.[24]
폴리스티렌은 광산화 시 노란색으로 관찰되는데, 이는 이들 단자 알케네에서 폴리엔이 형성되기 때문으로 풀이된다.[25]
폴리염화비닐 - (PVC)
폴리염화비닐(PVC)과 같은 순수 유기염화물은 220nm 이상의 빛을 흡수하지 않는다. 광산화 발단은 대신 구조 결함뿐[26][27] 아니라 하이드로페로산화물, 카보닐 그룹, 이중 결합 등 폴리머 체인의 각종 불규칙성 때문에 발생한다.[28] 처리 중 형성된 수산화물은 가장 중요한 이니시에이터지만 [29]광산화 시 농도가 감소하는 반면 카보닐 농도는 증가하는 반면,[30] 이러한 카보닐은 시간이 지남에 따라 주요 이니시에이터가 될 수 있다.[29][31][32]
전파 단계에는 하이드로페록실 라디칼이 포함되며, 이는 유사한 속도로 중합체의 탄화수소(-CH-2)와 유기염화수소(-CHCl-2) 부위에서 모두 수소를 추출할 수 있다.[29][31] 탄화수소 현장에서 형성된 활성산소는 염소의 손실과 함께 연소로 빠르게 전환된다. 이것은 지퍼와 같은 반응에서 폴리에네스의 형성을 유도하는 수소 추상화에 더 취약한 아군 하이드로겐(빨간색으로 표시)을 형성한다.
폴리에넨이 적어도 8개의 결합 이중 결합을 포함할 경우, 그것들은 노란색으로 변하게 되고 결국 재료의 갈색으로 변하게 된다. 이것은 대기 산소로 광택을 내는 더 긴 폴리엔에 의해 약간 상쇄되지만,[33] PVC는 폴리머 안정기가 존재하지 않는 한 결국 변색된다. 유기염색체 현장의 반응은 광분해가 α-클로로-alkoxyl 과격성을 산출하기 전에 일반적인 하이드로페록실 및 과산화수소를 통해 진행된다. 이 종은 카보닐, 과산화 크로스 링크, 베타 디시션 제품을 주기 위해 다양한 반응을 겪을 수 있다.[34]
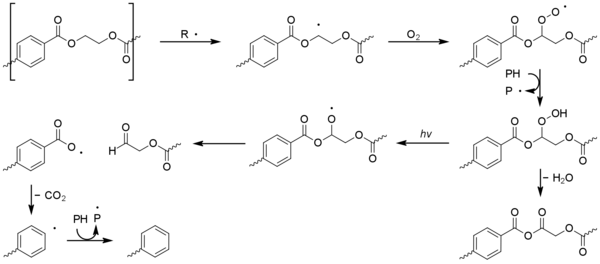
폴리(에틸렌 테레프탈레이트) - (PET)
대부분의 다른 일반 플라스틱과 달리, 폴리에틸렌 테레프탈레이트(PET)는 햇빛에 가까운 자외선을 흡수할 수 있다. 흡수는 360nm에서 시작하여 320nm 이하로 강해지고 300nm 이하로 매우 중요하다.[1][35][36] 이 PET는 다른 일반 플라스틱에 비해 광산화 저항성이 뛰어나지만 양자 수율이 좋지 않기 때문이다.[37] 분해 화학은 동시 광분해(즉, 산소를 포함하지 않음)와 분자의 방향족 및 탈색 부위의 광산화 반응으로 인해 복잡하다. 체인 스크리닝은 지배적인 과정으로, 체인 분기 및 색상 불순물의 형성이 덜 일반적이다. 일산화탄소, 이산화탄소, 카복실산이 주산이다.[35][36] 폴리부틸렌 테레프탈레이트, 폴리에틸렌 나프탈레이트 등 다른 선형 폴리에스테르의 광산화도 비슷하게 진행된다.
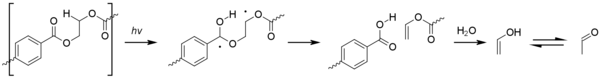
광분해에는 노르웨이의 반응을 일으키는 흥분된 테레프탈산 단위가 형성된다. I형 반응이 지배적인데, 카보닐 유닛에서 연쇄 방해를 일으켜 다양한 제품을 제공한다.[1][38]
타입 II 노리쉬 반응은 덜 흔하지만 비닐 알코올 에스테르를 통해 아세트알데히드를 발생시킨다.[36] 이것은 냄새와 맛의 문턱이 매우 낮으며 생수에 오프 미각을 일으킬 수 있다.[39]
광분해에 의해 형성된 활성산소는 PET에서 광산화 작용을 시작할 수 있다. 방향족 테레프탈산 코어의 광산화 작용은 단계별로 2,5-디히드록시테레프탈산으로 산화된다. 아열대 현장의 광산화 과정은 폴리오레핀에서 볼 수 있는 것과 유사하며, 수산화수소가 형성되면 결국 폴리머 체인의 베타 디스카시스가 된다.[1]
이차인자
환경
아마도 놀랍게도, 기온의 효과는 종종 자외선 노출의 효과보다 더 크다.[5] 이것은 반응률이 온도에 지수 의존성을 가지고 있음을 보여주는 아르헤니우스 방정식의 관점에서 볼 수 있다. 그에 비해 자외선 노출과 산소 가용성에 대한 열화율의 의존도는 대체로 선형이다. 해양 환경의 육지 플라스틱 오염보다 바다가 더 차갑기 때문에 더 느리게 분해된다.[40][41] 매립지에 매립되는 물질은 다른 공정에 의해 점차적으로 부패할 수 있지만 광산화 작용에 의해 전혀 저하되지 않는다.
기계적 스트레스는 광산화[42] 속도에 영향을 줄 수 있으며 플라스틱 물체의 물리적 분해를 가속화할 수도 있다. 응력은 기계적 하중(텐실 및 전단 응력) 또는 심지어 온도 순환에 의해 유발될 수 있으며, 특히 팽창의 온도 계수가 다른 재료로 구성된 복합 시스템에서 더욱 그러하다. 마찬가지로 갑작스러운 강우량은 열적 스트레스를 유발할 수 있다.
염료/염료의 효과
염료와 색소는 색을 제공하기 위해 폴리머 재료에 사용되지만 광산화율에도 영향을 미칠 수 있다. 많은 사람들이 자외선을 흡수하고 그렇게 함으로써 폴리머를 보호하지만, 흡수는 염료들이 폴리머를 공격하거나 에너지를 O로2 전달하여 해로운 싱클레트 산소를 형성할 수 있는 흥분 상태에 들어갈 수 있다. 쿠-프탈로시아닌이 그 예인데, 자외선을 강하게 흡수하지만 흥분한 쿠-프탈로시아닌은 폴리머에서 수소 원자를 추출하여 광시네이터 역할을 할 수 있다.[43] 다른 첨가물이 있을 때 그것의 상호작용은 훨씬 더 복잡해질 수 있다.[44] 마찬가지로, 탄소 블랙은 자외선을 차단하지만 플라스틱에 흡수되는 열 에너지의 양을 크게 증가시킨다.
열화강화를 위한 첨가제
생분해성 첨가물을 폴리머에 첨가하여 분해 속도를 높일 수 있다. 광산화 OXO-바이오드분해 첨가제를 사용한다.[45] 철(Fe), 망간(Mn), 코발트(Co) 등 전이 금속 염이다. Fe 콤플렉스는 펜턴 반응을 통해 수산화물의 균질화를 촉진하여 광산화율을 높인다.
이런 첨가제의 사용은 처리된 플라스틱이 완전히 생분해되지 않고 대신에 미세 플라스틱의 빠른 형성을 초래한다는 우려 때문에 논란이 되어왔다.[46] 옥소 플라스틱은 처리되지 않은 플라스틱과 구별하기 어렵지만 플라스틱 재활용 중에 포함되면 잠재적 용도가 적은 불안정한 제품을 만들 수 있으며,[47][48] 플라스틱 재활용에 대한 비즈니스 사례를 잠재적으로 위태롭게 할 수 있다. OXO-생물분해 첨가제는 2019년[49] EU에서 금지됐다.
예방
햇빛에 의한 UV 공격은 대개 사출 몰딩에 의해 제품을 형성하기 전에 항-UV 폴리머 안정제를 첨가함으로써 개선되거나 예방될 수 있다. 플라스틱의 자외선 안정제는 보통 자외선을 우선적으로 흡수하고 에너지를 낮은 수준의 열로 소멸시키는 작용을 한다. 사용되는 화학물질은 자외선 차단제에 들어있는 것과 유사하며 자외선 차단제로부터 피부를 보호해준다. 그것들은 화장품과 필름을 포함한 플라스틱에서 자주 사용된다. 기질, 의도된 기능 수명, 자외선 저하에 대한 민감도에 따라 다른 UV 안정제가 사용된다. 벤조페논과 같은 자외선 안정제는 자외선을 흡수하고 활성산소의 형성을 막는 작용을 한다. 대체에 따라 UV 흡수 스펙트럼이 용도에 맞게 변경된다. 농도는 보통 0.05%~2%이며, 일부 용도는 최대 5%이다.
종종, 유리는 자외선 저하에 관한 한 폴리머의 더 나은 대안이 될 수 있다. 일반적으로 사용되는 유리 종류는 대부분 자외선에 강한 내성이 있다. 예를 들어 오일 장비를 위한 폭발 보호 램프는 폴리머 또는 유리로 만들 수 있다. 여기선 자외선과 거친 날씨가 폴리머를 너무 심하게 자극해 재료를 자주 교체해야 한다.
폴리(에틸렌-나프탈레이트) (PEN)는 산소의 확산을 감소시키는 보호막 역할을 하는 산화아연 코팅을 적용하여 보호할 수 있다.[50] 산화 아연은 또한 태양 방사선에 의한 산화율과 광노란율을 감소시키기 위해 폴리카보네이트(PC)에도 사용될 수 있다.[51]
분석
중합체의 기상시험
중합체의 광산화 여부는 자연적 또는 가속적 기상 테스트를 통해 조사할 수 있다.[52] 이러한 시험은 폐플라스틱의 운명뿐만 아니라 플라스틱 품목의 예상 사용 수명을 결정하는 데 중요하다.
탐지

적외선 분광법을 이용한 제품에서 심각한 균열이 나타나기 전에 열화를 감지할 수 있다.[53] 특히 광산화 작용에 의해 형성된 과산화종과 카보닐 그룹은 뚜렷한 흡수 밴드를 가지고 있다.
왼쪽의 예에서 카보닐 그룹은 주조 박막에서 IR 분광법에 의해 쉽게 검출되었다. 이 제품은 LDPE에서 회전 몰딩으로 만든 로드콘으로, 사용 중 조기 균열이 발생했다. 처리 중에 항-UV 첨가제를 사용하지 않았기 때문에 많은 유사한 원추형도 실패했다. 실패한 다른 플라스틱 제품들에는 단 몇 달간의 사용 후 갈라진 도로공장에서 사용되는 폴리프로필렌 맨카브가 포함되어 있었다.
참고 항목
참조
- ^ a b c d e f Zweifel, Hans; Maier, Ralph D.; Schiller, Michael (2009). Plastics additives handbook (6th ed.). Munich: Hanser. ISBN 978-3-446-40801-2.
- ^ Feldman, D. (1 October 2002). "Polymer Weathering: Photo-Oxidation". Journal of Polymers and the Environment. 10 (4): 163–173. doi:10.1023/A:1021148205366. S2CID 92300829.
- ^ Solar spectral irradiance (1st ed.). Vienna: Commission internationale de l'eclairage. 1989. ISBN 9783900734220.
- ^ Amin, M.U.; Scott, G.; Tillekeratne, L.M.K. (January 1975). "Mechanism of the photo-initiation process in polyethylene". European Polymer Journal. 11 (1): 85–89. doi:10.1016/0014-3057(75)90179-2.
- ^ a b Grause, Guido; Chien, Mei-Fang; Inoue, Chihiro (November 2020). "Changes during the weathering of polyolefins". Polymer Degradation and Stability. 181: 109364. doi:10.1016/j.polymdegradstab.2020.109364.
- ^ Allen, Norman S.; Chirinos-Padron, Alfonso; Henman, Terence J. (March 1985). "Photoinitiated oxidation of polypropylene: a review". Progress in Organic Coatings. 13 (2): 97–122. doi:10.1016/0033-0655(85)80020-0.
- ^ Osawa, Zenjiro (January 1988). "Role of metals and metal-deactivators in polymer degradation". Polymer Degradation and Stability. 20 (3–4): 203–236. doi:10.1016/0141-3910(88)90070-5.
- ^ Hussain, Ikram; Atiqullah, Muhammad; Fazal, Atif; Alam, Khurshid; Hossaen, Anwar (December 2010). "Effect of selected residual Ziegler–Natta and metallocene catalysts on the UV-induced degradation of unstabilized ethylene homopolymer films". Polymer Degradation and Stability. 95 (12): 2289–2299. doi:10.1016/j.polymdegradstab.2010.09.004.
- ^ Gijsman, Pieter; Sampers, Jacq (January 1997). "The influence of oxygen pressure and temperature on the UV-degradation chemistry of polyethylene". Polymer Degradation and Stability. 58 (1–2): 55–59. doi:10.1016/S0141-3910(97)00012-8.
- ^ Chien, J. C. W. (December 1965). "On the Possible Initiation of Photooxidation by Charge-Transfer Excitation". The Journal of Physical Chemistry. 69 (12): 4317–4325. doi:10.1021/j100782a040.
- ^ Smith, Leesa M.; Aitken, Heather M.; Coote, Michelle L. (18 September 2018). "The Fate of the Peroxyl Radical in Autoxidation: How Does Polymer Degradation Really Occur?". Accounts of Chemical Research. 51 (9): 2006–2013. doi:10.1021/acs.accounts.8b00250. hdl:1885/209140. PMID 30016062.
- ^ Gray, Peter; Williams, Alan (1 April 1959). "The Thermochemistry And Reactivity Of Alkoxyl Radicals". Chemical Reviews. 59 (2): 239–328. doi:10.1021/cr50026a002.
- ^ Carlsson, D. J.; Wiles, D. M. (November 1969). "The Photodegradation of Polypropylene Films. III. Photolysis of Polypropylene Hydroperoxides". Macromolecules. 2 (6): 597–606. Bibcode:1969MaMol...2..597C. doi:10.1021/ma60012a007.
- ^ Costa, L.; Luda, M.P.; Trossarelli, L. (January 1997). "Ultra high molecular weight polyethylene—II. Thermal- and photo-oxidation" (PDF). Polymer Degradation and Stability. 58 (1–2): 41–54. doi:10.1016/S0141-3910(97)00010-4.[데드링크]
- ^ Gugumus, F. (January 1990). "Contribution to the photolysis of hydroperoxides in polyethylene". Polymer Degradation and Stability. 27 (1): 19–34. doi:10.1016/0141-3910(90)90094-N.
- ^ Gugumus, F. (March 1988). "Contribution to polyethylene photooxidation". Angewandte Makromolekulare Chemie. 158 (1): 151–176. doi:10.1002/apmc.1988.051580108.
- ^ Hartley, G. H.; Guillet, J. E. (March 1968). "Photochemistry of Ketone Polymers. I. Studies of Ethylene-Carbon Monoxide Copolymers". Macromolecules. 1 (2): 165–170. Bibcode:1968MaMol...1..165H. doi:10.1021/ma60002a012.
- ^ Rabek, J. F.; ??anby, B. (January 1975). "Role of singlet oxygen in photo-oxidative degradation and photostabilization of polymers". Polymer Engineering and Science. 15 (1): 40–43. doi:10.1002/pen.760150107.
- ^ Kuzina, Svetlana I.; Mikhailov, Alfa I. (November 2001). "Photo-oxidation of polymers 4. The dual mechanism of polystyrene photo-oxidation: a hydroperoxide and a photochain one". European Polymer Journal. 37 (11): 2319–2325. doi:10.1016/S0014-3057(01)00028-3.
- ^ Gardette, Jean-Luc; Mailhot, Bénédicte; Lemaire, Jacques (January 1995). "Photooxidation mechanisms of styrenic polymers". Polymer Degradation and Stability. 48 (3): 457–470. doi:10.1016/0141-3910(95)00113-Z.
- ^ Yousif, Emad; Haddad, Raghad (December 2013). "Photodegradation and photostabilization of polymers, especially polystyrene: review". SpringerPlus. 2 (1): 398. doi:10.1186/2193-1801-2-398. PMC 4320144. PMID 25674392.
- ^ a b Rabek, Jan F.; Rånby, Bengt (February 1974). "Studies on the photooxidation mechanism of polymers. I. Photolysis and photooxidation of polystyrene". Journal of Polymer Science: Polymer Chemistry Edition. 12 (2): 273–294. Bibcode:1974JPoSA..12..273R. doi:10.1002/pol.1974.170120203.
- ^ a b Ranby, B.; Lucki, Julia (1 January 1980). "New aspects of photodegradation and photooxidation of polystyrene". Pure and Applied Chemistry. 52 (2): 295–303. doi:10.1351/pac198052020295.
- ^ Geuskens, G.; Baeyens-Volant, D.; Delaunois, G.; Lu-Vinh, Q.; Piret, W.; David, C. (January 1978). "Photo-oxidation of polymers—I". European Polymer Journal. 14 (4): 291–297. doi:10.1016/0014-3057(78)90051-4.
- ^ Geuskens, G.; Baeyens-Volant, D.; Delaunois, G.; Lu-Vinh, Q.; Piret, W.; David, C. (1 January 1978). "Photo-oxidation of polymers—I: A quantitative study of the chemical reactions resulting from irradiation of polystyrene at 253.7 nm in the presence of oxygen". European Polymer Journal. 14 (4): 291–297. doi:10.1016/0014-3057(78)90051-4.
- ^ Starnes, William H. (3 May 2005). "Structural defects in poly(vinyl chloride)". Journal of Polymer Science Part A: Polymer Chemistry. 43 (12): 2451–2467. Bibcode:2005JPoSA..43.2451S. doi:10.1002/pola.20811.
- ^ Adeniyi, Jacob B.; Scott, Gerald (1 January 1987). "The effects of structural defects on the stability of poly(vinyl chloride): A critical review". Polymer Degradation and Stability. 17 (2): 117–129. doi:10.1016/0141-3910(87)90099-1.
- ^ Starnes, W. H. (8 April 1981). "Photodegradation of Polyvinyl Chloride: A Survey of Recent Studies". Photodegradation and Photostabilization of Coatings. 151: 197–215. doi:10.1021/bk-1981-0151.ch014.
- ^ a b c Boyd Cooray, B.; Scott, G. (February 1981). "The effect of thermal processing on PVC—Part VIII: The role of thermally formed peroxides on photo-degradation". Polymer Degradation and Stability. 3 (2): 127–135. doi:10.1016/0141-3910(81)90005-7.
- ^ Jian, Li; Dafei, Zhou; Deren, Zhao (January 1991). "The photo-degradation of PVC: Part II—Structural changes in PVC chains". Polymer Degradation and Stability. 31 (1): 1–7. doi:10.1016/0141-3910(91)90091-5.
- ^ a b Decker, C. (January 1984). "Degradation of poly(vinyl chloride) by u.v. radiation—II". European Polymer Journal. 20 (2): 149–155. doi:10.1016/0014-3057(84)90201-5.
- ^ Decker, Christian; Balandier, Michel (July 1981). "Photo-oxidation of poly(vinyl chloride)". Polymer Photochemistry. 1 (3): 221–232. doi:10.1016/0144-2880(81)90021-X.
- ^ Rabek, Jan F.; Rånby, Bengt; Östensson, Bengt; Flodin, Per (15 December 1979). "Oxidation of polyene structures in poly(vinyl chloride) by molecular oxygen and singlet oxygen". Journal of Applied Polymer Science. 24 (12): 2407–2413. doi:10.1002/app.1979.070241209.
- ^ Jian, Li; Dafei, Zhou; Deren, Zhao (January 1990). "The photo-degradation of PVC: Part I—Photo-degradation in air and nitrogen". Polymer Degradation and Stability. 30 (3): 335–343. doi:10.1016/0141-3910(90)90087-N.
- ^ a b Day, M.; Wiles, D. M. (January 1972). "Photochemical degradation of poly(ethylene terephthalate). II. Effect of wavelength and environment on the decomposition process". Journal of Applied Polymer Science. 16 (1): 191–202. doi:10.1002/app.1972.070160117.
- ^ a b c Day, M.; Wiles, D. M. (January 1972). "Photochemical degradation of poly(ethylene terephthalate). III. Determination of decomposition products and reaction mechanism". Journal of Applied Polymer Science. 16 (1): 203–215. doi:10.1002/app.1972.070160118.
- ^ Osborn, K. R. (August 1959). "The photolysis of polyethylene terephthalate". Journal of Polymer Science. 38 (134): 357–367. Bibcode:1959JPoSc..38..357O. doi:10.1002/pol.1959.1203813407.
- ^ Sang, Tian; Wallis, Christopher J.; Hill, Gavin; Britovsek, George J.P. (August 2020). "Polyethylene terephthalate degradation under natural and accelerated weathering conditions". European Polymer Journal. 136: 109873. doi:10.1016/j.eurpolymj.2020.109873.
- ^ Nawrocki, J; Dąbrowska, A; Borcz, A (November 2002). "Investigation of carbonyl compounds in bottled waters from Poland". Water Research. 36 (19): 4893–4901. doi:10.1016/S0043-1354(02)00201-4. PMID 12448533.
- ^ Pegram, Jan E.; Andrady, Anthony L. (January 1989). "Outdoor weathering of selected polymeric materials under marine exposure conditions". Polymer Degradation and Stability. 26 (4): 333–345. doi:10.1016/0141-3910(89)90112-2.
- ^ Chamas, Ali; Moon, Hyunjin; Zheng, Jiajia; Qiu, Yang; Tabassum, Tarnuma; Jang, Jun Hee; Abu-Omar, Mahdi; Scott, Susannah L.; Suh, Sangwon (9 March 2020). "Degradation Rates of Plastics in the Environment". ACS Sustainable Chemistry & Engineering. 8 (9): 3494–3511. doi:10.1021/acssuschemeng.9b06635.
- ^ Tyler, David R. (30 December 2004). "Mechanistic Aspects of the Effects of Stress on the Rates of Photochemical Degradation Reactions in Polymers". Journal of Macromolecular Science, Part C: Polymer Reviews. 44 (4): 351–388. doi:10.1081/MC-200033682. S2CID 97316912.
- ^ "THE PHOTO-OXIDATION OF POLYMERS - A comparison with low molecular weight compounds" (PDF). Pergamon Press Ltd. 1979 - Pure & Appi. Chem., Vol. 51, pp.233—240. Retrieved 9 February 2011.
- ^ Allen, N.S.; Vasiliou, C.; Marshall, G.P.; Chen, W. (January 1989). "Light stabiliser, antioxidant and pigment interactions in the thermal and photochemical oxidation of polyethylene films". Polymer Degradation and Stability. 24 (1): 17–31. doi:10.1016/0141-3910(89)90130-4.
- ^ Ammala, Anne; Bateman, Stuart; Dean, Katherine; Petinakis, Eustathios; Sangwan, Parveen; Wong, Susan; Yuan, Qiang; Yu, Long; Patrick, Colin; Leong, K.H. (August 2011). "An overview of degradable and biodegradable polyolefins". Progress in Polymer Science. 36 (8): 1015–1049. doi:10.1016/j.progpolymsci.2010.12.002.
- ^ "on the impact of the use of oxo-degradable plastic, including oxo-degradable plastic" (PDF). EUROPEAN. Retrieved 11 November 2020.
- ^ Babetto, Alex S.; Antunes, Marcela C.; Bettini, Sílvia H. P.; Bonse, Baltus C. (February 2020). "A Recycling-Focused Assessment of the Oxidative Thermomechanical Degradation of HDPE Melt Containing Pro-oxidant". Journal of Polymers and the Environment. 28 (2): 699–712. doi:10.1007/s10924-019-01641-6. S2CID 209432804.
- ^ Aldas, Miguel; Paladines, Andrea; Valle, Vladimir; Pazmiño, Miguel; Quiroz, Francisco (2018). "Effect of the Prodegradant-Additive Plastics Incorporated on the Polyethylene Recycling". International Journal of Polymer Science. 2018: 1–10. doi:10.1155/2018/2474176.
- ^ EU 지침 2019/904 (제5조), EU 지침 2019년 6월 5일
- ^ L. Guedri-Knani, J. L. Gardette, M. Jacquet, A. Rivaton, 아연 산화 코팅에 의한 폴리(에틸렌-나프탈레이트)의 광복제, 표면 및 코팅 기술, Volumes 180-181, 2004년 3월 1일, 71-75페이지
- ^ A. 무스타그피르, E. 토마셀라, A. 리바톤, B. Mailhot, M. Jacquet, J. L. Gardette, J. Cellier, Sputtered 아연 산화물 코팅: 구조 연구 및 폴리탄산염, 표면 및 코팅 기술의 광전자복제 적용, Volume 180-181, 2004년 3월 1일, 642-645페이지.
- ^ Jacques, L.F.E (November 2000). "Accelerated and outdoor/natural exposure testing of coatings". Progress in Polymer Science. 25 (9): 1337–1362. doi:10.1016/S0079-6700(00)00030-7.
- ^ Celina, Mathew C.; Linde, Erik; Martinez, Estevan (March 2021). "Carbonyl Identification and Quantification Uncertainties for Oxidative Polymer Degradation". Polymer Degradation and Stability: 109550. doi:10.1016/j.polymdegradstab.2021.109550.