테르트부틸페록시벤조이트
tert-Butyl peroxybenzoate | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 테르트부틸벤젠카르보페록소아테 | |
| 기타 이름 테르트부틸페르벤조이트 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.009.440 |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C11H14O3 | |
| 어금질량 | 194.230 g·190−1 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
TBPB(tert-Butyl peroxybenzoate)는 페레스터 그룹(일반 구조 R-C1(O)OO-R을2 포함하는 합성물)의 화학 화합물로, 페닐 그룹을 R로1, 테르트 부틸 그룹을2 R로 함유하고 있다.에틸렌으로부터 LDPE의 생산, 불포화 폴리에스테르 수지와 같은 교차연결을 위한 등 중합반응에 급진적인 이니시에이터로 자주 사용된다.
특성.
TBPB는 물에 거의 녹지 않지만 에탄올이나 프탈레이트 같은 많은 유기 용매에서 잘 녹는 투명한 연두색 액체다.[1]
페록소 화합물로서 TBPB는 약 8.16 wt%의 활성산소를 함유하고 있으며 자가가속 분해온도(SADT)는 약 60 °C이다.SADT는 운송포장 내 자가가속분해가 일주일 이내에 발생할 수 있는 최저온도로, 보관이나 운송 중에는 이를 초과해서는 안 된다.[2]따라서 TBPB는 최소 10°C(고형화 이하)에서 최대 50°C 사이에 저장해야 한다.고부화 용매로 희석하면 SADT가 증가한다.과산화 에스테르 50%가 분해되는 TBPB의 반감기는 104°C에서 10시간, 124°C에서 1시간, 165°C에서 1분이다.아민, 금속 이온, 강한 산, 염기뿐만 아니라 강한 환원제와 산화제는 낮은 농도에서도 TBPB의 분해를 가속화한다.[2]그러나 TBPB는 취급 시 가장 안전한 페레스터 또는 유기 과산화물 중 하나이다.[3]테르트-부틸 과록시벤조이트의 주요 분해 산물은 이산화탄소, 아세톤, 메탄, 테르트-부탄올, 벤조산, 벤젠이다.[4]
생산
페레스터의 표준 준비 절차는 염화 벤조일(benzoyl)을 사용한 테르트 부틸(tert-butyl hydroperoxide) 아킬화다.[5]반응에는 테르트-부틸 수산화수소가 많이 사용되고 형성된 염화수소는 바쿠오에서 제거되며, 여기서 사실상 양적 수율을 얻는다.
적용들
폴리머 화학에서의 응용
TBPB는 주로 에틸렌(LDPE에 대한 것), 염화비닐, 스티렌 또는 아크릴 에스테르 등의 중합이나 이른바 불포화 폴리에스테르 레진(UP 레진)으로 급진적인 이니시에이터로 사용된다.[1]UP 레진 양생에 사용되는 수량은 약 1~2%[1]이다.
특히 식품이나 화장품 분야에서 응용을 위한 폴리머 생산의 단점은 폴리머에서 확산될 수 있는 분해 제품으로서 벤젠이 형성될 수 있다는 것이다(예: LDPE 포장 필름).
유기화학분야의 응용
1차 아미노 그룹 및 2차 아미노 그룹에 대한 보호 그룹 2-트리메틸릴슬레탄설폰산나트륨에 대한 비닐트리메틸실렌과 TBPB의 반응과 그에 상응하는 황화염에 대한 티오닐의 반응을 통해 접근할 수 있다.[3]
TBPB를 사용하여 불포화 탄화수소의 아군 위치에서 벤조일록시 그룹을 도입할 수 있다.[6]
사이클로헥센으로부터, 3-벤조일록시사이클록센은 71~80%의 수율에서 구리(I)브로마이드의 촉매 양이 존재하는 곳에서 TBPB로 형성된다.
이러한 알케인의 동맹적 산화(Kharasch-Sosnovsky 산화)는 구리(I)브로미드의 촉매 양이 존재하는 곳에서 인종적 동맹적 벤조이트를 생성한다.[7]
반응의 수정은 구리를 이용한다.II) 촉매로서의 트리플루오르메탄네술폰산염, TBPB와 함께 아군 벤조이트에 대한 Acyclic olefin의 반응에서 최대 80%의 수율을 달성하기 위한 베이스로서의 DBN 또는 DBU.[8]
대체된 옥사졸린과 티아졸린은 TBPB에 의한 수정된 카라시-소노브스키 산화와 적절한 수확량에 Cu(I)와 Cu(II) 염을 혼합하여 해당 옥사졸과 티아졸로 산화시킬 수 있다.[9]
C-4 위치에 있는 카르발코시 그룹은 반드시 성공적인 반응이다.
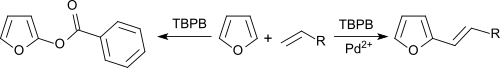
벤젠과 푸란은 팔라듐 염 촉매에 따른 산화 커플링에서 올레핀으로 알케닐화 할 수 있으며, TBPB는 수소 수용기로 사용할 수 있다.[10]
Pd솔트가2+ 없을 때 방향제는 벤조실화된다.
참조
- ^ a b c United Initiator, Technisches Datenblatt, TBPB
- ^ a b 유기 과산화물 생산자 안전 부문, 플라스틱 산업의 사회, 2012년판 2016-04-01년판 웨이백머신에 유기 과산화물 생산자 안전 부문, 안전 및 취급
- ^ a b "2-Trimethylsilylethanesulfonyl chloride (SES-Cl)". Organic Syntheses. doi:10.15227/orgsyn.075.0161.
- ^ PERGAN GmbH: Organicche Peroxide für
- ^ N.A. Milas, D.G. Orphanos, R.J. Klein (1964), "The solvolysis of acid chlorides with t-alkyl hydroperoxides", J. Org. Chem., vol. 29, no. 10, pp. 3099–3100, doi:10.1021/jo01033a525
{{citation}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ "3-Benzoyloxycyclohexene". Organic Syntheses. doi:10.15227/orgsyn.048.0018.
- ^ M.S. Kharasch, G. Sosnovsky (1958), "The reactions of t-butyl perbenzoate and olefins – a stereospecific reaction", J. Am. Chem. Soc., vol. 80, no. 3, p. 756, doi:10.1021/ja01536a062
- ^ G. Sakar, A. DattaGupta, V.K. Singh (1996), "Cu(OTf)2 – DBN/DBU complex as an efficient catalyst for allylic oxidation of olefins with tert-butyl perbenzoate", Tetrahedron Lett., vol. 37, no. 46, pp. 8435–8436, doi:10.1016/0040-4039(96)01911-9
{{citation}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ A.I. Meyers, F.X. Tavares (1996), "Oxidation of Oxazolines and Thiazolines to Oxazoles and Thiazoles. Application of the Kharasch−Sosnovsky Reaction", J. Org. Chem., vol. 61, no. 23, pp. 8207–8215, doi:10.1021/jo9613491, PMID 11667808
- ^ J. Tsuji, H. Nagashima (1984), "Palladium-catalyzed oxidative coupling of aromatic compounds with olefins using t-butyl perbenzoate as a hydrogen accepter", Tetrahedron, vol. 40, no. 14, pp. 2699–2702, doi:10.1016/S0040-4020(01)96888-7