시냅스 안정화
Synaptic stabilization시냅스 안정화는 발달 중인 신경계 및 성인 신경계에서 매우 중요하며 장기강화(LTP)의 후기의 결과로 간주됩니다.이 메커니즘은 세포골격 및 세포외 매트릭스 요소 및 시냅스 후 골격 단백질의 발현 증가를 통해 활성 시냅스를 강화하고 유지하는 동시에 덜 활성 시냅스를 제거하는 것을 포함한다.예를 들어 세포접착분자(CAM)는 시냅스 유지 및 안정화에 큰 역할을 합니다.Gerald Edelman은 CAM을 발견하고 발달하는 동안 그 기능을 연구했는데, 이것은 CAM이 세포 이동과 [1][2]전체 신경계의 형성에 필요하다는 것을 보여주었다.성인 신경계에서 CAM은 학습과 [3]기억과 관련된 시냅스 가소성에 필수적인 역할을 한다.
CAM의 종류
SynCAM
시냅스 세포 접착 분자(CAM)는 신경 발달 동안 축삭 경로 탐색과 뉴런 사이의 시냅스 확립에 중요한 역할을 하며 시냅스 전후의 신호 전달 경로의 올바른 정렬, 내구증 및 외구증 관련 소포 재활용을 포함한 많은 시냅스 과정의 필수 구성 요소입니다.시냅스 후 수용체의 통합과 시냅스 성분의 안정성을 보장하기 위해 세포골격에 고정
SynCAMs(Cadm 또는 nectin 유사 분자라고도 함)는 흥분성 시냅스의 성장과 안정을 촉진하는 척추동물에서 발견되는 시냅스 CAM의 특정 유형입니다.SynCAM은 주로 시냅스 전 및 시냅스 후 부위의 뇌에서 국부화되며, 이들의 구조는 세포 내 FERM 및 PDZ 결합 도메인, 단일 막 통과 도메인 및 세 개의 세포 외 Ig 도메인으로 구성된다.신경발달 중 SynCAM1과 같은 SynCAM은 축삭 성장 원추의 "접촉 센서" 역할을 하며 축삭 치내 결합이 이루어졌을 때 빠르게 축적되어 안정적인 접착 [5]복합체를 형성하는데 도움을 준다.
neuroligin과 함께 synCAM1은 co-cultured neuronal 및 non-neuronal cells의 배지에 synCAM1을 추가하면 시냅스 전 말단 형성에 충분한 것으로 알려진 2개의 CAM이다.축삭 성장 원추와 수상돌기의 필로포디아에 있는 2개의 synCAM1 분자의 호모필릭 결합은 시냅스 전 세포와 후 세포 사이의 초기 접촉을 가능하게 한다.[6]
synCAM은 단백질의 Ig 슈퍼패밀리에 속합니다.시냅스 후 막에 내장된 synCAM의 세포질 PDZ 도메인은 시냅스 후 발판 단백질 PSD-95와 상호작용하여 복합체를 기초 세포골격에 고정시킨다.[7]
카데린카테닌
카드헤린은 칼슘 의존성, 호모세포 접착 분자로, [8]카테닌으로 알려진 세포결합 파트너와 복합체를 형성한다.이 복합체의 구성 요소는 많은 다른 발판 단백질, 포스포타아제, 키나아제 및 [9]수용체에 결합합니다.고전적인 카드헤린은 칼슘을 결합하는 5개의 세포외 반복 구조, 단일 막 통과 도메인 및 카테닌 [9][10]파트너를 결합하는 말단 세포질 도메인을 가진 세포내 꼬리를 가지고 있다.최근의 연구는 시냅스 안정화 및 [8][9][10]가소성과 같은 많은 다른 중추신경계 과정에 카드헤린-카테닌 복합체를 포함시켰습니다.
중추신경계의 많은 캐드헤린들은 뚜렷한 공간적, 시간적 [9]발현 패턴을 보인다.예를 들어 N-cadherin은 개발 중인 시냅스에서 널리 발현되고 나중에 성숙한 활성 영역 근처에 남아 구조 변화와 시냅스 안정성 사이의 연결을 제공하는 데 [9]이 복합체가 적합할 수 있음을 시사한다.실제로 국소 시냅스 활성 변화는 카드헤린-카테닌 [9]복합체의 발현에 영향을 미친다.특정 척추에서의 활성 증가는 N-카데린의 이량화로 이어지며, N-카데린은 분해되어 CBP/CREB [9]전사가 억제된다.이러한 억제에는 많은 발달 및 가소성 관련 영향이 있습니다.
수지상 척추 형성 및 가지치기의 경우, 경쟁 가설이 제안되고 확인되었습니다.[11][12]이 가설은 활동 의존적인 방식으로 지역 내 가시들 사이에 분포하는 카드헤린-카테닌 복합체의 상대적 수준이 개별 가시들의 운명을 결정한다는 것을 암시한다.즉, β-카테닌에 대한 척추 간 경쟁은 척추가 성숙할 것인지(복합체 수가 증가) 가지치기할 것인지([12]복합체 수가 감소)를 결정한다.이는 [11]피질회로를 미세화하는 과정에서 개발 과정에서 발생하는 중요한 메커니즘입니다.
넥틴
넥틴은 세포 접착 분자의 독특한 계열이다.이러한 CAM은 시냅스 형성 중 시냅스 전 및 시냅스 후 신경 과정의 초기 접촉에 관여합니다.시냅스에는 Nectin-1, 2, 3, [13]4의 네 가지 특징적인 넥틴만 있습니다.모든 막결합 넥틴은 3개의 면역글로불린 유사 루프를 가진 세포외 영역을 가진다.막에서 가장 멀리 떨어진 루프를 V형 루프라고 하며 내부에 있는 두 개의 루프는 C2형 루프라고 합니다.하나의 세포막 위에 있는 여러 개의 넥틴은 시스 클러스터링이라고 불리는 과정인 넥틴 단백질의 클러스터를 형성하기 위해 V형 루프에서 결합할 것입니다.개별 cis-cluster를 가진 두 개의 세포가 접촉할 때, 그들은 접착력을 제공하고, 경우에 따라서는 [14]두 세포 사이에 시그널링을 제공하는 트랜잭션-상호작용이라고 불리는 강한 복합체를 형성합니다.
시냅스 [15]안정화에서 넥틴의 역할에 대한 가장 강력한 지식은 해마의 CA3 영역에 있는 이끼 섬유 말단과 피라미드 세포 수상돌기 사이에 만들어진 시냅스로부터 온다.이 시냅스의 형성 및 안정에 관여하는 넥틴은 각각 시냅스 후 세포와 시냅스 전 세포의 혈장막에서 돌출하여 이호성 세포외 접촉을 형성하는 넥틴-1과 넥틴-3이다.모든 넥틴의 세포 내 도메인은 L-아파딘이라고 불리는 단백질과 직접 결합합니다.L-아파딘은 액틴 세포골격의 F-액틴에 결합하는 액틴 결합 단백질이다.이러한 방식으로, 넥틴은 통제되고 안정된 [16]환경에서 시냅스가 발달할 수 있도록 하는 세포들의 작용 구조에서 리지드 연결을 형성합니다.
CA3 영역에서 시냅스가 성숙함에 따라 시냅스 안정화에서 서로 밀접하게 연관된 넥틴과 카드헤린은 활성 영역의 주변으로 이동하며 PJ(putta adherens junction)를 형성한다.PAJ는 상피조직의 아데렌 접합부와 같은 기능을 한다.이러한 CAM의 변위와 이 접합부의 형성은 초기 시냅스 막이 상호작용하고 성숙할 수 있는 공간을 제공하고 주변 막을 분리하여 세포 골격 [14]고정 기능을 제공한다.
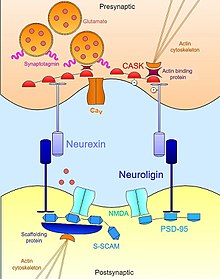
뉴렉신뉴롤리긴
뉴렉신-뉴롤리긴 상호작용은 적절한 시냅스 [17]전달의 안정화와 유지에 필수적인 트랜스 시냅스 기능 비대칭성을 확립하는 데 도움을 준다.시냅스 전 뉴렉신과 그 시냅스 후 결합 파트너인 뉴롤리긴은 신경 발달 초기에 복합적이며 둘 다 시냅스 [18]발생의 잠재적 유도 인자로 알려져 있습니다.뉴렉신을 인위적으로 발현하는 비뉴렉신 세포는 공배된 [19]뉴런에서 시냅스 후 분화를 동원하기에 충분하다.뉴롤리긴 발현 세포도 마찬가지로 인접한 [20][21]뉴런에서 시냅스 전 분화의 마커를 유도할 수 있다.그러나, 둘 다 시냅토제네이션에서 중요한 역할을 하지만,[22] 이러한 세포 접착 분자는 발달하는 동안 신경 결합의 형성에 필요하지 않다.뉴렉신 또는 뉴롤리긴 중 하나의 트리플 녹아웃 마우스 돌연변이는 정상적인 수의 시냅스를 나타내지만, 정상적인 시냅스 [23]전달 장애로 인한 배아 치사 표현형을 발현한다.따라서 시냅스 형성 자체에는 필요하지 않지만 생존에 필요한 기능 회로로의 시냅스 성숙 및 집적에는 필수적이다.
서로 세포 외 접촉을 넘어, 뉴렉신과 뉴롤리긴은 또한 시냅스 전달의 필요한 구성 요소를 국소화하는 데 도움을 주는 어댑터 단백질과 발판 구조의 광대한 네트워크에 세포 내 결합합니다.예를 들어, 최초로 발견된 뉴롤리긴(NLGN1)은 기능적으로 NMDA 수용체를 적절한 시냅스 후 [21][24]위치에 연결하는 글루탐산 시냅스의 잘 알려진 발판 단백질인 PSD95에 결합하는 PDZ 도메인에 의해 확인되었다.마찬가지로 뉴롤리긴의 다른 아이소폼(NLGN2)은 GABA-ergic 시냅스에 특이적인 비계단백질인 게피린과 상호작용하여 시냅스 어댑터 단백질 콜리비스틴의 [25]활성화를 담당한다.뉴렉신의 경우, 이들의 세포내 결합 상호작용은 활성 영역에서 시냅스 전달을 위한 필수기구를 모집하는데 동등하게 중요하다.뉴렉신은 뉴롤리긴과 마찬가지로 CASK(칼슘-칼슘-칼모듈린-의존성 단백질인산화효소)[24]와 관련된 PDZ 도메인을 가지고 있다.CASK는 그 자체와 뉴렉신을 인산화시키는 것 외에 뉴렉신과 액틴 결합 단백질 사이의 상호작용을 촉진하여 뉴렉신이 시냅스 안정성과 가소성에 필수적인 세포골격역학을 변조할 수 있는 직접적인 연결을 제공한다.뉴렉신은 또한 시냅스 소포의 막에 내장된 단백질인 시냅토타그민에 결합할 수 있으며, 시냅스 자극 [26][23]시 신경전달물질의 세포외증에 필요한 이온 플럭스를 매개하는 전압 게이트 칼슘 채널과의 결합을 촉진할 수 있다.이러한 방식으로, 뉴렉신과 뉴롤리긴은 시냅스의 형태학적, 기능적 측면을 조정하며, 이는 다시 신경 전달을 위한 완전한 기능적 플랫폼으로 초기, 미성숙한 접촉을 안정시킬 수 있게 한다.
에프린-Eph 신호
에프린과 같은 비전통 접착 분자도 시냅스 접촉을 안정시키는 데 도움이 됩니다.에프 수용체와 그 막 결합 리간드인 에프린은 축삭 유도, 신경 이동, 시냅토제네이션 및 [27][28]축삭 가지치기를 포함한 다양한 세포 과정에 관여한다.해마에서 수지상 척추형태는 쌍방향 에프린/[29]EphA 시그널링을 통해 성상세포에 의해 조절될 수 있다.성상세포와 그 과정은 에프린 A3를 발현하는 반면, EpA4 수용체는 해마 뉴런에서 농축된다.에프린 A3/EphA4 시그널링에 의해 매개되는 이 상호작용은 사이클린 의존성 키나제 5(Cdk5)의 모집 및 활성화를 유도하고, 그 후 구아닌 교환인자(GEF), 에펙신 [30]1을 인산화한다.인산화 에펙신1은 작은 GTPase인 RhoA를 활성화하여 그 이펙터인 Rho-kinase(ROCK)의 후속 활성화를 유도할 수 있으며, 이는 액틴 필라멘트의 [30]재배열을 초래한다.이 메커니즘을 통해 성상세포 과정은 에프린/EphA 시그널링을 통해 개별 수상돌기를 안정시킬 수 있을 뿐만 아니라 척추로 성숙시킬 수 있다.EpA4의 활성화를 수반하는 전방 시그널링은 신경근 [30]접합부의 시냅스 단백질을 안정화시킨다.EpA4/ephrinA3 매개 뉴런-글리아 상호작용에서와 같이, 이 과정은 [30]에펙신을 통해 ROCK를 활성화함으로써 액틴 세포골격의 역학을 조절한다.
에프린 B/EphB 시그널링도 다른 메커니즘을 통한 시냅스 안정화에 관여한다.이들 분자는 새롭게 형성된 CNS 시냅스를 [28]안정시키기 위해 PDZ 도메인을 통해 발판 단백질과 상호작용하는 세포질 꼬리를 포함한다.예를 들어 에프린 B3는 어댑터 단백질 글루탐산-수용체-상호작용단백질 1(GRIP-1)과 상호작용하여 흥분성 수지상 시냅스의 [28]발달을 조절한다.해마 뉴런 배양에서 확인된 이 과정은 Ep/ephrin B3 역신호가 시냅스 [31]후 축의 막에 GREP1을 모집한다는 것을 밝혀냈다.GREP1은 막축에 도달하면 글루탐산 수용체를 시냅스 전 말단 아래에 고정시키는 데 도움이 됩니다.이 과정은 또한 시냅스에서 [27]AMPA 수용체의 안정화를 이끄는 에프린-B 카르복실 말단(PDZ 결합 모티브에 근접한) 근처의 세린 잔류물의 인산화도 포함한다.
해마 뉴런에서 발견된 또 다른 메커니즘은 EpB 시그널링이 EpAs에서 [32]관찰된 바와 같이 Rho GTPase 활성을 조절함으로써 척추 성숙을 촉진할 수 있다는 것을 밝혔다.그러나 EpAs와 달리 EpB2 수용체는 시냅스 후 N-메틸-D-아스파르트산 수용체(NMDARs)와 상호작용하여 에프린B [32][30][33]결합 시 복합체에 GEF Tiam1을 수용하는 것으로 나타났다.Tiam1의 인산화 작용은 NMDAR 활성에 반응하여 일어나며, 이는 Tiam1을 활성화하는 칼슘의 유입을 허용한다.이 메커니즘은 또한 액틴 세포골격의 변조를 초래한다.이 안정화 결과 EpB2 순방향 시그널링과 에프린-B3 역방향 시그널링 모두 NMDAR를 [34]통해 LTP를 유도하는 것으로 밝혀졌다.
레퍼런스
- ^ Rutishauser U, Jessell TM (July 1988). "Cell adhesion molecules in vertebrate neural development". Physiological Reviews. 68 (3): 819–57. doi:10.1152/physrev.1988.68.3.819. PMID 3293093.
- ^ "Gerald M. Edelman biography". Nobelprize.org. Retrieved 13 March 2018.
- ^ Benson DL, Schnapp LM, Shapiro L, Huntley GW (November 2000). "Making memories stick: cell-adhesion molecules in synaptic plasticity". Trends in Cell Biology. 10 (11): 473–82. doi:10.1016/S0962-8924(00)01838-9. PMID 11050419.
- ^ Bukalo, Olena; Dityatev, Alexander (27 December 2012). Synaptic Plasticity Dynamics Development and Disease. Advances in Experimental Medicine and Biology. Vol. 970. Vienna: Springer, Vienna. pp. 97–128. doi:10.1007/978-3-7091-0932-8_5. ISBN 978-3-7091-0932-8. PMID 22351053.
- ^ Biederer, Thomas; Missler, Markus; Südhof, Thomas (2012). "Synaptic Cell Adhesion". Cold Spring Harbor Perspectives in Biology. Cold Spring Harbor Laboratory Press. 4 (4): a005694. doi:10.1101/cshperspect.a005694. PMC 3312681. PMID 22278667. Retrieved 12 March 2018.
- ^ Washbourne, Philip; Dityatev, Alexander; Scheiffele, Peter; Biederer, Thomas; Weiner, Joshua A.; Christopherson, Karen S.; El-Husseini, Alaa (20 October 2004). "Cell Adhesion Molecules in Synapse Formation". Journal of Neuroscience. 24 (42): 9244–9249. doi:10.1523/JNEUROSCI.3339-04.2004. PMC 6730099. PMID 15496659.
- ^ Dalva, Matthew; McClelland, Andrew; Kayser, Matthew (14 February 2007). "Cell adhesion molecules: signalling functions at the synapse". Nature. 8 (3): 206–220. doi:10.1038/nrn2075. PMC 4756920. PMID 17299456.
- ^ a b Bamji SX (July 2005). "Cadherins: actin with the cytoskeleton to form synapses". Neuron. 47 (2): 175–8. doi:10.1016/j.neuron.2005.06.024. PMID 16039559.
- ^ a b c d e f g Arikkath J, Reichardt LF (September 2008). "Cadherins and catenins at synapses: roles in synaptogenesis and synaptic plasticity". Trends in Neurosciences. 31 (9): 487–94. doi:10.1016/j.tins.2008.07.001. PMC 2623250. PMID 18684518.
- ^ a b Seong E, Yuan L, Arikkath J (April 2015). "Cadherins and catenins in dendrite and synapse morphogenesis". Cell Adhesion & Migration. 9 (3): 202–13. doi:10.4161/19336918.2014.994919. PMC 4594442. PMID 25914083.
- ^ a b Whalley K (October 2015). "Neural development: a complex competition for spines". Nature Reviews. Neuroscience. 16 (10): 577. doi:10.1038/nrn4024. PMID 26307326.
- ^ a b Bian WJ, Miao WY, He SJ, Qiu Z, Yu X (August 2015). "Coordinated Spine Pruning and Maturation Mediated by Inter-Spine Competition for Cadherin/Catenin Complexes". Cell. 162 (4): 808–22. doi:10.1016/j.cell.2015.07.018. PMID 26255771.
- ^ Sanes D (January 25, 2011). Development of the Nervous System (3rd ed.). Elsevier. ISBN 978-0-08-092320-8.
- ^ a b Irie K, Shimizu K, Sakisaka T, Ikeda W, Takai Y (December 2004). "Roles and modes of action of nectins in cell-cell adhesion". Seminars in Cell & Developmental Biology. 15 (6): 643–56. doi:10.1016/s1084-9521(04)00088-6. PMID 15561584.
- ^ Rikitake Y, Mandai K, Takai Y (August 2012). "The role of nectins in different types of cell-cell adhesion". Journal of Cell Science. 125 (Pt 16): 3713–22. doi:10.1242/jcs.099572. PMID 23027581.
- ^ Takai Y, Shimizu K, Ohtsuka T (October 2003). "The roles of cadherins and nectins in interneuronal synapse formation". Current Opinion in Neurobiology. 13 (5): 520–6. doi:10.1016/j.conb.2003.09.003. PMID 14630213. S2CID 10053035.
- ^ Craig AM, Kang Y (February 2007). "Neurexin-neuroligin signaling in synapse development". Current Opinion in Neurobiology. 17 (1): 43–52. doi:10.1016/j.conb.2007.01.011. PMC 2820508. PMID 17275284.
- ^ Dean C, Dresbach T (January 2006). "Neuroligins and neurexins: linking cell adhesion, synapse formation and cognitive function". Trends in Neurosciences. 29 (1): 21–9. doi:10.1016/j.tins.2005.11.003. PMID 16337696. S2CID 11664697.
- ^ Nam CI, Chen L (April 2005). "Postsynaptic assembly induced by neurexin-neuroligin interaction and neurotransmitter". Proceedings of the National Academy of Sciences of the United States of America. 102 (17): 6137–42. Bibcode:2005PNAS..102.6137N. doi:10.1073/pnas.0502038102. PMC 1087954. PMID 15837930.
- ^ Brady ST, Siegel GJ, Albers RW, Price DL (2012). Basic neurochemistry : principles of molecular, cellular, and medical neurobiology (Eighth ed.). Waltham, Massachusetts. ISBN 978-0-12-374947-5. OCLC 754167839.
- ^ a b Missler M, Südhof TC, Biederer T (April 2012). "Synaptic cell adhesion". Cold Spring Harbor Perspectives in Biology. 4 (4): a005694. doi:10.1101/cshperspect.a005694. PMC 3312681. PMID 22278667.
- ^ Hortsch M (2009). "A Short History of the Synapse – Golgi Versus Ramón y Cajal". In Hortsch M, Umemori H (eds.). The Sticky Synapse. Springer, New York, NY. pp. 1–9. doi:10.1007/978-0-387-92708-4_1. ISBN 978-0-387-92707-7.
- ^ a b Missler M, Zhang W, Rohlmann A, Kattenstroth G, Hammer RE, Gottmann K, Südhof TC (June 2003). "Alpha-neurexins couple Ca2+ channels to synaptic vesicle exocytosis". Nature. 423 (6943): 939–48. Bibcode:2003Natur.423..939M. doi:10.1038/nature01755. PMID 12827191. S2CID 10315093.
- ^ a b Squire LR (2009). Encyclopedia of neuroscience. Amsterdam: Academic Press. ISBN 978-0-08-096393-8. OCLC 503584095.
- ^ Zhang C, Atasoy D, Araç D, Yang X, Fucillo MV, Robison AJ, Ko J, Brunger AT, Südhof TC (May 2010). "Neurexins physically and functionally interact with GABA(A) receptors". Neuron. 66 (3): 403–16. doi:10.1016/j.neuron.2010.04.008. PMC 3243752. PMID 20471353.
- ^ Hata Y, Davletov B, Petrenko AG, Jahn R, Südhof TC (February 1993). "Interaction of synaptotagmin with the cytoplasmic domains of neurexins". Neuron. 10 (2): 307–15. doi:10.1016/0896-6273(93)90320-Q. PMID 8439414. S2CID 12954601.
- ^ a b Lisabeth EM, Falivelli G, Pasquale EB (September 2013). "Eph receptor signaling and ephrins". Cold Spring Harbor Perspectives in Biology. 5 (9): a009159. doi:10.1101/cshperspect.a009159. PMC 3753714. PMID 24003208.
- ^ a b c Bianchi L (2018). Developmental Neurobiology. New York, NY: Garland Science. pp. 299–302. ISBN 9780815344827.
- ^ Bolton MM, Eroglu C (October 2009). "Look who is weaving the neural web: glial control of synapse formation". Current Opinion in Neurobiology. 19 (5): 491–7. doi:10.1016/j.conb.2009.09.007. PMID 19879129. S2CID 44625935.
- ^ a b c d e Rubenstein J (May 2013). Cellular Migration and Formation of Neuronal Connections: Comprehensive Developmental Neuroscience. San Diego, CA: Elsevier Science & Technology. pp. 659–669. ISBN 978-0-12-397266-8.
- ^ Flannery DB (September 1988). "Nondisjunction in Down syndrome". American Journal of Medical Genetics. 31 (1): 181–2. doi:10.1002/ajmg.1320310123. PMID 2975924.
- ^ a b Lerner AM (October 1990). "Viral myocarditis as an incidental discovery". Hospital Practice. 25 (10): 81–4, 87–90. doi:10.1016/j.brainres.2006.11.033. PMC 2170431. PMID 2170431.
- ^ Arvanitis D, Davy A (February 2008). "Eph/ephrin signaling: networks". Genes & Development. 22 (4): 416–29. doi:10.1101/gad.1630408. PMC 2731651. PMID 18281458.
- ^ Lundgren A, Tibbling L, Henriksson NG (March 2018). "DC-determined displacement of the nystagmus beat in rotatory tests". Practica Oto-Rhino-Laryngologica. 31 (1): 54–64. doi:10.3892/etm.2018.5702. PMID 5795627.