시냅스 게이트
Synaptic gating시냅스 게이트는 특정 시냅스 활동을 억제하거나 촉진함으로써 입력을 게이트하는 신경 회로의 능력입니다.특정 시냅스의 선택적 억제는 철저히 연구되어 왔고(통증의 게이트 이론 참조), 최근의 연구는 허용 게이트 시냅스 전달의 존재를 뒷받침하고 있다.일반적으로 시냅스 게이트는 뉴런의 출력에 대한 중앙 통제 메커니즘을 포함한다.이것은 게이트키퍼 뉴런의 일종을 포함하고 있으며, 이것은 시냅스의 작용 부분과는 독립적으로 선택된 타겟에 대한 정보 전달에 영향을 미치는 능력을 가지고 있다(신경조절 참조).
쌍안정성 뉴런은 활동 전위를 발생시키지 않고 과분극(다운 상태)과 탈분극(업 상태) 휴지막 전위 사이에서 진동할 수 있는 능력을 가지고 있습니다.따라서 이러한 뉴런은 업/다운 뉴런이라고 할 수 있습니다.한 모델에 따르면, 이 능력은 NMDA [1]및 AMPA 글루탐산 수용체의 존재와 관련이 있다.NMDA 수용체의 외부 자극은 뉴런을 다운 상태에서 업 상태로 이동시키는 역할을 하며, AMPA 수용체의 자극은 뉴런이 역치 전위에 도달하고 이를 초과할 수 있도록 한다.이 쌍안정 능력을 가진 뉴런은 게이트키퍼의 외부 뉴런이 위쪽 상태에서 아래쪽 상태로 선택적으로 이동함으로써 게이트 뉴런의 막 전위를 조절할 수 있기 때문에 게이트될 가능성이 있다.이러한 메커니즘은 피질, 시상 및 [1]기저신경절에서 기원하는 게이트키퍼와 함께 핵 어컴벤스에서 관찰되었다.
게이트 시냅스 모델
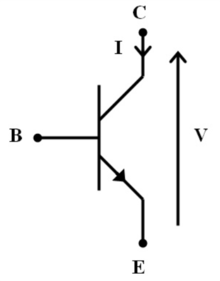
게이트 시냅스 모델은 원래 게이트키퍼가 회로의 트랜지스터 역할을 하는 모델 전자 회로에서 파생되었습니다.회로에서 트랜지스터는 전기 신호를 켜거나 끄는 스위치 역할을 할 수 있습니다.또한 트랜지스터는 회로 내의 기존 전류를 증폭하는 역할을 할 수 있다.실제로 게이트키퍼 뉴런은 시냅스 전 뉴런과 시냅스 후 뉴런 사이의 신호 전달을 변조함으로써 게이트 시냅스의 트랜지스터로서 기능한다.
모델 게이트 시냅스에서는 게이트가 기본적으로 열리거나 닫힙니다.따라서 게이트키퍼 뉴런은 다른 두 뉴런의 시냅스에서 게이트에 대한 외부 스위치 역할을 합니다.이들 뉴런 중 하나는 입력 신호를 제공하고 다른 하나는 출력 신호를 제공합니다.게이트키퍼 뉴런의 역할은 입력이 출력으로 전달되는 것을 조절하는 것입니다.활성화되면 게이트키퍼 뉴런이 시냅스 전 축삭의 극성을 변경하여 게이트를 열거나 닫습니다.이 뉴런이 시냅스 전 축삭을 탈분극시키면 신호가 전달될 수 있습니다.그래서 문이 열려 있습니다.시냅스 전 축삭의 과분극은 관문을 닫는다.트랜지스터와 마찬가지로 게이트키퍼 뉴런은 시스템을 켜거나 끕니다. 시냅스 후 뉴런의 출력 신호에 영향을 줍니다.시냅스 전 뉴런의 입력 신호(자극성 또는 억제성)의 성질에 따라 켜지거나 꺼집니다.
억제
인터뉴론의 변조
억제성 인터요론이 흥분성 타깃 축삭의 막전도율을 변화시켜 흥분성 신호를 확산시키는 [2]션팅 억제에 의해 게이트가 발생할 수 있다.게이트키퍼로부터의 게이트 신호는 이들 억제 인터유론을 트리거하여 한 쌍의 뉴런이 다른 세트에 의해 자극되어도 발화하지 않도록 한다.이 상태에서는 게이트가 [1]닫힙니다.이러한 종류의 게이트의 예는 관련이 없는 [3]자극을 억제하는 데 책임이 있을 수 있는 영장류의 시각 피질[2] 뉴런과 전전두엽 피질(PFC) 영역에서 발견되었다.연구에 따르면 이러한 종류의 억제는 부분적으로 GABA 수용체 매개 [2]시냅스에 기인할 수 있다.
이러한 억제 인터유론이 타겟에 작용하기 위해서는 게이트키퍼 신호로부터 입력을 받아 자극해야 합니다.이 입력은 내적, 외적 또는 둘 [4]다일 수 있습니다.외인성 입력은 주어진 회로와 해부학적으로나 기능적으로 다른 뇌의 영역에서 오는 반면, 내인 입력은 회로 자체일 경우 부품에서 방출된다.일반적으로 이 입력은 호르몬, 신경펩타이드 및 들어오는 [4]뉴런에서 방출되는 다른 신경전달물질과 같은 신경조절물질의 형태로 발생합니다.그런 다음 이러한 신호는 게이트키퍼로 수렴되어 통합되고 타깃으로 향합니다.회로에 따라 다른 뇌 영역에서 게이트 신호가 도착할 수 있습니다.예를 들어 장피질이 내측 PFC의 영역을 게이트하여 다른 뇌 [5]영역으로 돌출하는 것을 억제할 수 있다는 연구 결과가 나왔다.
추가적인 연구는 시상이 게이트 신호의 [6]소스로도 작용할 수 있다는 것을 보여주었다.PFC와 해마 사이의 경로에서는 복측 피개 영역 뉴런의 자극뿐만 아니라 중간 시상 뉴런의 자극이 PFC 뉴런 [6]발사를 억제했다.이러한 억제 효과는 다양한 도파민 수용체 길항제들에 의해 조절되는 것으로 나타났으며, 이는 이 회로에서 신경조절제로서의 도파민의 일부 역할을 암시한다.
공간 주의에서의 역할
뇌의 정보처리능력이 제한적이기 때문에 뇌가 불필요한 정보를 걸러내고 중요한 정보를 선택하는 능력이 필요하다.특히 시각 영역에 대한 입력은 선별적인 관심을 위해 경쟁합니다.주목의 과정에서의 게이트 메커니즘의 모델은 많은 연구자들에 의해 탐구되어 왔지만, 주목의 시냅스 게이트의 역할에 대한 합의는 [7][8][9]이루어지지 않았다.
작업 메모리에서의 역할
기저신경절의 게이트 메커니즘은 관련이 없는 정보를 걸러내고 작업 [10]기억에서 관련 정보에 접근하는 우리의 능력과 관련이 있다.이 경우 게이트키퍼 기능은 시상의 책임입니다.그것은 피질에서 두 영역 사이의 관문을 열어주고, 작동 기억에서 자극의 영향을 허용합니다.그러나 시상골은 기저신경절에 의해 강직하게 억제된다.기저신경절 내의 활성화는 시상 억제 해제와 그에 따른 [1]게이트의 개방을 가능하게 할 것이다.
허용 게이트
활동전위의 발화와 결과적으로 신경전달물질의 방출은 이 게이트 메커니즘에 의해 일어난다.시냅스 게이트에서 활동 전위가 발생하기 위해서는 게이트되는 뉴런에서 단일 출력을 생성하기 위한 입력이 둘 이상 있어야 합니다.이 뉴런들 사이의 상호작용은 생물학적 AND [1]관문을 만든다.게이트되고 있는 뉴런은 쌍안정성이 있고 활동전위를 발화시키기 전에 위쪽으로 이동해야 한다.이 쌍안정성 뉴런이 업 상태일 때 게이트가 열립니다.게이트키퍼 뉴런은 다운 상태에서 업 상태로 이행하여 게이트를 열어 쌍안정 뉴런을 자극하는 역할을 한다.일단 게이트가 열리면, 흥분성 뉴런은 쌍안정성 뉴런을 더욱 탈분극시키고 역치 원인과 활동 전위를 발생시킬 수 있다.만약 게이트키퍼가 쌍안정 뉴런을 아래로부터 위로 이동시키지 않는다면, 흥분성 뉴런은 쌍안정 뉴런에서 활동 전위를 발사할 수 없을 것이다.게이트키퍼 뉴런과 흥분성 뉴런은 모두 쌍안정성 뉴런에서 활동전위를 발화시키기 위해 필요하지만,[1] 둘 다 혼자서는 충분하지 않다.
이러한 유형의 게이트의 예는 핵에서 발생할 수 있습니다.연구에 따르면 해마 뉴런은 전전두피질과 핵액컴 [11]사이의 신호 전달을 관문화할 수 있다.전전두피질뉴런의 자극은 그 뉴런들이 아래로 내려간 상태일 때 핵에서 활동전위를 이끌어낼 가능성이 매우 적다.마찬가지로, 해마 뉴런의 자극은 핵에서 활동 전위를 만들어내는 데 실패하지만, 이 해마 뉴런들은 핵에서 그들의 목표물을 위로 바꾸는 것으로 나타났습니다.이 뉴런들이 위로 유지되는 한, 전전두피질 뉴런의 자극은 핵에서 활동 전위를 생성할 가능성이 훨씬 더 높습니다.[11]따라서 해마는 전전두피질에서 핵액컴벤스로의 정보 흐름의 게이트키퍼 역할을 하며, 그 작용이 이러한 시냅스를 관대하게 게이트한다.
시냅스 게이트는 신경 활동의 효과가 조절되는 다양한 메커니즘을 포함한다.추가 연구는 시냅스 게이트의 [12][13][14]허용적 특성을 증명한다.어떤 경우, 막 탈분극은 이전에 그들이 게이트하고 있던 뉴런에 억제 효과를 주었던 게이트를 열게 할 것이다.그러나 이 관대한 게이트는 단순한 요약 이상의 문제이다.합산이란 축삭 언덕(높은 주파수로 단일 뉴런을 발사하거나 동시에 발사하는 많은 뉴런)에 있는 많은 EPSP의 수렴으로, 막 전위를 한계점까지 탈분극시킨다.시냅스 게이트의 개방에 의한 막 탈분극은 신경전달물질의 방출을 촉진하는 세포 내 칼슘의 증가를 유발하므로 시냅스 전 [15]세포로부터 선택적으로 정보를 분배할 수 있다.
질병
ADHD와 불안의 공존
ADHD로 진단된 아동에 대한 연구는 아헨바흐 아동 행동 [16]체크리스트의 불안/우울 척도에서 상당히 높은 점수를 보였으며, 이는 ADHD와 불안의 공존을 의미한다.핵의 시냅스 동팅 과정의 장애가 이 [17]상호비례의 근본 원인이라고 제안되었다.이 결손은 전전두피질에서 도파민 투입의 시냅스 게이트의 감소를 일으킨다.한 이론은 이 결함이 편도체의 공포 반응을 선택적으로 억제하는 개인의 능력을 떨어뜨려 불안감을 유발한다고 가정한다.그러나 이 장애가 궁극적으로 ADHD [17]환자들에게 어떻게 영향을 미치는지에 대해서는 몇 가지 이론이 있다.
설치류에 관한 연구에서, 전전두피질, 특히 내측전두피질(mPFC)은 밀리초에서 수초 동안 지속되는 정보 처리에 관여한 반면, 해마는 몇 분에서 몇 [18]시간까지 더 긴 시간 척도의 정보 처리에 관여했다.ADHD를 앓고 있는 사람들의 이 두 부위의 손상은 그들이 왜 부주의와 충동성을 보이는지를 보여주는 것 같다.핵흡장 뉴런은 쌍안정성이므로 선택적으로 "상향" – 탈분극 상태 또는 "하향" – 과분극 상태로 게이트될 수 있다.핵 어큐벤스 뉴런은 해마와 편도체의 입력에 의해 게이트되며, 이것은 [19]전전두피질로부터의 입력으로부터 신경에 더 수용적인 탈분극 어큐벤스 뉴런을 생성한다.따라서 ADHD 환자에서는 전전두엽 피질에서 핵 어큐멘스로의 입력이 감소할 뿐만 아니라 해마에서 핵 어큐멘스로의 게이트 입력도 감소하여 핵 어큐멘스 뉴런의 활성화가 감소한다.메틸페니다이트(리탈린)와 같은 약물을 복용하는 사람들은 ADHD의 병태생리학에서 생성된 시냅스 활성의 손실을 보상하는 데 도움이 되는 많은 시냅스를 따라 도파민(DA) 생산량을 증가시킬 것이다.메틸페니데이트를 복용하는 것은 전전두피질과 해마 사이의 시냅스 활성을 증가시키는 작용을 할 수 있을 뿐만 아니라, 핵이 중림부 [20]경로의 일부이기 때문에 보상 시스템으로서도 작용할 수 있다.게다가, 리탈린이 뇌의 긍정적인 강화제 역할을 하기 때문에 리탈린에 있는 사람들이 배우고자 하는 욕구와 욕구가 있는 이유일 수 있다.또한 이러한 보상 회로 활성화는 메틸페니다이트가 중독성이 높고 의존성이 큰 이유일 가능성이 높다.결론적으로, 시냅스 게이트는 리탈린과 같은 ADHD 약물이 시냅스 활성과 기억을 조절하는 그럴듯한 메커니즘을 보여준다.
정신분열증
정신분열증을 앓고 있는 사람들은 종종 상황 의존적인 기억을 설명할 수 없는 것, 감정적인 원가를 보여줄 수 없는 것, 그리고 주의력과 시간적 과정을 보여줄 [19]수 없는 것을 보인다.시냅스 게이트는 이러한 모든 기능들이 발달하는 이유를 설명해 주는 것 같습니다.특히, 기저신경절의 한 영역인 핵 어큐멘스에 대한 해마 입력은 어큐멘스 뉴런 내에서 더 탈분극된 업 상태를 만드는 게이트로서 작용하여 전전두엽 피질(PFC)로부터의 신경에 대한 수용성을 높일 수 있다.게다가 편도체 입력은, 거의 같은 방법으로, 비록 이 탈분극 상태가 훨씬 더 일시적이긴 하지만, 어큐벤스 뉴런 내에서 더 탈분극 상태를 만드는 관문 역할을 합니다.대체로, 핵 축적 신경 세포는 쌍생성이 있다.정신분열증을 앓고 있는 사람들은 부적절한 게이트를 보여줌으로써 핵이 아래로 내려가는 것을 나타내는 해마와 편도체에 손상을 입게 된다.이것이 정신분열증을 가진 사람들이 상황 의존적인 기억력과 적절한 감정의 원가를 나타내지 못하는 이유이다.게다가, 어컴벤스 뉴런은 아래쪽에 있기 때문에 그들은 PFC 자극에 대해 수용적이지 않기 때문에 정신분열증 환자들은 주의력 결손의 문제를 보인다.정신분열증의 게이트 이론은 부적절한 게이트가 많은 행동과 기억력 [19]결손으로 이어지는 쌍안정성 핵 축적 뉴런을 가정한다.
현재 및 미래 연구
현재 연구는 뉴런의 쌍안정성이 더 큰 쌍안정성 신경망의 [21]일부일 수 있다는 사실을 밝혀냈다.청각 피질의 인터뉴론과 함께 쌍안정적 네트워크의 증거가 나타났다.이 청각 피질 네트워크의 안정적인 상태는 동기 또는 반동기이며, 이는 쌍안정성을 나타낸다.청각 인터뉴론이 전기 및 화학적 억제 시냅스와 결합되었을 때, 쌍모달 발화 패턴이 관찰되었다.이 바이모달 패턴은 동기 또는 반동기 중 하나의 상태로 기동하는 네트워크의 쌍안정성을 나타내고 있습니다.이 두 상태는 개인이 음파의 다른 주파수를 인식하는 모드가 될 수 있다.미래의 연구는 이 쌍안정성 네트워크가 쌍안정성 뉴런의 많은 특성을 구현하는지, 그리고 네트워크 전체를 조절하는 더 큰 게이트키퍼가 있는지를 조사하고 있다.
핵의 축적성 뉴런은 [19]쌍생성이기 때문에 게이트가 될 수 있는 것으로 나타났다.최근의 증거는 피질에 있는 뉴런들이 또한 쌍안정성이 있고, 따라서 또한 게이트가 될 수 있다는 것을 보여준다.게이트 회로에는 세 가지 다른 유형이 있는 것으로 보입니다. 하나는 피질에 의해 제어되고, 하나는 시상 내 연관 핵에 의해 제어되고, 다른 하나는 기저 신경절, 피질 및 시상 전체에 걸쳐 있는 회로에 의해 제어됩니다.시상의 게이트가 해마의 전전두피질 반응에 영향을 미친다는 강력한 증거가 있다.이는 프로세스의 쌍안정성을 나타내는 확장 또는 억제 중 하나로 간주됩니다.핵의 침전 뉴런이 게이트 역할을 한다는 것은 증명되었지만, 피질의 뉴런도 같은 방식으로 작용하는가?미래의 연구는 두 쌍의 쌍안정성 뉴런들 사이의 유사점을 조사할 것이다.게다가, 쌍안정성 뉴런을 "다운" 상태로 전환하는 메커니즘은 확장될 필요가 있다.이 상태는 억제로 이어지며, 따라서 이러한 변화를 조절하는 억제성 인터유론이 존재하며, 만약 그렇다면 GABA와 같은 억제성 신경전달물질이 관여하는가?마지막으로, 해마와 시상 뉴런과 같이 관문을 변조할 수 있는 뉴런은 뇌의 많은 다른 영역과 접촉할 수 있습니다.대뇌피질, 핵, 소뇌의 뉴런이 모두 게이트될 수 있다는 연구 결과가 증가함에 따라, 해마는 이 모든 신호를 변조할 수 있고 만약 그렇다면 이러한 다른 뇌 영역을 동시에 변조할 수 있는 훨씬 더 큰 신경 네트워크로 연결할 수 있을까요?이것들은 미래에 [1]시냅스 게이트의 핵심에 있는 질문들이다.
레퍼런스
- ^ a b c d e f g Boukadoum, Mounir; Gisiger, Thomas (2011). "Mechanisms Gating the Flow of Information in the Cortex: What They Might Look Like and What Their Uses may be". Frontiers in Computational Neuroscience. 5: 1. doi:10.3389/fncom.2011.00001. PMC 3025648. PMID 21267396.
- ^ a b c Borg-Graham, LJ; Monier, C; Fregnac, Y (1998). "Visual input evokes transient and strong shunting inhibition in visual cortical neurons". Nature. 393 (6683): 369–73. Bibcode:1998Natur.393..369B. doi:10.1038/30735. PMID 9620800. S2CID 1698876.
- ^ Barbas, H; Zikopolous, B (2007). "The prefrontal cortex and flexible behavior". The Neuroscientist. 13 (5): 532–45. doi:10.1177/1073858407301369. PMC 2855184. PMID 17901261.
- ^ a b Katz, PS; Frost, WN (1996). "Intrinsic neuronmodulation: altering neuronal circuits from within". Trends in Neurosciences. 19 (2): 54–61. doi:10.1016/0166-2236(96)89621-4. PMID 8820868. S2CID 20753760.
- ^ Valenti, O; Grace, AA (2009). "Entorhinal cortex inhibits medial prefrontal cortex and modulates the activity states of electrophysiologically characterized pyramidal neurons in vivo". Cerebral Cortex. 19 (3): 658–74. doi:10.1093/cercor/bhn114. PMC 2637308. PMID 18632738.
- ^ a b Floresco, SB; Grace, AA (2003). "Gating of hippocampal-evoked activity in PFC neurons by inputs from the mediodorsal thalamus and ventral tegmental area". The Journal of Neuroscience. 23 (9): 3930–43. doi:10.1523/JNEUROSCI.23-09-03930.2003. PMC 6742171. PMID 12736363.
- ^ Moran, J; Desimone, R (1985). "Selective attention gates visual processing in the extrastriate cortex". Science. 229 (4715): 782–84. Bibcode:1985Sci...229..782M. CiteSeerX 10.1.1.308.6038. doi:10.1126/science.4023713. PMID 4023713.
- ^ Anderson, C. H.; Van Essen, DC (1987). "Shifter Circuits: A Computational Strategy for Dynamic Aspects of Visual Processing". Proceedings of the National Academy of Sciences. 84 (17): 6297–301. Bibcode:1987PNAS...84.6297A. doi:10.1073/pnas.84.17.6297. JSTOR 29821. PMC 299058. PMID 3114747.
- ^ Crick, F; Koch, C (1990). "Some reflections on visual awareness". Cold Spring Harbor Symposia on Quantitative Biology. 55: 953–62. doi:10.1101/SQB.1990.055.01.089. PMID 2132872.
- ^ McNab, F; Klingberg, T (2008). "Prefrontal cortex and basal ganglia control access to working memory". Nature Neuroscience. 11 (1): 103–7. doi:10.1038/nn2024. PMID 18066057. S2CID 709944.
- ^ a b O'Donnell, P; Grace AA (1995). "Synaptic interactions among excitatory afferents to nucleus accumbens neurons: hippocampal gating of prefrontal cortical input". The Journal of Neuroscience. 15 (5): 3622–39. doi:10.1523/JNEUROSCI.15-05-03622.1995. PMC 6578219. PMID 7751934.
- ^ Ivanov, Andrei I.; Calabrese, Ronald L. (2003). "Modulation of Spike-Mediated Synaptic Transmission by Presynaptic Background Ca2+ in Leech Heart Interneurons". The Journal of Neuroscience. 23 (4): 1206–18. doi:10.1523/JNEUROSCI.23-04-01206.2003. PMC 6742253. PMID 12598609.
- ^ Evans, Colin G.; Jing, Jian; Rosen, Steven C.; Cropper, Elizabeth C. (2003). "Regulation of Spike Initiation and Propagation in an Aplysia Sensory Neuron: Gating-In via Central Depolarization". The Journal of Neuroscience. 23 (7): 2920–31. doi:10.1523/JNEUROSCI.23-07-02920.2003. PMC 6742086. PMID 12684479.
- ^ Herberholz, Jens; Antonsen, Brian L.; Edwards, Donald H. (2002). "A Lateral Excitatory Network in the Escape Circuit of Crayfish". The Journal of Neuroscience. 22 (20): 9078–85. doi:10.1523/JNEUROSCI.22-20-09078.2002. PMC 6757705. PMID 12388615.
- ^ Katz, Paul S. (2003). "Synaptic Gating: The Potential to Open Closed Doors". Current Biology. 13 (14): R554–6. doi:10.1016/S0960-9822(03)00471-8. PMID 12867047. S2CID 10202054.
- ^ Graetz, Brian W.; Sawyer, Michael G.; Hazell, Philip L.; Arney, Fiona; Baghurst, Peter (2001). "Validity of DSM-IV ADHD Subtypes in a Nationally Representative Sample of Australian Children and Adolescents". Journal of the American Academy of Child & Adolescent Psychiatry. 40 (12): 1410–7. doi:10.1097/00004583-200112000-00011. PMID 11765286.
- ^ a b Levy, Florence (2004). "Synaptic Gating and ADHD: A Biological Theory of Comorbidity of ADHD and Anxiety". Neuropsychopharmacology. 29 (9): 1589–96. doi:10.1038/sj.npp.1300469. PMID 15114344.
- ^ Yoon, Taejib; Okada, J.; Jung, M. W.; Kim, J. J. (2008). "Prefrontal cortex and hippocampus subserve different components of working memory in rats". Learning and Memory. 15 (3): 97–105. doi:10.1101/lm.850808. PMC 2275661. PMID 18285468.
- ^ a b c d Grace, Anthony A. (2000). "Gating of information flow within the limbic system and the pathophysiology of schizophrenia". Brain Research Reviews. 31 (2–3): 330–41. doi:10.1016/S0165-0173(99)00049-1. PMID 10719160. S2CID 41827055.
- ^ Sulzer, David; Sonders, M. S.; Poulsen, N. W.; Galli, A (2005). "Mechanisms of neurotransmitter release by amphetamines:A review". Progress in Neurobiology. 75 (6): 206–433. doi:10.1016/j.pneurobio.2005.04.003. PMID 15955613. S2CID 2359509.
- ^ Merriam, Elliot; Netoff, T. I.; Banks, M. I. (2005). "Bistable Network Behavior of Layer I Interneurons in Auditory Cortex". Journal of Neuroscience. 25 (26): 6175–6186. doi:10.1523/JNEUROSCI.0512-05.2005. PMC 1994149. PMID 15987947.



