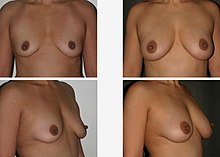
줄기세포 지방 이식술
Stem cell fat grafting줄기세포 지방 이식술은 지방이 많은 기증 부위(예: 허벅지 또는 위)에서 추출한 지방 유도 줄기세포(ADSC)를 얼굴, 가슴, 엉덩이 등 다른 부위에 자가 이식해 수술 부위를 바람직한 모양으로 재구성하는 것이다.[1] ADSC는 지방 조직에서 발견되는 다발성 줄기세포로 골수에서 파생된 중수성 줄기세포(BM-MSC)와 유사한 분화 잠재력을 보인다.[2]
ADSC의 발견은 재생의학과 심미적 시술 분야에 큰 발전을 가져왔다.배아줄기세포의 사용은 윤리적 이유로 재고된 반면, ADSC는 전능한 분화 가능성, 파라신 활동, 면역기능, 호밍 효과와 같은 특징 때문에 성형외과 의사들로부터 주목을 받았다.[3]
수많은 혜택과 상관없이 부작용과 종양학 안전 문제는 거의 없다. 줄기세포 미용 치료제에 대한 투자가 증가하고 있는 것은 특히 한국에 대한 높은 기대와 요구를 반영한다. ADSC 접목 효과에 대한 추가 연구에서는 줄기세포 증식을 위한 적절한 조건과 충분한 영양소 섭취를 촉진함으로써 치료의 여파가 줄기세포의 질과 식단의 영향을 받을 수 있다고 제안했다.[4]
줄기세포 성형수술의 역사
위스콘신 대학의 제임스 톰슨 박사는 1998년에 처음으로 인간 배아 줄기세포를 분리했다. 그러나 배아줄기세포와 관련한 윤리 논란으로 인해 유도 만능줄기세포(iPSC)가 대체 줄기세포로 제안되었다. 재생의학의 가장 중요한 자원으로서 성인줄기세포를 제시함으로써 iPSC의 남아 있는 종양학적 우려는 완화되었다.[5]
자가 지방 이식술의 역사
골수에서 중피줄기세포를 처음으로 분리시킨 것은 1986년 프리든슈타인 외 연구진에 의해 이루어졌으며 주요 임상 줄기세포 원천으로 간주되었다. 그러나 고통스러운 인수와 낮은 세포 수율은 더 이상의 연구를 제한했다. 그 후 Zuk 외 연구진은 ADSC를 분리했고 BM-MSC와 동일한 잠재력을 가지고 있다는 것을 발견했다. 이후 인체의 다른 부분에서 다른 줄기세포가 확인되었지만, ADSC는 가장 쉽게 분리할 수 있고 세포 확장이 필요하지 않기 때문에 가장 안전하다고 여겨졌다. 따라서 ADSC는 여전히 지방 전이 요법의 주요 원천으로 사용된다.[6]
자기 지방 이식술의 개념은 1893년에 처음 제안되었다. 첫 번째 보고서에서는 구조를 바꾸지 않은 지방조직이 골수염으로 인한 부착성 흉터에 이식되었다고 기술했다. 그 결과는 성공적이었고 곧 유방 확대와 코뿔소 수술과 같은 심미적 시술의 다른 분야에서 널리 사용되었다.[6]
1978년에는 지방흡입술의 과다한 퇴적물을 제거하기 위한 지방흡입술이 발명되었다. 이후 일루즈는 이 시술이 지방조직의 이상적인 공급처라는 것을 발견하고 1983년 이식용으로 귀납된 리포아스피레이트를 사용했으며 포니에는 흡인된 지방의 재주입 기법을 제안했다.[6]
3교시는 1994년 에스알 콜먼이 지방세포 전이를 위해 지방 조직을 사용하는 콜맨 기법을 도입한 때부터 시작된다. Lipoaspirate는 ADSC를 포함한 스트롬 혈관 분율(SVF)을 혈액, 조직, 유체, 지질로부터 분리하기 위해 원심분리되었다.[3] 그러나 지방세포 보유율은 30%에서 95%까지 다양했다. 접목 생존을 설명하는 첫 번째 이론은 세포 생존 이론으로, 적절한 순환을 위한 실행 가능한 아디프세포의 이전이 생존율을 높여주고, 이것은 트라우마를 최소화하기 위한 가공과 주사 기술을 개발함으로써 이루어질 수 있다.[6]
최근의 이론은 지방 이식 후 유지율은 지방 이식 후 ADSC가 아디프구를 대체하는 것에 의해 결정된다는 호스트 대체 이론이다. 왜냐하면 성공적인 ADSC 활성화와 아디프세포의 대체는 허혈성 조건에서 전이된 아디프세포의 조기 사망과 관련이 있기 때문이다.[6]
메커니즘
ADSC
팽 외 연구진은 ADSC의 만능 분화 잠재력, 파라클린 활동 및 면역조절 기능 등 세 가지 특성 때문에 ADSC가 가장 널리 사용된다고 제안했다. ADSC는 중피줄기세포(MSC)의 한 종류로 BM-MSC와 유사성이 높다.[7] 따라서, 그들은 지방, 장바구니, 심장 근육, 신경, 피부, 골격 근육으로 다층 분화가 가능하다. 그들은 또한 다른 줄기세포보다 더 높은 증식능력을 가지고 더 오랜 기간 생존하는 경향이 있다. ADSC는 친기생성 요인과 사이토카인, 케모카인, 성장 요인, mRNA, microRNA 등의 항중독 요인을 비밀로 한다. 그리고 나서, 그들은 그들이 이식된 다른 시스템에 작용하고 이 이식된 시스템에서 세포를 재생시킨다. 더구나 ADSC는 BM-MSC와 닮아 면역억제적 특성이 있어 선천적 면역체계와 적응적 면역체계를 모두 억제한다. 그러나 IL-6, TGF-B 등 면역억제 인자의 분비에 의해 BM-MSC보다 용량이 더 강하다. 또한 림프구 증식을 억제하기 위한 면역 허용자 역할을 수행한다. 그러한 특성은 이종 이식용 ADSC의 가능성을 시사한다.[8]
호밍 효과
호밍 효과는 조직의 혈관 구조 내에서 ADSC가 구속되어 골수 내피에 ADSC가 주입되는 것을 말한다. ADSC는 골수 내피에 이식되는데, 내피에 걸쳐 순환하면서 골수 내피에 접착 상호작용이 활성화되기 때문이다. 따라서, 그러한 기구는 전달된 지방의 장기 생존 확률을 증가시킨다. 호밍 효과는 롤링, 접착, 투과 세 가지 주요 과정을 따른다. 롤링하는 동안, ADSC는 전단 저항성과 저선호도 매너에서 골수의 혈관 내피 세포와 이동 및 상호작용한다. ADSC가 골수 내피에 달라붙기 때문에 MSC는 CD44 등소형 및 적분 등 접착력을 높이는 여러 가지 다른 분자를 표현한다. ADSC가 골수 내 혈관을 통해 전이되기 때문에 스트롬 유래 화학요인 -1(SDF-1)과 수용체 CXCR4 사이의 상호작용과 신호가 가장 중요한 과정이다.[9][10]
지방으로부터 격리 또는 팽창
기계식+전자식(ME)과 기계식 방법은 표준 방법은 없지만 가장 일반적인 격리 방법이다.[11] 이에 따라 글래스 박사와 페레티 박사는 기계식 또는 초음파 보조 지방흡입 캐뉼라를 이용한 지방흡입술을 적용하는 ME 방법 중 하나를 제안했다. 지방흡입술을 통해 지방시료를 덜베코의 변형 이글스 매체(DMM)에서 콜라겐아제나 트립신 등의 효소 활성으로 소화한다. 결과 조직 서스펜션은 약 37°C에서 배양과 동요를 거치며 여과기를 통해 여과되어 불필요한 이물질을 제거한다. 원심분리 후 남은 세포 팔레트를 SVF라고 한다. SVF는 소의 종아리 혈청, 1% 페니실린 또는 스트렙토마이신, 그리고 L-글루타민으로 두 번째 정지를 한 후에 판에 씨앗을 뿌린다. 플레이트에 부착된 ADSC의 부착된 특성은 ADSC의 분리를 허용한다.[12] 그러나 순수 ADSC를 분리해야 하는 불편함 때문에, 세포 보조 리포 전이(CAL)가 더 많이 사용된다. CAL은 격리된 SVF와 흡인된 지방을 혼합하여 불량 ADSC를 농축 ADSC로 변환한다.[13] CAL의 효능은 유방 1개당 약 270ml를 도입했을 때 자가 유방 확대 생존율이 증가하여 입증되었다.[14]
합병증과 안전
유방 삽입물
매년 약 150만 명의 여성들이 유방 이식 수술을 받는다.[15] 그러나 지방 이식의 부작용은 심각할 수 있고 환자의 몸에 돌이킬 수 없는 손상을 줄 수 있다. 가장 잘 알려진 부작용은 이물감, 석회화, 지방세포 괴사, 캡슐구조, 파열, 낭종, 그리고 이식된 부위를 빠져나가는 일부 지방세포들이다.
대부분의 경우 석회화와 낭종은 유방확대수술의 가장 큰 위협이다. 새로운 혈액 공급을 채우지 못한 지방 줄기세포는 면역세포에 의해 죽어서 몸에서 제거될 것이다. 그러나, 이 정화 과정이 죽은 세포를 제거하지 못할 때, 성단은 석회화와 낭종 형성으로 이어질 것이다. 이것들은 때때로 가슴에서 덩어리로 보여지며, 선택되지 않은 죽은 세포가 암세포로 발견될 때 더 위험하다. 이는 유방암의 정확한 진단을 방해한다. 석회화 조직은 '베니그' 암으로 진단되어 아무런 해를 끼치지 않을 것이다. 그러나 조직이 심하게 손상되면 유방 전체를 제거해야 한다. 일단 유방 삽입물의 석회화 진단을 받으면, 암 발생 가능성을 감시하기 위해 정기적인 유방조영술을 시행해야 한다.[16]
안면지방 전이
고니츠키 맥길대 교수 등은 안면지방 전이를 받은 환자 4577명을 대상으로 체계적인 검토를 실시했다. 가장 많이 나타나는 부작용은 비대칭성, 피부 불규칙성, 비대칭성, 부종 장기화, 지방 괴사 등이었다.[17]
종양학 안전
호밍 효과는 전이 지방의 장기 생존을 증가시키는 데 장점이 있을 수 있지만, 특히 유방암을 포함한 종양후 이력을 가진 환자들의 우려는 여전하다. 유방종양은 호밍과 이주를 통해 암 진행에 유리한 미세 환경을 발달시켜 지방조직과 밀접하게 위치하기 때문에 더욱 우려스럽다.[18] 암 관련 아디프세포(CAAs)는 전이 및 종양의 진행에 결정적인 역할을 한다. 정상 조건에서 아디프세포는 성숙하고 분화되지 않는다. 그러나 ADSC가 호밍 성질에 의해 혈관에 이동, 순환할 경우 종양 성장이 진전될 수 있다. 나아가 철새세포의 성질은 FGF, ILs, IGF결합단백질 등 아디포킨과 같은 영양인자의 분비에 의해 종양 성장을 촉진하기도 한다. 이것은 그러한 인공적인 특성이 다른 BM-MSC나 폐에서 유래된 MSDC에서 드물기 때문에 혈관화를 증가시킨다.[19]
애플리케이션 및 마케팅
줄기세포 시장
재생의학에서 줄기세포에 대한 인식이 높아지면서 줄기세포 시장은 크게 성장했다. 구글 웹검색 빅데이터 분석 결과 '줄기세포 페이스리프트'라는 용어는 19만7000여 개, '줄기세포 가슴확대'는 약 30만2000여 개에 이르는 것으로 나타났다.[20]
줄기세포 미용 치료제에 대한 관심이 높아지면서 이 수치는 2013년 11월 구글 검색 플랫폼에 등장한 50개 임상 웹사이트의 '줄기세포 치료법' '치료법' '줄기세포 페이스리프트' 내용 분석을 보여준다. 그 결과 (A) 90%의 클리닉이 '자동성인 줄기세포'를 사용하고 있다. (B) 줄기세포 입수한 클리닉의 71%는 환자 지방 출신이었다. (C) 시술의 90%는 피하 방법을 통해 세포를 전달했다. (D) 안면노화 치료는 '줄기세포' 치료뿐만 아니라 '줄기세포 유방 확대' 치료에서도 가장 많이 광고되었다.[21]
사례 연구: 대한민국.
국제미용성형외과협회(ISAPS)는 국내 성형시장이 2017년 기준 약 4억4000만달러 규모로 추정된다고 밝혔다. 세계 시장의 4분의 1 수준으로 연간 성형수술 건수가 1위(연간 인구 1000명당 13.5건)를 차지했다. 국내 줄기세포 시장은 2016년 11억달러 규모로 형성됐으며 2025년에는 연평균 26.67%(95억달러)까지 성장할 것으로 전망된다.[22][23]
2017년 정부는 바이오 분야에 가장 높은 신약 개발 비중(13%), 줄기세포 투자 비중(1억1200만 달러)을 4%에 그쳤다. 카르티스템TM, Inc. 메디포스트는 줄기세포 기반 퇴행성 무릎 연골치료제 개발에 성공해 2017년부터 100억 건 이상의 매출을 달성했다.[22][23]
법적 문제
한국의 큰 줄기세포 미용 치료 시장 규모 뒤에는 일부 병원에서 비전문가들이 자격증 없이 실습하고 있다. 통계청 자료에 따르면 2018년 성형외과 전문의 수는 1,924명으로 대한성형협회에서는 성형외과 비전문가가 전문의의 약 10배에 이를 것으로 추산하고 있다.
신 박사는 최근 줄기세포 유방성형을 옹호하는 비슷한 수술이 잇따르고 있다. 줄기세포 유방 수술을 받을 때는 의사가 공식적으로 입증했는지, 병원에 줄기세포 연구원과 고품질 장비가 있는지 등을 확인해야 한다고 말했다.[24]
줄기세포 치료 후 식이요법
연구는 식이요법이 줄기세포 증식과 성과와 밀접한 관련이 있다는 것을 보여주었다. 줄기세포의 분화와 정착 과정에 영향을 미치는 수많은 화학물질 가운데 아래 같은 보충제를 섭취하면 줄기세포가 더 잘 기능하는 데 도움이 될 수 있는 것으로 나타났다.
- A, B3, C와 같은 비타민은 줄기세포 조작에서 비타민 의존 경로에 효과적인 표적이다. 특히 비타민C는 증식을 촉진해 골수줄기세포를 만들어 낸다. 비타민D는 배아줄기세포와 iPSC 활동을 자극해 분화시 줄기세포에 도움을 주고 배아 조혈모세포와 조혈모세포 생산, 인간 탯줄줄기세포 발달을 조절한다.[25][26]
- 글루코사민과 콘드로이틴은 증식 조직 라인의 적절한 조생제 성장을 촉진하여 줄기세포 기능을 향상시킨다.[27][28][4]
- 탄수화물과 설탕을 절단에 의한 혈당지수 및 칼로리 제한은 줄기세포 활동을 강화한다.[29][30] 미토콘드리아 수준에서 MSC의 산소 소비량을 증가시키고 노화 방지 능력을 보여줌으로써 혈당 지수가 낮은 것으로 제한되었을 때 MSC는 에너지를 보다 효율적으로 활용하며, MSC의 분화 능력은 영향을 받지 않는다.[31]
참조
- ^ Bellini, Elisa; Grieco, Michele; Raposio, Edoardo (10 December 2017). "The science behind autologous fat grafting". Annals of Medicine and Surgery. 24: 65–73. doi:10.1016/j.amsu.2017.11.001. PMC 5694962. PMID 29188051.
- ^ Rochette, Luc; Mazini, Loubna; Malka, Gabriel; Zeller, Marianne; Cottin, Yves; Vergely, Catherine (4 December 2020). "The Crosstalk of Adipose-Derived Stem Cells (ADSC), Oxidative Stress, and Inflammation in Protective and Adaptive Responses". International Journal of Molecular Sciences. 21 (23): 9262. doi:10.3390/ijms21239262. PMC 7730805. PMID 33291664.
- ^ a b Simonacci, F; Bertozzi, N; Grieco, MP; Grignaffini, E; Raposio, E (August 2017). "Procedure, applications, and outcomes of autologous fat grafting". Annals of Medicine and Surgery. 20: 49–60. doi:10.1016/j.amsu.2017.06.059. PMC 5491488. PMID 28702187.
- ^ a b Team, The Biotics Education. "7 Ways to Promote Stem Cell Proliferation". blog.bioticsresearch.com.
- ^ Evans, Gregory R. D.; Widgerow, Alan D. (30 May 2020). "Stem cells and tissue engineering in plastic surgery: an update". Plastic and Aesthetic Research. 7. doi:10.20517/2347-9264.2019.53. ISSN 2347-9264.
- ^ a b c d e Varghese, Jajini; Mosahebi, Afshin (1 July 2017). "Historical Overview of Stem Cell Biology and Fat Grafting". Aesthetic Surgery Journal. 37 (suppl_3): S1–S3. doi:10.1093/asj/sjw262. PMID 29025211.
- ^ Mazini, Loubna; Rochette, Luc; Amine, Mohamed; Malka, Gabriel (22 May 2019). "Regenerative Capacity of Adipose Derived Stem Cells (ADSCs), Comparison with Mesenchymal Stem Cells (MSCs)". International Journal of Molecular Sciences. 20 (10): 2523. doi:10.3390/ijms20102523. PMC 6566837. PMID 31121953.
- ^ Fang, Jun; Chen, Feng; Liu, Dong; Gu, Feiying; Wang, Yuezhen (6 January 2021). "Adipose tissue-derived stem cells in breast reconstruction: a brief review on biology and translation". Stem Cell Research & Therapy. 12 (1): 8. doi:10.1186/s13287-020-01955-6. PMC 7789635. PMID 33407902.
- ^ Zhao, Yong; Zhang, Haiyang (1 July 2016). "Update on the mechanisms of homing of adipose tissue-derived stem cells". Cytotherapy. 18 (7): 816–827. doi:10.1016/j.jcyt.2016.04.008. PMID 27260205.
- ^ Liesveld, Jane L.; Sharma, Naman; Aljitawi, Omar S. (2020). "Stem cell homing: From physiology to therapeutics". Stem Cells. 38 (10): 1241–1253. doi:10.1002/stem.3242. PMID 32526037.
- ^ Raposio, Edoardo; Simonacci, Francesco; Perrotta, Rosario E. (8 July 2017). "Adipose-derived stem cells: Comparison between two methods of isolation for clinical applications". Annals of Medicine and Surgery. 20: 87–91. doi:10.1016/j.amsu.2017.07.018. ISSN 2049-0801. PMC 5508488. PMID 28736612.
- ^ Glass, Graeme Ewan; Ferretti, Patrizia (14 March 2019). "Adipose-Derived Stem Cells in Aesthetic Surgery". Aesthetic Surgery Journal. 39 (4): 423–438. doi:10.1093/asj/sjy160. PMID 29982396.
- ^ Wang, Yu; Wu, Yanfei (19 October 2017). "Assessment of the clinical efficacy of cell-assisted lipotransfer and conventional fat graft: a meta-analysis based on case-control studies". Journal of Orthopaedic Surgery and Research. 12 (1): 155. doi:10.1186/s13018-017-0645-5. ISSN 1749-799X. PMC 5649090. PMID 29052508.
- ^ Mazini, Loubna; Ezzoubi, Mohamed; Malka, Gabriel (4 January 2021). "Overview of current adipose-derived stem cell (ADSCs) processing involved in therapeutic advancements: flow chart and regulation updates before and after COVID-19". Stem Cell Research & Therapy. 12 (1): 1. doi:10.1186/s13287-020-02006-w. PMC 7781178. PMID 33397467.
- ^ Alotaibi, Shaikha; Hamadani, Mehdi; Al-Mansour, Mubarak; Aljurf, Mahmoud (1 March 2021). "Breast Implant-associated Anaplastic Large Cell Lymphoma". Clinical Lymphoma, Myeloma & Leukemia. 21 (3): e272–e276. doi:10.1016/j.clml.2020.12.005. PMID 33384263.
- ^ Horton, Karen. "Why not augment the breasts with your own fat? A warning!". www.drkarenhorton.com. Dr Karen M. Horton.
- ^ Gornitsky, Jordan; Viezel-Mathieu, Alex; Alnaif, Nayif; Azzi, Alain; Gilardino, Mirko (1 March 2019). "A systematic review of the effectiveness and complications of fat grafting in the facial region". JPRAS Open. 19: 87–97. doi:10.1016/j.jpra.2018.12.004. ISSN 2352-5878. PMC 7061561. PMID 32158860.
- ^ O’Halloran, Niamh; Courtney, Donald; Kerin, Michael J; Lowery, Aoife J (1 January 2017). "Adipose-Derived Stem Cells in Novel Approaches to Breast Reconstruction: Their Suitability for Tissue Engineering and Oncological Safety". Breast Cancer: Basic and Clinical Research. 11: 117822341772677. doi:10.1177/1178223417726777. PMC 5562338. PMID 29104428.
- ^ Scioli, Maria Giovanna; Storti, Gabriele; D’Amico, Federico; Gentile, Pietro; Kim, Bong-Sung; Cervelli, Valerio; Orlandi, Augusto (4 July 2019). "Adipose-Derived Stem Cells in Cancer Progression: New Perspectives and Opportunities". International Journal of Molecular Sciences. 20 (13): 3296. doi:10.3390/ijms20133296. PMC 6651808. PMID 31277510.
- ^ The American Society of Plastic Surgeons. "Joint ASPS & ASAPS Position Statement: Stem Cells and Fat Grafting" (PDF). Plastic surgery.
- ^ McArdle, Adrian; Senarath-Yapa, Kshemendra; Walmsley, Graham G.; Hu, Michael; Atashroo, David A.; Tevlin, Ruth; Zielins, Elizabeth; Gurtner, Geoffrey C.; Wan, Derrick C.; Longaker, Michael T. (2014). "The Role of Stem Cells in Aesthetic Surgery: Fact or Fiction?". Plastic and Reconstructive Surgery. 134 (2): 193–200. doi:10.1097/PRS.0000000000000404. ISSN 0032-1052. PMC 4447486. PMID 24732654.
- ^ a b Kim, Kyung Ae (1 November 2019). "연평균 17% 성장한다는데…'줄기세포' 연구 홀대?". 히트뉴스 (in Korean). HitNews.
- ^ a b "생명공학정책연구센터". www.bioin.or.kr.
- ^ Chung, Sim Kyo (December 29, 2020). "밋밋한 가슴의 유학생, 줄기세포 가슴 성형 위해 귀국한 이유는 :: 중앙일보헬스미디어". jhealthmedia.joins.com.
- ^ Godoy-Parejo, Carlos; Deng, Chunhao; Zhang, Yumeng; Liu, Weiwei; Chen, Guokai (May 2020). "Roles of vitamins in stem cells". Cellular and Molecular Life Sciences. 77 (9): 1771–1791. doi:10.1007/s00018-019-03352-6. PMID 31676963. S2CID 207828217.
- ^ Cortes, Mauricio; Chen, Michael; Stachura, David; Liu, Sarah; Kwan, Wanda; Wright, Francis; Vo, Linda; Theodore, Lindsay; Esain, Virginie; Frost, Isaura; Schlaeger, Thorsten; Goessling, Wolfram; Daley, George; North, Trista (4 October 2016). "Developmental Vitamin D Availability Impacts Hematopoietic Stem Cell Production". Cell Reports. 17 (2): 458–468. doi:10.1016/j.celrep.2016.09.012. ISSN 2211-1247. PMC 5338633. PMID 27705794.
- ^ Jung, Jin Hyuk; Iwabuchi, Kumiko; Yang, Zhihong; Loeken, Mary R. (17 June 2016). "Embryonic Stem Cell Proliferation Stimulated By Altered Anabolic Metabolism From Glucose Transporter 2-Transported Glucosamine". Scientific Reports. 6 (1): 28452. Bibcode:2016NatSR...628452J. doi:10.1038/srep28452. PMC 4911601. PMID 27311888.
- ^ Mehrabani, D; Mojtahed Jaberi, F; Zakerinia, M; Hadianfard, MJ; Jalli, R; Tanideh, N; Zare, S (May 2016). "The Healing Effect of Bone Marrow-Derived Stem Cells in Knee Osteoarthritis: A Case Report". World Journal of Plastic Surgery. 5 (2): 168–74. PMC 5003953. PMID 27579273.
- ^ "Diet & Blood Sugar Levels The Effect on Stem Cells". Regen America. 2 January 2018.
- ^ He, Jingjing; Kong, Desheng; Yang, Zhifen; Guo, Ruiyun; Amponsah, Asiamah Ernest; Feng, Baofeng; Zhang, Xiaolin; Zhang, Wei; Liu, Aijing; Ma, Jun; O’Brien, Timothy; Cui, Huixian (11 March 2021). "Clinical efficacy on glycemic control and safety of mesenchymal stem cells in patients with diabetes mellitus: Systematic review and meta-analysis of RCT data". PLOS ONE. 16 (3): e0247662. Bibcode:2021PLoSO..1647662H. doi:10.1371/journal.pone.0247662. ISSN 1932-6203. PMC 7951834. PMID 33705413.
- ^ Lo, Ting; Ho, Jennifer H.; Yang, Muh-Hwa; Lee, Oscar K. (1 July 2011). "Glucose Reduction Prevents Replicative Senescence and Increases Mitochondrial Respiration in Human Mesenchymal Stem Cells". Cell Transplantation. 20 (6): 813–826. doi:10.3727/096368910X539100. ISSN 1555-3892. PMID 21054932. S2CID 30722685.
이 글은 추가 또는 더 구체적인 범주가 필요하다. (2021년 9월) |