펩타이드 합성
Peptide synthesis유기 화학에서 펩타이드 합성은 펩타이드 결합으로도 알려진 아미드 결합을 통해 여러 아미노산이 연결된 화합물인 펩타이드의 생산이다.한 아미노산의 카르복실기와 다른 아미노기의 축합반응에 의해 펩타이드가 화학적으로 합성된다.다양한 아미노산 측쇄에 [1]대한 바람직하지 않은 부작용을 방지하기 위해 일반적으로 그룹 보호 전략이 필요합니다.화학적 펩타이드 합성은 가장 일반적으로 펩타이드(C-terminus)의 카르복실 말단에서 시작하여 아미노 말단(N-terminus)[2]으로 진행됩니다.생물에서 단백질 생합성(긴 펩타이드)은 반대 방향으로 일어난다.
펩타이드의 화학적 합성은 대부분의 연구 및 개발 환경에서 고체상 방법([3]아래 참조)으로 대체되었지만 고전적인 용액상 기법을 사용하여 수행할 수 있다.그러나 용액상 합성은 산업용 펩타이드의 대규모 생산에서 그 유용성을 유지한다.
화학 합성은 박테리아에서 발현하기 어려운 펩타이드의 생산, 부자연스러운 아미노산의 결합, 펩타이드/단백질 골격 변형 및 D-아미노산으로 구성된 D-단백질의 합성을 촉진한다.
고체 합성
연구실에서 합성 펩타이드를 생산하기 위한 확립된 방법은 고체상 펩타이드 합성(SPPS)[2]으로 알려져 있다.로버트 브루스 [4][5]메리필드가 개발한 SPPS는 불용성 다공질 지지체에 아미노산 유도체를 연속적으로 반응시켜 펩타이드 사슬을 빠르게 조립할 수 있도록 한다.
고체 서포트는 초기 펩타이드 [2]체인에 연결되는 반응기(아민 또는 하이드록실기 등)로 기능하는 작고 고분자 수지 비즈로 구성됩니다.펩타이드는 합성 내내 지지체에 공유적으로 부착되어 있기 때문에 세척 및 여과로 여분의 시약 및 부가물을 제거할 수 있다.이 접근방식은 각 반응 단계 후에 제품 펩타이드가 용액에서 비교적 시간이 오래 걸리는 분리를 회피하는데, 이는 기존의 용액-상 합성을 사용할 때 필요할 것이다.
펩타이드 사슬 N 말단에 결합되는 각 아미노산은 측쇄 및 사용된 보호 전략에 따라 Boc(산-라벨) 또는 Fmoc(염기-라벨)와 같은 적절한 보호기를 사용하여 N 말단과 측쇄에서 보호되어야 한다(아래 [1]참조).
일반적인 SPPS 절차는 N 단자 보호 해제 및 커플링 반응의 반복 주기 중 하나입니다.각 단계 사이에 [2]수지를 세척할 수 있습니다.우선 수지에 아미노산을 결합한다.이어서 아민을 탈보호시킨 후 제2아미노산의 유리산과 결합시킨다.이 주기는 원하는 시퀀스가 합성될 때까지 반복됩니다.SPPS 사이클은 또한 반응하지 않은 아미노산의 끝을 차단하는 캡핑 단계를 포함할 수 있다.합성 종료 시 조펩타이드를 고체 지지체로부터 분리함과 동시에 트리플루오로아세트산이나 [2]친핵산 등의 시약 강산을 사용하여 모든 보호기를 제거한다.조펩타이드는 디에틸에테르와 같은 비극성 용매에서 침전되어 제품에 의해 유기적으로 용해되는 것을 제거할 수 있다.조펩타이드는 역상 HPLC를 [6][7]이용하여 정제할 수 있다.제품과 매우 유사한 소량의 부산물을 제거해야 하기 때문에 특히 더 긴 펩타이드의 정제 과정은 어려울 수 있다.이러한 이유로 MCSGP와 같은 이른바 연속 크로마토그래피 프로세스가 순도 [8]수준을 희생하지 않고 수율을 극대화하기 위해 상용 환경에서 점점 더 많이 사용되고 있습니다.
SPPS는 반응 수율에 의해 제한되며, 전형적으로 70개의 아미노산 범위의 펩타이드와 단백질은 합성 [2]접근성의 한계를 높이고 있다.합성 난이도 또한 배열에 의존하며, 전형적으로 아밀로이드와[9] 같은 집합하기 쉬운 배열은 만들기 어렵다.더 긴 길이는 토종 화학 결찰과 같은 결찰 방법을 사용하여 접근할 수 있으며, 여기에서 두 개의 짧은 완전 방호 합성 펩타이드가 용액에 결합될 수 있다.
펩타이드 결합 시약
SPPS의 광범위한 적용을 가능하게 한 중요한 기능은 커플링 [2]스텝에서 매우 높은 수율을 발생시키는 것입니다.매우 효율적인 아미드 결합 형성 조건이 필요합니다.[10][11][12]각 아미노산의 과잉(2배에서 10배 사이)을 첨가한다.결합 중 아미노산 라세미화를 최소화하는 것도 최종 펩타이드 제품에서 에피머화를 방지하기 위해 매우 중요하다.
아민과 카르본산 사이의 아미드 결합 형성은 느리므로 일반적으로 '커플링 시약' 또는 '활성제'가 필요하다.다양한 커플링 시약이 존재하는데, 이는 부분적으로 특정 [13][14]커플링에 대한 다양한 효과로 인해 이러한 시약 중 많은 수가 시중에 판매되고 있습니다.
카르보디이미데스
디시클로헥실카르보디이미드(DCC)나 디이소프로필카르보디이미드(DIC) 등의 카르보디이미드가 아미드 결합 [12]형성에 자주 사용된다.이 반응은 반응성이 높은 O-아실리소요소의 형성을 통해 진행된다.이 반응성 중간체는 펩타이드 N-말단 아민에 의해 공격되어 펩타이드 결합을 형성한다.O-아실 [15]이소요소의 형성은 디클로로메탄과 같은 비극성 용매에서 가장 빠르게 진행됩니다.
DIC는 액체로서 쉽게 배출되고 요소 부산물이 쉽게 씻겨 나가므로 SPPS에 특히 유용합니다.이와 반대로 관련된 카르보디이미드 1-에틸-3-(3-디메틸아미노프로필) 카르보디이미드(EDC)는 [12]수성작업 중에 요소부생물을 제거할 수 있기 때문에 용액상 펩타이드 커플링에 자주 사용된다.
카르보디이미드 활성화는 활성 아미노산의 [12]라세미화 가능성을 열어준다.트리아졸 1-히드록시-벤조트리아졸(HObt) 및 1-히드록시-7-아자-벤조트리아졸(HOAt) 등의 '레이스화 억제' 첨가물에 의해 레이스화를 회피할 수 있다.이러한 시약들은 활성 에스테르를 형성하기 위해 O-acylisoulea 중간체를 공격하고, 활성 에스테르와 반응하여 원하는 펩타이드 [16]결합을 형성한다.카르보디이미드 결합용 첨가물인 에틸시아노히드록시이미노아세트산(Oxyma)은 [17]HOAt의 대안으로 작용한다.
아미늄/우로늄 및 포스포늄염
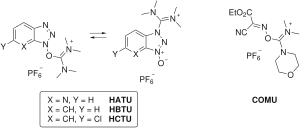
일부 결합시약은 카르보디이미드를 완전히 생략하고 비핵성 음이온(테트라플루오로베이트 또는 헥사플루오로인산)[11]의 아미노늄/우로늄 또는 포스포늄염으로서 HOAt/HOBt 부분을 함유시킨다.아미노/우로늄 시약의 예로는 HATU(HOAt), HBTU/TBTU(HObt) 및 HCTU(6-ClHObt)가 있다.HBTU와 TBTU는 음이온을 선택할 때만 다릅니다.포스포늄 시약에는 PyBOP(HOBt)와 PyAOP(HOAt)가 있다.
이들 시약은 카르보디이미드 활성화 조건과 동일한 활성 에스테르종을 형성하지만 결합 [18]시약의 탄소 골격 특성에 따라 결정되는 초기 활성화 단계의 속도가 다르다.또한 아미노/우로늄 시약은 펩타이드 N-말단과 반응하여 불활성 구아니디노 부산물을 형성할 수 있지만 포스포늄 시약은 그렇지 않다.
프로파네포스폰산무수물
2000년대 후반부터 "T3P"와 같은 다양한 이름으로 시판되는 프로파네포스폰산 무수물은 상업적인 용도로 아미드 결합 형성에 유용한 시약이 되었다.그것은 카르본산의 산소를 이탈기로 전환시키고, 펩타이드 결합 부산물은 수용성이며 쉽게 씻어낼 수 있다.비아펩타이드제 제조를 위한 프로판포스폰산 무수물과 다른 펩타이드 결합 시약과의 성능 비교에서 이 시약은 수율 및 낮은 에피머화 [19]측면에서 다른 시약보다 우수함을 발견했다.
견고한 서포트
펩타이드 합성을 위한 고체 서포트는 물리적인 안정성을 위해 선택되며 액체의 신속한 여과가 가능하다.적절한 지지대는 SPPS 중에 사용되는 시약 및 용제에 대해 불활성화되지만 시약 침투 및 첫 번째 아미노산 [20]부착을 위해 사용되는 용제에서 팽창해야 합니다.
솔리드 서포트의 주요 유형은 젤 타입 서포트, 표면 타입 서포트 및 [20]컴포지트입니다.펩타이드 합성에 사용되는 고체 서포트에 대한 개선은 SPPS의 [21]탈보호 단계 동안 TFA의 반복적인 사용을 견딜 수 있는 능력을 향상시킨다.C 말단 카르본산 또는 아미드 중 어느 쪽이 바람직한지에 따라 2개의 1차 수지가 사용된다.Wang 수지는 1996년 현재[update] C 말단 카르본산과 [22][needs update]함께 펩타이드에 가장 일반적으로 사용되는 수지였다.
그룹 구성표 보호
이 섹션은 확인을 위해 추가 인용문이 필요합니다.(2017년 6월 (이 및 ) |
위와 같이 펩타이드 합성 시 활성 아미노산의 자가 결합([1]중합)과 같은 바람직하지 않은 부작용을 피하기 위해 N-말단 및 측쇄 보호기를 사용하는 것이 필수적이다.이는 의도된 펩타이드 결합 반응과 경쟁하여 수율이 낮거나 심지어 원하는 펩타이드를 합성하는 데 완전히 실패할 수 있다.
고체상 펩타이드 합성에 사용하기 위한 두 가지 기본 직교 보호기 스킴, 이른바 Boc/Bzl [2]및 Fmoc/tBu 접근법이 존재한다.Boc/Bzl 전략은 TFA-labil N-말단 Boc 보호와 함께 측면 사슬 보호를 활용하며, 측면 사슬 보호는 최종 분할 단계(고체 지지대에서 펩타이드를 동시에 분할함)에서 무수 불화수소를 사용하여 제거된다.Fmoc/tBu SPPS는 사이드 체인 보호 및 산-가연성 수지 링크와 함께 베이스-가연성 Fmoc N-말단 보호를 사용합니다(최종 산성 분할은 TFA 처리를 통해 수행됨).
각각의 장점과 단점을 포함한 두 가지 접근법에 대해 아래에 자세히 설명합니다.
Boc/Bzl SPPS
SPSS가 등장하기 이전의 펩타이드 합성 방법은 일시적인 N 말단 α-아미노 보호기로서 tert-부틸록시카르보닐(약칭 'Boc')에 의존했다.Boc기는 트리플루오로아세트산(TFA)과 같은 산과 함께 제거된다.이는 과잉 TFA(오른쪽 이미지에서 아미노기가 양성화되지 않음)가 존재하는 상태에서 양전하 아미노기를 형성하며, 아미노기는 중화되어 유입되는 활성 아미노산과 [23]결합됩니다.중성화는 결합 전 또는 기본 결합 반응 중에 발생할 수 있습니다.
Boc/Bzl 접근법은 합성 [24]중 펩타이드 응집 감소에 대한 유용성을 유지한다.또한 Fmoc 탈보호 단계(아래 참조)에서 염기를 이용한 처리가 필요하므로 염기 감수성 부분(예: 펩타이드)을 포함하는 펩타이드를 합성할 때 Fmoc/tBu 접근법보다 Boc/Bzl SPPS가 선호될 수 있다.
Boc/Bzl SPPS 동안 사용되는 영구 사이드 체인 보호 그룹은 일반적으로 벤질 또는 벤질 기반 [1]그룹입니다.고체 지지체로부터의 펩타이드의 최종 제거는 가수분해분할을 통해 무수불화수소를 사용하는 측쇄 탈보호와 동시에 이루어진다.최종 산물은 비교적 가용화하기 쉬운 불소염이다.반응성 T-부틸 양이온이 원치 않는 제품을 생성하지 않도록 하려면 크레졸과 같은 청소제를 HF에 추가해야 합니다.이 접근법의 단점은 플루오르화수소에 의한 펩타이드의 분해 가능성이다.
Fmoc/tBu SPPS
질소 말단 Fmoc 보호의 사용은 순한 deprotection 계획보다는 Boc/Bzl SPPS를 위해 사용되는, 그리고 이 보호 계획 정말 SPPS 조건에서 직교가 있다.Fmoc deprotection DMF.[20]에 있는 기지, 일반적으로 20–50%피페리딘을 이용한다.그 노출된 아민 따라서 결국 peptide-resin의 중립화가 필요한 경우 Boc/Bzl 접근법의 경우와 마찬가지로 중립적 입장이다.는 펩티드 사슬 사이에 정전 반발의 부족 통합 Fmoc/tBu SPPS과 위험 하지만으로 이어질 수 있다.왜냐하면 해방fluorenyl단이 발색단, Fmoc deprotection는 반작용 혼합의 UV흡광도, 자동화된 펩티드 신디사이저에 종사하고 있는 전략에 의해 감시할 수 있다.
그 Fmoc 그룹의 능력을 확보하는 산성에 안정적인 상대적으로 가벼운 기본적인 조건에서 cleaved 곁 사슬 보크와 tBu 같은 보다 부드러운 산성으로 최종 분할 조건에서(TFA)그 최종 분열에 Boc/Bzl SPPS(HF)에 사용되는 것보다 제거될 수 있는 단체들을 보호하는 것의 사용만을 허용한다.위해 반응성 양이온성 종들 곁 사슬 deprotection의 결과로 발표와 쪽 반응을 막기 위해 물과 triisopropylsilane(TIPS) 같은 Scavengers 최종 분열 동안 추가됩니다.그 결과 원유 펩티드가 어쩌면 더 용해도를 높이다에 불소염 보크 SPPS에 비해 어려운 TFA 소금,로 얻어진 것이다.
로fluorenyl 그룹이 보크 그룹보다 크다 Fmoc/tBu SPPS 덜,atom-economical 있다.하나 나올 때까지 첫번째 합성 펩티드 마약, enfuvirtide의 대규모 조종은 1990년대 시장 수요 Fmoc- vs Boc- 아미노산의 상대적인 가격 조정에 시작했다 이에 따라 Fmoc 아미노산들 가격 높았다.
기타 보호 그룹
벤질록시카르보닐
그(Z)그룹은 또 다른carbamate-type한 아민을 보호하는 그룹, 레오니다스 Zervas에 의해 1930년대 초와 보통 벤질 클로르 의산에 반응을 통해에서 추가 발견했다.[26]
아세트산에 HBr을 사용하는 가혹한 조건이나 촉매 수소화의 가벼운 조건 하에서 제거됩니다.
이 방법론은 1932년 [27]Zervas와 Max Bergmann에 의해 올리고펩타이드의 합성에 처음 사용되었다.따라서, 이것은 "에폭 제조"로 특징지어지고 합성 펩타이드 화학을 별개의 [26]분야로 확립하는 데 도움을 준 베르그만-제르바 합성이라고 알려지게 되었다.이는 제어된 펩타이드 합성을 위한 최초의 유용한 실험실 방법을 구성하였으며, 반응성 측쇄를 통해 이전에는 얻을 수 없었던 펩타이드 합성을 가능하게 했으며, Z-보호 아미노산도 라세미화 과정을 [26][27]거치는 것을 방지하였다.
Bergmann-Zervas 방법의 사용은 출판 [26]후 20년 동안 펩타이드 화학의 표준 관행으로 유지되었으며, 1950년대 초 새로운 방법(예: Boc 보호 그룹)으로 대체되었다.최근에는 α-아민 보호를 위해 주기적으로 사용되어 왔지만, 사이드 체인 보호를 위해 훨씬 더 일반적으로 사용되고 있습니다.
할당 및 기타 그룹
알록시카르보닐(Alloc) 보호기는 직교 탈보호 방식이 필요할 때 아미노기(또는 카르본산 또는 알코올기)를 보호하기 위해 사용되기도 한다.또한 측쇄 관능기에 의해 펩타이드가 수지에 결합되는 온레진 고리형 펩타이드를 형성할 때도 사용된다.Alloc 그룹은 테트라키스(트리페닐포스핀) 팔라듐(0)[28]을 사용하여 제거할 수 있습니다.
단백질 마이크로어레이를 수반하는 합성 공정과 같은 특수한 용도에서는, 「라이토그래피」라고 불리는 보호 그룹이 사용됩니다.이 보호 그룹은 특정 파장의 빛에서 광화학에 대응할 수 있기 때문에, 리소그래피 타입의 [29][30][31][32]작업 중에 제거할 수 있습니다.
위치선택적 디술피드결합형성
다중 네이티브 이황화물의 형성은 고체상 방법에 의한 네이티브 펩타이드 합성에 있어 여전히 어려운 과제이다.랜덤 체인 조합은 일반적으로 비원어민 디술피드 [33]결합을 가진 여러 제품을 생성한다.디술피드 결합의 단계적 형성은 일반적으로 바람직한 방법이며 티올 보호기를 [34]사용하여 수행된다.서로 다른 티올 보호 그룹은 직교 보호의 여러 차원을 제공합니다.이러한 직교로 보호되는 시스테인은 펩타이드의 고체상 합성 중에 통합됩니다.유리 티올기의 선택적 노출을 허용하기 위해 이러한 그룹의 연속적인 제거는 단계적 방법으로 디술피드 형성을 유도한다.한 번에 하나의 그룹만 삭제되도록 그룹의 삭제 순서를 고려해야 합니다.
나중에 위치선택적 디술피드 결합 형성을 필요로 하는 펩타이드 합성에 사용되는 티올 보호기는 여러 [35][36]특성을 가져야 한다.첫째, 보호되지 않은 사이드 체인에 영향을 주지 않는 조건에서 가역성이 있어야 합니다.둘째, 보호군은 고체상 합성 조건을 견딜 수 있어야 한다.셋째, 직교 보호가 필요한 경우 티올 보호 그룹의 제거는 다른 티올 보호 그룹을 그대로 유지하도록 해야 한다.즉, PG A의 제거가 PG B에 영향을 미치지 않아야 한다. 일반적으로 사용되는 티올 보호 그룹에는 아세트아미도메틸(Acm), 테르트-부틸(But), 3-니트로-2-피리딘 술페닐(NPYS), 2-피리딘-술페닐(Pyrine-Sulfenyl)[35] 및 트리티(T) 그룹이 포함된다.중요한 것은 NPYS기가 Acm PG를 대체하여 활성화된 티올을 [37]생성할 수 있다는 것이다.
이 방법을 사용하여 [38]키소와 동료들은 1993년에 인슐린의 첫 번째 총합성을 보고했다.본 연구에서 인슐린의 A-사슬은 시스테인에 다음과 같은 보호군과 함께 준비되었다.CysA6(But), CysA7(Acm) 및 CysA11(But)은 CysA20을 [38]보호하지 않습니다.
마이크로파지원펩티드합성
마이크로파 지원 펩타이드 합성은 높은 수율 및 낮은 라세미화의 [39][40]긴 펩타이드 배열을 완성하기 위해 사용되어 왔다.
긴 펩타이드 합성
아미노산을 단계적으로 연결하는 단계적 연장은 아미노산 잔기를 2~100개 함유하는 작은 펩타이드에 이상적이다.또 다른 방법은 펩타이드 조각이 결합되는 단편 응축이다.전자는 라세미화 없이 펩타이드 사슬을 연장할 수 있지만, 긴 펩타이드 또는 극성이 높은 펩타이드 생성에만 사용되면 수율이 감소한다.단편 축합은 정교한 긴 펩타이드를 합성하는 단계적 신장보다 낫지만, 라세미화를 방지하기 위해 사용을 제한해야 한다.또한 결합된 단편은 총 초과여야 하며, 이는 단편 [41]길이에 따라 제한될 수 있기 때문에 단편 응축도 바람직하지 않습니다.
더 긴 펩타이드 사슬을 생산하기 위한 새로운 개발은 화학적 결찰이다: 보호되지 않은 펩타이드 사슬은 수용액에서 화학적으로 선택적으로 반응한다.동태적으로 제어된 제1제품은 아미드 결합을 형성하기 위해 정렬된다.토종 화학 결찰의 가장 일반적인 형태는 말단 시스테인 [42]잔기와 반응하는 펩타이드 티오에스테르를 사용한다.
수용액 중 폴리펩타이드 공유결합에 적용할 수 있는 다른 방법으로는 분할내부,[43] 자발적 이소펩타이드 결합형성[44] 및 소르테아제 [45]결찰이 있다.
긴 펩타이드 합성을 최적화하기 위해 메디콘 밸리에서 펩타이드 [citation needed]배열을 변환하는 방법이 개발되었다.알파 나선 구조를 유도하기 위해 펩타이드의 C 말단에 통합된 단순 전순서(예: Lysine(Lysn), Glutamic Acid(Glun), (LysGlu)n)이다.이는 잠재적으로 생물학적 반감기를 증가시키고, 펩타이드 안정성을 향상시키며, 약리학적 활성이나 [46][47]작용 프로파일을 변경하지 않고도 효소적 분해를 억제할 수 있다.
고리형 펩타이드
수지 사이클라이제이션에 대하여
펩타이드는 고체 지지대 위에서 환화될 수 있다.HBTU/HOBt/DIEA, PyBop/DIEA, PyClock/DIEA [48]등 다양한 사이클화 시약을 사용할 수 있습니다.고체 지지대 위에 머리-꼬리 펩타이드를 만들 수 있다.적절한 지점에서 C-말단을 탈보호함으로써 탈보호된 N-말단과의 아미드 결합 형성에 의한 온레진 환화를 가능하게 한다.일단 환화가 이루어지면, 펩타이드는 산분해로 수지로부터 분해되고 [citation needed]정제된다.
고리형 펩타이드의 고체상 합성을 위한 전략은 Asp, Glu 또는 Lys 측쇄를 통한 부착에 국한되지 않는다.시스테인은 측쇄에 매우 반응적인 술프하이드릴기를 가지고 있다.한 시스테인으로부터의 황 원자가 단백질의 다른 부분의 제2 시스테인으로부터의 다른 황 원자와 단일 공유 결합을 형성할 때 디술피드 브릿지가 생성된다.이 다리들은 단백질, 특히 세포에서 분비되는 단백질을 안정시키는데 도움을 준다.일부 연구자들은 S-아세토미도메틸(Acm)을 사용하여 변형된 시스테인을 사용하여 디술피드 결합의 형성을 차단하지만 시스테인과 단백질의 원래 1차 [49]구조를 보존합니다.
오프레진 사이클라이제
오프레진환화는 주요 중간체의 고체상 합성이며, 이어서 용액상의 키환화이며, 마스크된 측쇄의 최종적인 탈보호도 용액상에서 이루어진다.이는 용액상 단계에서 고체상 합성의 효율이 상실되고, 부산물, 시약 및 비변환 물질로부터의 정화가 필요하며, 매크로사이클 형성이 [50]수반될 경우 바람직하지 않은 올리고머가 형성될 수 있다는 단점이 있다.
펜타플루오로페닐에스테르(FDPP,[51] PFPOH[52]) 및 BOP-Cl의[53] 사용은 펩타이드를 고리화하는데 유용하다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d Isidro-Llobet A, Alvarez M, Albericio F (June 2009). "Amino acid-protecting groups". Chemical Reviews. 109 (6): 2455–2504. doi:10.1021/cr800323s. hdl:2445/69570. PMID 19364121.
- ^ a b c d e f g h Chan WC, White PD (2000). Fmoc Solid Phase Peptide Synthesis: A Practical Approach. Oxford, UK: OUP. ISBN 978-0-19-963724-9.
- ^ Jaradat DM (January 2018). "Thirteen decades of peptide synthesis: key developments in solid phase peptide synthesis and amide bond formation utilized in peptide ligation". Amino Acids. 50 (1): 39–68. doi:10.1007/s00726-017-2516-0. PMID 29185032. S2CID 3680612.
- ^ Merrifield RB (1963). "Solid Phase Peptide Synthesis. I. The Synthesis of a Tetrapeptide". J. Am. Chem. Soc. 85 (14): 2149–2154. doi:10.1021/ja00897a025.
- ^ Mitchell AR (2008). "Bruce Merrifield and solid-phase peptide synthesis: a historical assessment". Biopolymers. 90 (3): 175–184. doi:10.1002/bip.20925. PMID 18213693. S2CID 30382016.
- ^ Mant CT, Chen Y, Yan Z, Popa TV, Kovacs JM, Mills JB, et al. (2007). "HPLC analysis and purification of peptides". Peptide Characterization and Application Protocols. Methods in Molecular Biology. Vol. 386. Humana Press. pp. 3–55. doi:10.1007/978-1-59745-430-8_1. ISBN 978-1-59745-430-8. PMC 7119934. PMID 18604941.
- ^ "Custom peptide synthesis service. HPLC refers to High Performance Liquid Chromatography". Remetide Biotech. November 2021.
- ^ Lundemann-Hombourger O (May 2013). "The ideal peptide plant" (PDF). Speciality Chemicals Magazine: 30–33.
- ^ Tickler AK, Clippingdale AB, Wade JD (August 2004). "Amyloid-beta as a "difficult sequence" in solid phase peptide synthesis". Protein and Peptide Letters. 11 (4): 377–384. doi:10.2174/0929866043406986. PMID 15327371.
- ^ 주어진 합성에 대한 차선의 커플링 수율의 영향을 설명하기 위해, 각 커플링 단계가 최소 99%의 수율을 가져야 하는 경우를 고려하자. 이는 26-아미노산 펩타이드(각 탈보호에서 100% 수율 가정)의 전체 조수율 77%를 산출한다. 각 커플링이 95% 효율적이라면 전체 수율은 25%가 될 것이다.
- ^ a b El-Faham A, Albericio F (November 2011). "Peptide coupling reagents, more than a letter soup". Chemical Reviews. 111 (11): 6557–6602. doi:10.1021/cr100048w. PMID 21866984.
- ^ a b c d e Montalbetti CA, Falque V (2005). "Amide bond formation and peptide coupling". Tetrahedron. 61 (46): 10827–10852. doi:10.1016/j.tet.2005.08.031.
- ^ Valeur E, Bradley M (February 2009). "Amide bond formation: beyond the myth of coupling reagents". Chemical Society Reviews. 38 (2): 606–631. doi:10.1039/B701677H. PMID 19169468.
- ^ El-Faham A, Albericio F (November 2011). "Peptide coupling reagents, more than a letter soup". Chemical Reviews. 111 (11): 6557–6602. doi:10.1021/cr100048w. PMID 21866984.
- ^ Singh S (January 2018). "CarboMAX - Enhanced Peptide Coupling at Elevated Temperatures" (PDF). AP Note. 0124: 1–5.
- ^ Joullié MM, Lassen KM (2010). "Evolution of Amide Bond Formation". Arkivoc. viii (8): 189–250. doi:10.3998/ark.5550190.0011.816.
- ^ Subirós-Funosas R, Prohens R, Barbas R, El-Faham A, Albericio F (September 2009). "Oxyma: an efficient additive for peptide synthesis to replace the benzotriazole-based HOBt and HOAt with a lower risk of explosion". Chemistry. 15 (37): 9394–9403. doi:10.1002/chem.200900614. PMID 19575348.
- ^ Albericio F, Bofill JM, El-Faham A, Kates SA (1998). "Use of Onium Salt-Based Coupling Reagents in Peptide Synthesis". J. Org. Chem. 63 (26): 9678–9683. doi:10.1021/jo980807y.
- ^ J. 히블 외 연구진, J. 펩트규정 (1999), 54, 54
- ^ a b c Albericio F (2000). Solid-Phase Synthesis: A Practical Guide (1 ed.). Boca Raton: CRC Press. p. 848. ISBN 978-0-8247-0359-2.
- ^ Feinberg RS, Merrifield RB (1974). "Zinc chloride-catalyzed chloromethylation of resins for solid phase peptide synthesis". Tetrahedron. 30 (17): 3209–3212. doi:10.1016/S0040-4020(01)97575-1.
- ^ Hermkens PH, Ottenheijm HC, Rees DC (1997). "Solid-phase organic reactions II: A review of the literature Nov 95 – Nov 96". Tetrahedron. 53 (16): 5643–5678. doi:10.1016/S0040-4020(97)00279-2.
- ^ Schnolzer MA, Jones A, Alewood D, Kent SB (2007). "In Situ Neutralization in Boc-chemistry Solid Phase Peptide Synthesis". Int. J. Peptide Res. Therap. 13 (1–2): 31–44. doi:10.1007/s10989-006-9059-7. S2CID 28922643.
- ^ Beyermann M, Bienert M (1992). "Synthesis of difficult peptide sequences: A comparison of Fmoc-and BOC-technique". Tetrahedron Letters. 33 (26): 3745–3748. doi:10.1016/0040-4039(92)80014-B.
- ^ Jones J (1992). Amino Acid and Peptide Synthesis. Oxford, UK: Oxford University Press.
- ^ a b c d Katsoyannis PG, ed. (1973). The Chemistry of Polypeptides. New York: Plenum Press. doi:10.1007/978-1-4613-4571-8. ISBN 978-1-4613-4571-8. S2CID 35144893.
- ^ a b Bergmann M, Zervas L (1932). "Über ein allgemeines Verfahren der Peptid-Synthese". Berichte der deutschen chemischen Gesellschaft. 65 (7): 1192–1201. doi:10.1002/cber.19320650722.
- ^ Thieriet N, Alsina J, Giralt E, Guibé F, Albericio F (1997). "Use of Alloc-amino acids in solid-phase peptide synthesis. Tandem deprotection-coupling reactions using neutral conditions". Tetrahedron Letters. 38 (41): 7275–7278. doi:10.1016/S0040-4039(97)01690-0.
- ^ Shin DS, Kim DH, Chung WJ, Lee YS (September 2005). "Combinatorial solid phase peptide synthesis and bioassays". Journal of Biochemistry and Molecular Biology. 38 (5): 517–525. doi:10.5483/BMBRep.2005.38.5.517. PMID 16202229.
- ^ Price JV, Tangsombatvisit S, Xu G, Yu J, Levy D, Baechler EC, et al. (September 2012). "On silico peptide microarrays for high-resolution mapping of antibody epitopes and diverse protein-protein interactions". Nature Medicine. 18 (9): 1434–1440. doi:10.1038/nm.2913. PMC 3491111. PMID 22902875.
- ^ Hedberg-Dirk EL, Martinez UA (8 August 2010). "Large-Scale Protein Arrays Generated with Interferometric Lithography for Spatial Control of Cell-Material Interactions". Journal of Nanomaterials. 2010: e176750. doi:10.1155/2010/176750. ISSN 1687-4110.
- ^ Fodor SP, Read JL, Pirrung MC, Stryer L, Lu AT, Solas D (February 1991). "Light-directed, spatially addressable parallel chemical synthesis". Science. 251 (4995): 767–773. Bibcode:1991Sci...251..767F. doi:10.1126/science.1990438. PMID 1990438.
- ^ Tam JP, Wu CR, Liu W, Zhang JW (1991). "Disulfide bond formation in peptides by dimethyl sulfoxide. Scope and applications". J. Am. Chem. Soc. 113 (17): 6657–6662. doi:10.1021/ja00017a044.
- ^ Sieber P, Kamber B, Hartmann A, Jöhl A, Riniker B, Rittel W (January 1977). "[Total synthesis of human insulin. IV. Description of the final steps (author's transl)]". Helvetica Chimica Acta. 60 (1): 27–37. doi:10.1002/hlca.19770600105. PMID 838597.
- ^ a b Spears RJ, McMahon C, Chudasama V (October 2021). "Cysteine protecting groups: applications in peptide and protein science". Chemical Society Reviews. 50 (19): 11098–11155. doi:10.1039/D1CS00271F. PMID 34605832. S2CID 238258277.
- ^ Laps S, Atamleh F, Kamnesky G, Sun H, Brik A (February 2021). "General synthetic strategy for regioselective ultrafast formation of disulfide bonds in peptides and proteins". Nature Communications. 12 (1): 870. Bibcode:2021NatCo..12..870L. doi:10.1038/s41467-021-21209-0. PMC 7870662. PMID 33558523.
- ^ Ottl J, Battistuta R, Pieper M, Tschesche H, Bode W, Kühn K, Moroder L (November 1996). "Design and synthesis of heterotrimeric collagen peptides with a built-in cystine-knot. Models for collagen catabolism by matrix-metalloproteases". FEBS Letters. 398 (1): 31–36. doi:10.1016/S0014-5793(96)01212-4. PMID 8946948. S2CID 24688988.
- ^ a b Akaji K, Fujino K, Tatsumi T, Kiso Y (1993). "Total synthesis of human insulin by regioselective disulfide formation using the silyl chloride-sulfoxide method". Journal of the American Chemical Society. 115 (24): 11384–11392. doi:10.1021/ja00077a043.
- ^ Pedersen SL, Tofteng AP, Malik L, Jensen KJ (March 2012). "Microwave heating in solid-phase peptide synthesis". Chemical Society Reviews. 41 (5): 1826–1844. doi:10.1039/C1CS15214A. PMID 22012213.
- ^ Kappe CO, Stadler A, Dallinger D (2012). Microwaves in Organic and Medicinal Chemistry. Methods and Principles in Medicinal Chemistry. Vol. 52 (Second ed.). Wiley. ISBN 9783527331857.
- ^ Nyfeler R (7 November 1994). Peptide synthesis via fragment condensation. Methods in Molecular Biology. Vol. 35. New Jersey: Humana Press. pp. 303–316. doi:10.1385/0-89603-273-6:303. ISBN 978-0-89603-273-6. PMID 7894607.
- ^ Flood DT, Hintzen JC, Bird MJ, Cistrone PA, Chen JS, Dawson PE (September 2018). "Leveraging the Knorr Pyrazole Synthesis for the Facile Generation of Thioester Surrogates for use in Native Chemical Ligation". Angewandte Chemie International Edition in English. 57 (36): 11634–11639. doi:10.1002/anie.201805191. PMC 6126375. PMID 29908104.
- "Peptide Thioesters for Native Chemical Ligation". Chemistry Views. 9 September 2018.
- ^ Aranko AS, Wlodawer A, Iwaï H (August 2014). "Nature's recipe for splitting inteins". Protein Engineering, Design & Selection. 27 (8): 263–271. doi:10.1093/protein/gzu028. PMC 4133565. PMID 25096198.
- ^ Reddington SC, Howarth M (December 2015). "Secrets of a covalent interaction for biomaterials and biotechnology: SpyTag and SpyCatcher". Current Opinion in Chemical Biology. 29: 94–99. doi:10.1016/j.cbpa.2015.10.002. PMID 26517567.
- ^ Haridas V, Sadanandan S, Dheepthi NU (September 2014). "Sortase-based bio-organic strategies for macromolecular synthesis". ChemBioChem. 15 (13): 1857–1867. doi:10.1002/cbic.201402013. PMID 25111709. S2CID 28999405.
- ^ Kapusta DR, Thorkildsen C, Kenigs VA, Meier E, Vinge MM, Quist C, Petersen JS (August 2005). "Pharmacodynamic characterization of ZP120 (Ac-RYYRWKKKKKKK-NH2), a novel, functionally selective nociceptin/orphanin FQ peptide receptor partial agonist with sodium-potassium-sparing aquaretic activity". The Journal of Pharmacology and Experimental Therapeutics. 314 (2): 652–660. doi:10.1124/jpet.105.083436. PMID 15855355. S2CID 27318583.
- ^ Rizzi A, Rizzi D, Marzola G, Regoli D, Larsen BD, Petersen JS, Calo' G (October 2002). "Pharmacological characterization of the novel nociceptin/orphanin FQ receptor ligand, ZP120: in vitro and in vivo studies in mice". British Journal of Pharmacology. 137 (3): 369–374. doi:10.1038/sj.bjp.0704894. PMC 1573505. PMID 12237257.
- ^ Davies JS (August 2003). "The cyclization of peptides and depsipeptides". Journal of Peptide Science. 9 (8): 471–501. doi:10.1002/psc.491. PMID 12952390.
- ^ Sieber P, Kamber B, Riniker B, Rittel W (10 December 1980). "Iodine Oxidation of S-Trityl- and S-Acetamidomethyl-cysteine-peptides Containing Tryptophan: Conditions Leading to the Formation of Tryptophan-2-thioethers". Helvetica Chimica Acta. 63 (8): 2358–2363. doi:10.1002/hlca.19800630826. Retrieved 1 November 2021.
- ^ Scott P (13 October 2009). Linker Strategies in Solid-Phase Organic Synthesis. John Wiley & Sons. pp. 135–137. ISBN 978-0-470-74905-0.
- ^ Nicolaou KC, Natarajan S, Li H, Jain NF, Hughes R, Solomon ME, et al. (October 1998). "Total Synthesis of Vancomycin Aglycon-Part 1: Synthesis of Amino Acids 4-7 and Construction of the AB-COD Ring Skeleton". Angewandte Chemie. 37 (19): 2708–2714. doi:10.1002/(SICI)1521-3773(19981016)37:19<2708::AID-ANIE2708>3.0.CO;2-E. PMID 29711605.
- ^ East SP, Joullié MM (1998). "Synthetic studies of 14-membered cyclopeptide alkaloids". Tetrahedron Lett. 39 (40): 7211–7214. doi:10.1016/S0040-4039(98)01589-5.
- ^ Baker R, Castro JL (1989). "The total synthesis of (+)-macbecin I". Chem. Commun. (6): 378–381. doi:10.1039/C39890000378.
추가 정보
- Stewart JM, Young JD (1984). Solid phase peptide synthesis (2nd ed.). Rockford, IL: Pierce Chemical Company. p. 91. ISBN 978-0-935940-03-9.
- Kent SB (1988). "Chemical Synthesis of Peptides and Proteins". Annual Review of Biochemistry. Vol. 57. Palo Alto, CA: Annual Reviews. pp. 957–989. doi:10.1146/annurev.bi.57.070188.004521. PMID 3052294.
- Atherton E, Sheppard RC (1989). Solid Phase peptide synthesis: a practical approach. Oxford, England: IRL Press. ISBN 978-0-19-963067-7.
- Chan W, White P, eds. (2000). Fmoc Solid Phase Peptide Synthesis: A Practical Approach. Practical Approach Series, Issue 222. Oxford, UK: Oxford University Press. ISBN 0199637245. Retrieved 12 November 2016.
- Fields GB (February 2002). "Introduction to peptide synthesis". Current Protocols in Protein Science. Chapter 18: Unit 18.1. doi:10.1002/0471140864.ps1801s26. ISBN 978-0-471-14086-3. PMC 3564544. PMID 18429226.
- Bodanszky M (2012). Principles of Peptide Synthesis. Reactivity and Structure: Concepts in Organic Chemistry, Volume 16. New York, NY: Springer Science & Business Media. ISBN 978-3642967634. Retrieved 12 November 2016.
- Bodanszky M, Bodanszky A (2013). The Practice of Peptide Synthesis. Reactivity and Structure: Concepts in Organic Chemistry, Volume 21. New York, NY: Springer Science & Business Media. ISBN 978-3-642-96835-8. Retrieved 12 November 2016.
- Benoiton NL (2016). Chemistry of Peptide Synthesis. Boca Raton, FL: CRC Press / Taylor & Frances. ISBN 978-1-4200-2769-3. Retrieved 12 November 2016.