마이크로톰
Microtome마이크로톰은 "작다"는 뜻의 그리스어 미크로스와 "절단하다"는 뜻의 템네인에서 유래한 절삭 도구이다.과학에서 중요한 것은, 마이크로톰은 현미경 검사에 사용되며, 투과된 빛이나 전자 방사선에서 관찰을 위한 샘플을 준비할 수 있게 해준다.
마이크로톰은 슬라이스되는 시료와 절단되는 단면의 원하는 두께에 따라 강철, 유리 또는 다이아몬드 블레이드를 사용합니다.강철 블레이드는 빛 현미경을 위해 동물이나 식물 조직의 조직학적 단면을 준비하는데 사용됩니다.유리칼은 광현미경을 위한 부분과 전자현미경을 위한 매우 얇은 부분을 자르는 데 사용된다.산업용 다이아몬드 칼은 광현미경 검사와 전자현미경 검사 모두에서 뼈, 치아, 질긴 식물 물질과 같은 단단한 재료를 잘라내는 데 사용됩니다.보석 품질의 다이아몬드 칼은 또한 전자 현미경을 위한 얇은 부분을 슬라이스하는 데 사용됩니다.
미세절제술은 뼈, 광물, 치아 등의 재료를 위한 얇은 단면을 만드는 방법이며, 일렉트로폴리싱 및 이온 밀링의 대안이다.마이크로톰 섹션은 50nm에서 100μm 사이의 두께로 사람의 머리카락을 폭에 걸쳐 절단할 수 있을 정도로 얇게 만들 수 있습니다.
역사

광현미경 개발 초기에, 식물과 동물에서 나온 부분들은 면도날을 사용하여 수동으로 준비되었다.관찰 대상 시료의 구조를 관찰하기 위해서는 빛이 투과될 수 있는 100μm 정도의 깨끗한 재현성 절단이 중요한 것으로 나타났다.이를 통해 투과 모드에서 광현미경을 사용하여 샘플을 관찰할 수 있습니다.
이러한 절단 준비를 위한 최초의 장치 중 하나는 1770년 조지 애덤스 주니어(1750–1795)에 의해 발명되었고 알렉산더 커밍스에 의해 [2]더욱 개발되었다.장치는 수동 조작되었으며, 샘플은 실린더에 고정되었고 샘플의 상부에서 수동 [1][3]크랭크를 사용하여 생성된 섹션입니다.
1835년 Andrew Prichard는 작업자를 칼로부터 [4]분리하여 테이블에 부착함으로써 진동을 차단할 수 있는 테이블 기반 모델을 개발했습니다.
때때로 마이크로톰의 발명에 대한 귀속은 해부학자 빌헬름 히스 시니어(1865년)[5][6]의 그의 베슈라이붕 에인 미크로톰스(독일어로 마이크로톰의 묘사)에 있다고 빌헬름은 썼다.
그 장치는 손으로 만들 수 없는 부분을 완성할 수 있는 정밀도를 가능하게 했다.즉, 연구 과정에서 물체의 절단되지 않은 단면을 달성할 수 있는 가능성을 가능하게 했다.
다른 소식통들은 체코의 생리학자인 얀 에반젤리스타 푸르킨의 개발 때문이라고 덧붙인다.[7] 몇몇 출처는 Purkyne 모델을 실용화된 [8][9]최초의 모델이라고 설명한다.
마이크로톰의 기원에 있어 불명확한 점은 최초의 마이크로톰이 단순히 장치를 절단하고 있었다는 사실 때문이며, 초기 장치의 발달 단계는 널리 문서화되어 있지 않다.
1800년대 말, 중요한 세포 성분이나 분자의 선택적 염색과 함께 마이크로토미에 의해 매우 얇고 일관되게 얇은 샘플의 개발이 현미경 [10][11]세부사항의 시각화를 가능하게 했다.
오늘날 마이크로톰의 대부분은 나이프 블록 설계로 변경 가능한 나이프, 시료 홀더 및 진보 메커니즘이 있습니다.대부분의 디바이스에서 샘플의 절단은 샘플이 나이프 위로 이동함으로써 시작됩니다.여기서 진행 메커니즘은 자동으로 앞으로 이동하여 선택한 두께의 다음 절단을 할 수 있습니다.섹션 두께는 조정 메커니즘에 의해 제어되므로 정밀한 제어가 가능합니다.
적용들
마이크로톰의 가장 일반적인 용도는 다음과 같습니다.
- 전통적인 조직학 기술: 조직은 고정되고, 탈수되고, 깨끗해지고, 녹은 파라핀에 내장됩니다. 파라핀은 냉각되면 단단한 블록을 형성합니다.그런 다음 조직을 마이크로톰에서 2 ~ 50 μm의 다양한 두께로 절단합니다.여기서 조직을 현미경 슬라이드 위에 장착하고 파라핀 제거 후 적절한 수성 염료로 염색한 후 광현미경을 [12]사용하여 검사할 수 있다.
- 동결절개법: 동결마이크로톰 또는 마이크로톰크리오스타트로 동결하여 수분이 풍부한 조직을 경화시켜 절단하고, 광현미경으로 염색하여 검사한다.이 기술은 기존 조직학보다 훨씬 빠르며(16시간 대비 5분) 빠른 진단을 위해 의료 절차와 함께 사용됩니다.동결조직은 고정제를 사용하는 것보다 조직의 열화를 더 빨리 막고 화학조성을 많이 바꾸거나 감추지 않기 때문에 면역조직화학에도 사용될 수 있다.
- 전자현미경 기술: 에폭시 수지에 조직을 삽입한 후 유리 또는 보석급 다이아몬드 나이프를 장착한 마이크로톰을 사용하여 매우 얇은 부분(일반적으로 60~100나노미터)을 절단합니다.단면을 적절한 중금속염 수용액으로 착색하고 투과전자현미경으로 검사한다.이 악기는 종종 초미량체라고 불린다.울트라마이크로톰은 또한 얇은 절단 전에 조사 부분을 절단하기 위해 유리 나이프 또는 산업용 다이아몬드 나이프와 함께 사용됩니다.이러한 조사 섹션의 두께는 일반적으로 0.5~1μm이며, TEM의 얇은 섹션을 작성하기 전에 유리 슬라이드에 장착하고 광현미경 아래에서 관심 영역을 찾기 위해 착색됩니다.TEM을 위한 얇은 섹션은 보석 품질의 다이아몬드 나이프로 종종 이루어집니다.기존의 TEM 기술을 보완하는 초미크로톰이 SEM 챔버 내에 탑재되어 있는 경우가 증가하고 있어 블록면의 표면을 촬상하고 마이크로톰으로 제거하여 다음 표면을 촬상할 수 있다.이 기술은 SBSEM(Serial Block-Face Scanning Electron Microscopy)이라고 불립니다.
- 식물학 마이크로토미 기술: 나무, 뼈, 가죽과 같은 단단한 재료에는 썰매 마이크로토미가 필요합니다.이 마이크로톰은 더 무거운 날을 가지고 있으며 일반 마이크로톰만큼 얇게 자를 수 없습니다.
- 분광학(특히 FTIR 또는 적외선 분광학)기술: 적외선 빔이 검사 대상 시료를 투과할 수 있도록 얇은 고분자 단면이 필요합니다.일반적으로 시료는 20~100μm 두께로 절단한다.얇은 단면에서 훨씬 더 작은 면적을 보다 상세하게 분석하기 위해 샘플 검사에 FTIR 현미경을 사용할 수 있습니다.
최근 개발된 것이 레이저 마이크로톰으로 기계 나이프 대신 펨토초 레이저로 표적 표본을 절단한다.이 방법은 접촉이 없으며 검체 준비 기술이 필요하지 않습니다.레이저 마이크로톰은 본래의 상태로 거의 모든 조직을 절단할 수 있는 능력을 가지고 있다.가공 재료에 따라 10~100μm의 슬라이스 두께가 가능하다.
분할 간격은 주로 다음 중 하나로 분류할 수 있습니다.
- 시리얼 섹션: 파라핀 블록에서 섹션의 연속 리본을 가져와 모두 슬라이드에 사용합니다.
- 스텝 섹션: 블록의 지정된 깊이로 수집됩니다.
종류들
슬레지
썰매 마이크로톰은 샘플을 고정 홀더(셔틀)에 넣은 다음 칼을 가로질러 앞뒤로 움직이는 장치입니다.현대식 썰매 마이크로톰은 많은 [13]거친 부분을 쉽게 자를 수 있는 디자인인 선형 베어링 위에 썰매를 놓습니다.시료와 마이크로톰 나이프의 각도를 조정함으로써 절단 시 시료에 가해지는 압력을 줄일 [13]수 있다.이 마이크로톰 설계의 일반적인 적용 분야는 생물학적 준비를 위한 파라핀에 내장된 샘플과 같은 대형 샘플의 준비이다.썰매 마이크로톰에서 얻을 수 있는 일반적인 절단 두께는 1~60μm입니다.
로터리
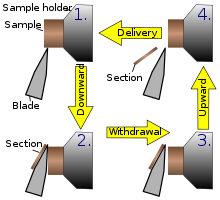
이 기기는 일반적인 마이크로톰 설계입니다.이 장치는 실제 절단 부분이 회전 동작의 일부가 되도록 단계별 회전 동작으로 작동합니다.회전식 마이크로톰에서 나이프는 일반적으로 수직 [14]위치에 고정된다.
왼쪽 그림에서는 절단 원리에 대해 설명합니다.시료 홀더의 움직임에 따라 시료를 나이프 위치 1에서 위치 2로 절단하고, 이 위치 2에서 신선부가 나이프 위에 남는다.회전운동의 최고점에서는 샘플 홀더를 만드는 부분과 같은 두께로 전진시켜 다음 부분을 만들 수 있다.
많은 마이크로톰의 플라이휠은 손으로 조작할 수 있다.이는 플라이휠의 질량이 상대적으로 크기 때문에 샘플 절단 도중 샘플이 정지되지 않기 때문에 깔끔하게 절단할 수 있다는 장점이 있습니다.신형 모델의 플라이휠은 종종 마이크로톰 케이스 안에 통합되어 있습니다.회전식 마이크로톰의 일반적인 절단 두께는 1 ~60μm입니다.합성수지에 내장된 샘플과 같은 단단한 재료의 경우, 이 마이크로톰 설계를 통해 0.5μm 두께의 "반박형" 단면을 만들 수 있습니다.
극저온로톰
냉동 샘플의 절단을 위해, 많은 회전 마이크로톰은 소위 크라이오미크로톰 구성으로 액체 질소 챔버에서 절단을 위해 조정될 수 있습니다.온도가 낮아지면 유리 천이를 거치는 등 샘플의 경도를 높일 수 있으며,[13] 이를 통해 반박형 샘플을 준비할 수 있습니다.그러나 샘플 두께를 최적화하려면 샘플 온도와 나이프 온도를 조절해야 합니다.
울트라마이크로톰
초미량체는 초미량절제술의 주요 도구이다.회전 마이크로톰과 동일한 방식으로 작동하지만 기계 구조에 대한 공차가 매우 엄격한 초박형 섹션을 준비할 수 있습니다.세심한 기계구조의 결과, 설치의 선형 열팽창에 의해 [13]두께를 매우 미세하게 제어할 수 있다.
이러한 초박형 컷은 투과형 전자현미경(TEM) 및 시리얼 블록 페이스 스캔 전자현미경(SBSEM)에 사용할 때 중요하며, 때로는 광광 [14]현미경에도 중요합니다.이러한 절단부의 일반적인 두께는 투과 전자 현미경의 경우 40~100 nm 사이이며, SBFSEM의 경우 30~50 nm 사이인 경우가 많다.특수 TEM 애플리케이션 또는 광현미경 조사 섹션의 경우 최대 500 nm 두께의 두꺼운 섹션이 최종 얇은 섹션의 영역을 선택하기 위해 사용됩니다.다이아몬드 나이프(가급적이면)와 유리 나이프는 초미량 로봇과 함께 사용됩니다.단면을 수집하기 위해 절단할 때 액체 위에 띄우고 TEM 시료 보기에 적합한 그리드에 조심스럽게 집어 올립니다.단면의 두께는 매우 낮은 샘플 [15]두께의 결과로 나타나는 반사광의 박막 간섭 색상으로 추정할 수 있습니다.
진동
진동 마이크로톰은 진동 블레이드를 사용하여 절단함으로써 작동하므로 정지 블레이드에 필요한 압력보다 낮은 압력으로 절단할 수 있습니다.진동하는 마이크로톰은 보통 어려운 생물학적 [13]샘플에 사용된다.절단 두께는 일반적으로 살아있는 조직의 경우 약 30~500 μm, 고정 [16]조직의 경우 10~500 μm이다.
진동하는 마이크로톰의 변형은 콤프레스토메 마이크로톰입니다.[17]Compresstome은 검체 주사기 또는 "립스틱 같은" 튜브를 사용하여 조직을 [18]고정합니다.조직 시료를 아가로스(다당류)에 완전히 박고 조직을 튜브 밖으로 천천히 부드럽게 밀어내 진동 블레이드를 절단한다.이 장치는 다음과 같은 방식으로 작동합니다. 조직이 나오는 검체 튜브의 끝이 로드 끝보다 약간 좁아 튜브에서 나올 때 조직을 부드럽게 "압축"할 수 있습니다.약간의 압축으로 전단, 고르지 않은 절단 및 진동 아티팩트가 형성되는 것을 방지합니다.압축 기술은 절개 중인 조직을 손상시키거나 영향을 미치지 않습니다.
Compresstome microtome microtome의 장점은 1) Agarose medding은 모든 면에서 시료 전체에 안정성을 부여하여 조직의 불균일한 슬라이스나 전단 현상을 방지하고 2) 조직을 부드럽게 압축하여 균등하게 절단하여 블레이드가 조직에 밀리지 않도록 하며 3) 대부분의 v보다 빠른 절단을 가능하게 한다.이브라팅 마이크로톰, 그리고 4) 건강한 [19]조직을 제공하기 위해 나이가 많거나 성숙한 동물의 조직을 잘 자른다.
봤다
톱으로 된 마이크로톰은 특히 치아나 뼈와 같은 단단한 물질을 위한 것이다.이 유형의 마이크로톰은 회전 톱이 움푹 패여 있어 샘플을 잘라냅니다.최소 절단 두께는 약 30μm이며 비교적 큰 [13]샘플에 대해 만들 수 있습니다.
레이저
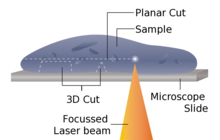
레이저 마이크로톰은 비접촉 [20]슬라이스용 기구입니다.매립, 동결 또는 화학적 고정을 통한 시료의 사전 준비는 필요하지 않으므로 준비 방법의 아티팩트를 최소화할 수 있습니다.또는 이 마이크로톰 디자인은 뼈나 치아와 같은 매우 단단한 재료뿐만 아니라 일부 세라믹에도 사용될 수 있습니다.샘플 재료의 특성에 따라 10~100μm의 두께를 얻을 수 있습니다.
이 장치는 적외선 레이저의 절단 동작을 사용하여 작동합니다.레이저가 근적외선으로 방사선을 방출하면 이 파장 영역에서 레이저가 생물학적 물질과 상호작용할 수 있습니다.시료 내에서 프로브를 날카롭게 포커싱함으로써 최대 TW/cm의2 매우 높은 강도의 초점을 얻을 수 있습니다.초점 영역에서의 광투과 비선형 상호 작용을 통해 광교란이라고 알려진 공정에서의 재료 분리가 도입된다.레이저 펄스 지속시간을 펨토초 범위로 제한함으로써 목표 영역에서 소비되는 에너지를 정밀하게 제어함으로써 컷의 상호작용 영역을 마이크로미터 이하로 제한한다.이 구역의 외부에서는 초단시간 빔 적용으로 샘플의 나머지 부분에 열 손상이 최소화되거나 전혀 발생하지 않습니다.
레이저 방사선은 고속 스캔 미러 기반 광학 시스템으로 유도되며, 이를 통해 빔 크로스오버를 3차원적으로 배치하면서 원하는 관심 영역으로 빔을 통과시킬 수 있습니다.높은 전력과 높은 래스터 레이트를 조합하면 스캐너가 단시간에 샘플의 넓은 영역을 절단할 수 있습니다.레이저 마이크로톰은 조직, 세포구조 및 기타 유형의 작은 특징의 내부 영역을 레이저 마이크로 해부하는 것도 가능하다.
칼
마이크로톰 나이프 블레이드 프로파일의 선택은 샘플의 재료와 준비 및 최종 샘플 요구 사항(예: 절단 두께 및 품질)에 따라 달라집니다.
설계 및 절단 유형
일반적으로 칼의 특징은 칼날의 윤곽이며, 이는 평면 오목형, 쐐기형 또는 끌 모양의 디자인으로 분류된다.
평면 오목형 마이크로톰 칼은 매우 날카롭지만 매우 섬세하기 때문에 매우 부드러운 [14]샘플에만 사용됩니다.웨지 프로파일 나이프는 다소 안정적이며 에폭시 또는 극저온 샘플 커팅과 같은 중간 정도의 단단한 재료에서 사용됩니다.마지막으로, 끝이 뭉툭한 끌 프로파일은 칼의 안정성을 높이는 동시에 절단을 위해 훨씬 더 많은 힘을 필요로 합니다.
울트라마이크로톰, 유리칼 및 다이아몬드칼의 경우 칼날 폭은 약 몇 밀리미터로 기존 마이크로톰칼보다 상당히 작습니다.유리칼은 보통 특수 "칼 제조기" 파쇄 장치를 사용하여 유리 막대의 파쇄로 제조됩니다.유리칼은 다이아몬드칼이 최종 절편에 사용될 수 있는 경우에도 초기 샘플 준비에 사용할 수 있습니다.유리칼은 보통 플라스틱 테이프로 만들어진 작은 홈을 가지고 있는데, 이 홈은 나중에 [13]수집하기 위해 샘플을 띄울 수 있도록 물로 채워져 있다.다이아몬드 블레이드를 이러한 기존 수조에 내장할 수 있으므로 동일한 수집 방법을 사용할 수 있습니다.
섹션화
마이크로톰에 의해 절단되기 전에 생물학적 재료는 보통 매립이라고 알려진 프로세스로 더 단단한 고정제에 놓입니다.이는 파라핀(왁스)이나 에폭시 등의 액체 물질이 시료 주위에 유입되어 금형에 넣은 후 경화시켜 쉽게 절단할 수 있는 "블록"을 생성함으로써 달성됩니다.
편각은 샘플 수직과 나이프 블레이드 사이의 접촉 각도입니다.칼날이 직각(탈락=90)일 경우 압력 기반 모드를 사용하여 직접 절단되므로 그에 비례하여 힘이 커집니다.그러나 칼이 기울면 칼의 상대운동이 샘플운동과 점점 평행하게 되어 슬라이스 동작을 할 수 있다.이 동작은 대형 또는 경질 검체에 매우 중요합니다.
칼의 기울기는 칼의 표면과 샘플 사이의 각도입니다.최적의 결과를 얻으려면 이 각도를 적절하게 선택해야 합니다.최적의 각도는 나이프 형상, 절단 속도 및 기타 많은 파라미터에 따라 달라집니다.각도를 0으로 조정하면 칼의 칼자국이 불규칙하게 되는 경우가 많으므로 칼자국을 새로 배치하여 매끄럽게 해야 합니다.
각도가 너무 크면 샘플이 구겨지고 칼이 절단 부위에 주기적으로 두께 변화를 일으킬 수 있습니다.각도를 너무 크게 하면 칼날 자체를 손상시킬 수 있습니다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Hill, John (1770). The Construction of Timber, from its early growth; Explained by Microscope, and proven from Experiments, in a great Variety of Kinds. London: The author. pp. 5–11, Plate I.
- ^ Quekett, John (1848). A Practical Treatise on the use of the Microscope. London: Hippolyte Bailliere. pp. 306, Chapter XII (Microtomes and Microtome Knives).
- ^ Anonymous (1910). "An eighteenth century Microtome". Journal of the Royal Microscopical Society. Oxford, England: The Royal Microscopical Society: 779–782.
- ^ 길버트 모건 스미스:식물학 마이크로테크닉의 발전.인: 미국현미경학회 34, Nr. 2. 1915, S. 71~129 (기사 PDF-버전) JSTOR 3221940 doi: 10.2307/3221940
- ^ "Wilhelm His". Encyclopædia Britannica Online. Encyclopædia Britannica. Retrieved 24 March 2009.
- ^ Loukas M, Clarke P, Tubbs RS, Kapos T, Trotz M (2008). "The His family and their contributions to cardiology". International Journal of Cardiology. 123 (2): 75–78. doi:10.1016/j.ijcard.2006.12.070. ISSN 0167-5273. PMID 17433467.
- ^ "Histology". msn Encarta. Archived from the original on 25 April 2009. Retrieved 18 March 2009.
- ^ Detlev Ganten:Handbuch der molkularen Medizin (분자의학 핸드북), Springer, ISBN 3-540-64552-7, (Google-Books)
- ^ 베르너 게라벡, 베른하르트 DHaage, Gundolf Keil, Wolfgang Wegner(2005) :Enzyklopaedie Medizingeschite(의료사 백과), Walter de Gruyter, ISBN 3-11-015714-4, (Google-Books)
- ^ Ernst Mayr (2002). Die Entwicklung der biologischen Gedankenwelt. (The evolution of the biological thought ). Springer. ISBN 978-3-540-43213-5.
- ^ Werner Lin,, Werner Linb, Jochen Fanghanel:히스토로지: 지톨로지, 알게마이네 히스토로지, 미크로스코피쉬 아나토미(이력:세포학, 일반조직학, 현미경 해부학) Walter de Gruyter, 1998, ISBN 3-11-014032-2 (Google-Books)
- ^ Bancroft, John; Stevens, Alan, eds. (1982). The Theory and Practice of Histological Techniques (2nd ed.). Longman Group Limited.
- ^ a b c d e f g Gudrun Lang (2006). Histotechnik. Praxislehrbuch für die Biomedizinische Analytik. (Histology : practical textbook for analytical biomedicine). Springer, Wien/New York. ISBN 978-3-211-33141-5.
- ^ a b c Klaus Henkel: Das Schneiden mit dem Mikrotom 2009년 11월 10일 Wayback Machine에서 아카이브.Mikrobroologische Vereinigung München, 2006, 2009년 2월 15일 접속
- ^ Peachey Lee D. (1958). "Thin Sections: A study of section thickness and physical distortion produced during microtomy" (PDF). J Biophys Biochem Cytol. 4 (3): 233–242. doi:10.1083/jcb.4.3.233. PMC 2224471. PMID 13549493.
- ^ Krumdieck, Carlos L. (January 2013). "Development of a live tissue microtome: reflections of an amateur machinist". Xenobiotica. 43 (1): 2–7. doi:10.3109/00498254.2012.724727. ISSN 0049-8254. PMID 23009272. S2CID 6108637.
- ^ Abdelaal, Hadia M.; Kim, Hyeon O.; Wagstaff, Reece; Sawahata, Ryoko; Southern, Peter J.; Skinner, Pamela J. (1 January 2015). "Comparison of Vibratome and Compresstome sectioning of fresh primate lymphoid and genital tissues for in situ MHC-tetramer and immunofluorescence staining". Biological Procedures Online. 17 (1): 2. doi:10.1186/s12575-014-0012-4. ISSN 1480-9222. PMC 4318225. PMID 25657614.
- ^ "index". www.precisionary.com. Retrieved 6 September 2016.
- ^ "Improved methods for acute brain slice preparation from adult and aging animals".
- ^ Holger Lubatschowski 2007: Laser Microtomy, WILE-VCH Verlag GmbH, 바이오포토닉스, S.49-51 (PDF 아카이브: 2011년 7월 19일 Wayback Machine)doi: 10.1002/opph.201190252
외부 링크
- . Encyclopædia Britannica (11th ed.). 1911.