리튬-황 전지
Lithium–sulfur battery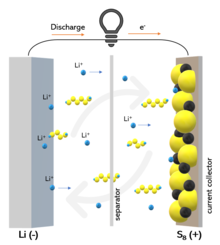 리튬-황 전지의 작동원리 및 "셔틀" 효과 | |
| 비중에너지 | 450[wh/kg][1] |
|---|---|
| 에너지 밀도 | 550[Wh/L][1] |
| 충방전 효율 | C/5 공칭 |
| 사이클 내구성 | 이의가 있는 |
| 공칭 셀 전압 | 방전 시 셀 전압은 비선형적으로 2.5~1.7V 범위 내에서 변화합니다. 배터리는 종종 3V용으로 포장됩니다. |
리튬-황 배터리(Li–S 배터리)는 충전식 배터리의 한 종류입니다. 높은 비중의 에너지로 유명합니다.[2] 리튬의 원자량이 낮고 황의 원자량이 적당하다는 것은 Li-S 전지가 비교적 가볍다는 것을 의미합니다(물의 밀도 정도). 그들은 2008년 8월, 제퍼 6호에 의해 (당시) 가장 길고 높은 고도의 무인 태양열 동력 항공기 비행에 사용되었습니다.[3]
리튬-황 전지는 에너지 밀도가 높고 비용이 절감되기 때문에 리튬-이온 전지를 대체할 수 있습니다. 리튬이온 배터리의 일반적인 원소인 코발트 대신 황을 사용했기 때문입니다.[4] Li–S 배터리는 550 Wh/kg 정도의 특정 에너지를 제공하는 [1]반면, 리튬 이온 배터리는 150–260 Wh/kg 범위입니다.[5]
2017년에 최대 1,500회 충전 및 방전 사이클을 갖는 Li–S 배터리가 [6]시연되었지만 상업적 규모와 희박한 전해질을 사용한 사이클 수명 테스트는 완료되지 않았습니다. 2021년 초 기준으로 상업적으로 이용 가능한 제품은 하나도 없었습니다.
수용 속도가 느려진 문제로는 양극에서 활성 물질이 점진적으로 누출되어 충전 주기가 너무 적어진 원인이 되는 폴리설파이드 "셔틀" 효과가 있습니다.[7] 또한 황 음극은 전도성이 낮아 용량에 대한 활성 질량의 기여를 이용하기 위해 전도제에 추가 질량이 필요합니다.[8] S에서 LiS로2 변환하는 동안 황 음극의 부피 팽창과 필요한 많은 양의 전해질도 문제입니다. 그러나 2000년대 초반에 과학자들은 안정성이 높은 황화탄소[9] 음극을 만드는 데 진전을 보이기 시작했고 2020년까지 라이스 대학의 과학자들은 1000 사이클 후 용량의 70% 이상을 유지하는 황화탄소 음극을 기반으로 배터리를 시연했습니다.[10] 2023년까지 텍사스에 본사를 둔 스타트업 제타 에너지는 황화 탄소 음극을 기반으로 하는 리튬-황 배터리가 폴리설파이드 셔틀이 없다는 것을 여러 국가 연구소가 독립적으로 검증했다고 발표했습니다.[11]
역사
Li–S 배터리는 1960년대에 Herbert와 Ulam이 리튬 또는 리튬 합금을 양극 재료로, 황을 양극 재료로, 그리고 지방족 포화 아민으로 구성된 전해질을 사용한 1차 배터리에 대한 특허를 낸 때에 발명되었습니다.[12][13] 몇 년 후, 2.35-2.5 V 배터리를 생산하는 PC, DMSO 및 DMF로 유기 용매를 도입함으로써 기술이 개선되었습니다.[14] 1980년대 말까지 전해액 용매로 에테르, 특히 DOL을 사용하는 충전식 Li–S 전지가 시연되었습니다.[15][16]
2020년에 Manthiram은 상업적 수용을 달성하는 데 필요한 중요한 매개 변수를 확인했습니다.[17][18] 구체적으로, Li-S 전지는 파우치형 셀에서 황 로딩이 >5 mg cm−2, 탄소 함량이 <5 %, 전해질 대 황비가 <5 μL mg−1, 전해질 대 용량비가 <5 μL (mAh),−1 음 대 용량비가 <5 >가 되어야 합니다.[17]
2021년, 연구원들은 양극을 오염시키는 음극에서 폴리설파이드 사슬이 방출되는 것을 방지하는 설탕 기반 양극 첨가제의 사용을 발표했습니다. 프로토타입 셀은 700 mAh/g의 용량으로 1,000회의 충전 사이클을 시연했습니다.[19]
2022년에는 다황화물 이동을 줄이고(양극 보호) 리튬 이온 전달을 용이하게 하여 충방전 시간을 줄일 수 있다고 주장하는 인터레이어가 도입되었습니다.[20] 또한 그 해에 연구원들은 세포막과 같은 네트워크로 만들어진 아라미드 나노섬유(나노스케일 케블라 섬유)를 사용했습니다. 이것은 덴드라이트 형성을 방지했습니다. 그것은 이온 선택성을 사용하여 네트워크에 작은 채널을 통합하고 전하를 추가하여 폴리설파이드 셔틀을 해결했습니다.[21]
또한 2022년, 드렉셀 대학교의 연구원들은 4000회 충전 주기 이상 저하되지 않는 리튬-황 전지의 원형을 만들었습니다. 분석 결과 배터리에는 95도 이하에서 불안정할 것으로 생각되는 단사정계 감마상 황이 포함되어 있는 것으로 나타났으며, 이 유형의 황은 20분에서 30분 이상 안정적인 것으로 나타난 연구는 소수에 불과합니다.[22]
화학
Li–S 셀에서의 화학적 공정으로는 방전 시 양극 표면으로부터 리튬 용해(및 알칼리 금속 폴리설파이드 염으로의 혼입), 충전 시 양극으로 역방향 리튬 도금 등이 있습니다.[23]
양극
양극 표면에서 금속 리튬의 용해가 일어나 방전 중에는 전자와 리튬 이온이 생성되고 충전 중에는 전착됩니다. 반작용은 다음과 같이 표현됩니다.[24]
리튬 전지와 유사하게, 용해/전착 반응은 시간이 지남에 따라 고체-전해질 계면(SEI)의 불안정한 성장을 유발하여 리튬의 핵 생성 및 수지상 성장을 위한 활성 부위를 생성합니다. 수지상 성장은 리튬 배터리의 내부 단락을 담당하며 배터리 자체의 사멸로 이어집니다.[25]
음극
Li–S 배터리에서는 황 음극(S8)에 에너지가 저장됩니다. 방전하는 동안 전해질의 리튬 이온은 황이 황화물(LiS2)로 환원되는 음극으로 이동합니다. 황은 재충전 단계에서 S로8 재산화됩니다. 따라서 반반응은 다음과 같이 표현됩니다.
+ +e -- - ⇀ 2 S {\{\ {S + 2Li+ + <=> Li2S}} E ° ≈ 2.15 V vs Li / Li )
실제로 황화리튬에 대한 황 환원 반응은 훨씬 더 복잡하며 순서에 따라 감소하는 사슬 길이에서 리튬 폴리설파이드(LiS2x, 2 ≤ x ≤ 8)의 형성을 포함합니다.[26]
최종 제품은 LiS에서2 환원 역학이 느리기 때문에 실제로 순수한 LiS가2 아닌 LiS와22 LiS의2 혼합물입니다.[27] 이것은 리튬 이온이 양극과 음극에 삽입되는 기존의 리튬 이온 셀과 대조됩니다. 각각의 황 원자는 두 개의 리튬 이온을 수용할 수 있습니다. 일반적으로 리튬 이온 배터리는 호스트 원자당 0.5~0.7개의 리튬 이온만 수용합니다.[28] 결과적으로 Li–S는 훨씬 더 높은 리튬 저장 밀도를 허용합니다. 다황화물은 셀이 방전되는 동안 음극 표면에서 순차적으로 환원됩니다.
- S
8 → Li
2S
8 → Li
2S
6 → Li
2S
4 → Li
2S
3
다공성 확산 분리기를 가로질러, 셀 전하에 따라 음극에서 황 폴리머가 형성됩니다.
- Li
2S → Li
2S
2 → Li
2S
3 → Li
2S
4 → Li
2S
6 → Li
2S
8 → S
8
Li-S 배터리의 주요 과제는 황의 낮은 전도성과 방전 시 상당한 부피 변화이며 적합한 음극을 찾는 것이 Li-S 배터리 상용화의 첫 단계입니다.[29] 따라서 대부분의 연구자들은 탄소/황 음극과 리튬 양극을 사용하고 있습니다.[30] 황은 매우 저렴하지만 25°C에서 5×10 S ⋅cm의 전기 전도성이 거의 없습니다. 탄소 코팅은 누락된 전기 전도성을 제공합니다. 탄소 나노 섬유는 비용이 더 많이 드는 단점이 있지만 효과적인 전자 전도 경로와 구조적 무결성을 제공합니다.[32]
리튬-황 설계의 한 가지 문제점은 음극에 있는 황이 리튬을 흡수할 때 LiSx 조성물의 부피 팽창이 일어나며, LiS의2 예측된 부피 팽창은 원래 황의 부피의 거의 80%라는 것입니다.[33] 이로 인해 음극에 큰 기계적 응력이 발생하여 급격한 열화의 주요 원인이 됩니다. 이 과정은 탄소와 황의 접촉을 줄이고 탄소 표면으로 리튬 이온의 흐름을 방지합니다.[34]
리튬화된 황 화합물의 기계적 특성은 리튬 함량에 따라 크게 좌우되며, 리튬 함량이 증가함에 따라 리튬화된 황 화합물의 강도가 향상되지만, 이러한 증가는 리튬화에 선형적이지 않습니다.[35]
대부분의 Li-S 전지의 주요 단점 중 하나는 전해액과의 원치 않는 반응입니다. S와 LiS는
2 대부분의 전해질에서 상대적으로 불용성이지만, 많은 중간 폴리설파이드는 그렇지 않습니다. LiS를
2
n 전해질에 용해시키면 활성 황이 비가역적으로 손실됩니다.[36] 반응성이 높은 리튬을 음극으로 사용하면 일반적으로 사용되는 다른 유형의 전해질 대부분이 해리됩니다. 음극 표면에 보호층을 사용하는 것은 셀의 안전성을 향상시키기 위해 연구되었습니다. 즉, Teflon 코팅을 사용하면 전해질 안정성이 [37]향상되고 LiPON, LiN도3 유망한 성능을 나타냈습니다.
폴리설파이드 "셔틀"
역사적으로, "셔틀" 효과는 Li–S 배터리의 열화의 주요 원인입니다.[38] 리튬 폴리설파이드 LiS2x(6≤x≤8)는 Li-S 배터리에 사용되는 일반적인 전해질에 잘 용해됩니다[39]. 이들은 음극에서 형성되고 누출되어 양극으로 확산되고, 단사슬 폴리설파이드로 환원되어 다시 긴사슬 폴리설파이드가 형성되는 음극으로 확산됩니다. 이 과정을 통해 양극에서 활물질이 지속적으로 누출되고, 리튬 부식, 낮은 쿨롱 효율 및 낮은 배터리 수명이 발생합니다.[40] 게다가, "셔틀" 효과는 Li-S 배터리의 특징적인 자가 방전의 원인이 되는데, 이는 정지 상태에서도 발생하는 폴리설파이드의 용해 속도가 느리기 때문입니다.[38] Li–S 배터리의 "셔틀" 효과는 충전 전압 플래토의 확장으로 평가되는 fc(0<fc<1) 인자로 정량화할 수 있습니다. 인자c f는 다음 식으로 표시됩니다.[41]
여기서 ks, qup, [Stot] 및 I는c 각각 양극 고원, 총 황 농도 및 전하 전류에 기여하는 운동 상수, 특정 용량입니다.
2022년,[42] 연구원들은 탄소 나노 섬유로 만든 음극의 사용을 보고했습니다. 원소유황을 탄소 기판(cf)에 증착했습니다. 물리적 기상 증착)은 희귀하고 일반적으로 준안정한 단사정계 γ-황 동소체를 형성합니다. 이 동소체는 중간 폴리설파이드 LiS의
2
x 형성 없이 LiS에
2 가역적으로 반응합니다. 따라서, 다소 위험한 에테르계 전해질(낮은 섬광점 및 끓는점) 대신 일반적으로 이러한 다황화물과 반응하는 탄산염 전해질을 사용할 수 있습니다.[43]
초기 용량은 800Ah/kg(클래식 LiCoO2/그래파이트 배터리는 셀 용량이 100Ah/kg)이었습니다. 사이클마다 평균 0.04%의 매우 느리게 붕괴되었으며, 4000 사이클(82%)[42] 후에도 658Ah/kg을 유지했습니다.
전해질
종래, Li-S 전지는, PP 분리막의 공극에 포함되는, 액체 유기 전해질을 사용합니다.[38] 전해액은 Li-S 배터리에서 중요한 역할을 하며, 폴리설파이드 용해에 의한 "셔틀" 효과와 음극 표면의 SEI 안정화에 모두 작용합니다. Li-ion 배터리에 일반적으로 사용되는 유기 탄산염을 기반으로 하는 전해질(즉, PC, EC, DEC 및 이들의 혼합물)은 Li-S 배터리의 화학적 성질과 호환되지 않는다는 것이 입증되었습니다.[44] 장사슬 폴리설파이드는 카르보네이트의 친전자성 부위에 친핵성 공격을 받아 에탄올, 메탄올, 에틸렌 글리콜 및 티오카르보네이트와 같은 부산물이 비가역적으로 형성됩니다. Li-S 배터리는 일반적으로 DEGDME 및 TEGDME를 포함하는 글리콜 에테르 계열뿐만 아니라 순환 에테르(DOL) 또는 단사슬 에테르(DME)를 사용합니다.[45] 한 가지 일반적인 전해질은 DOL에서 1M LiTFSI입니다.리튬 표면 패시베이션을 위한 첨가제로서 1% w/w di LiNO를3 포함하는 DME 1:1 vol.[45]
안전.
높은 전위 에너지 밀도와 셀의 비선형 방전 및 충전 응답으로 인해, 마이크로 컨트롤러 및 기타 안전 회로가 전압 조절기와 함께 사용되어 셀 작동을 관리하고 급속 방전을 방지합니다.[46]
조사.
| 양극 | 음극 | 날짜. | 원천 | 사이클링 후의 특정 용량 | 메모들 |
|---|---|---|---|---|---|
| 리튬금속 | 폴리에틸렌 글리콜 코팅, pitting mesoporous carbon | 2009년5월17일 | 워털루 대학교[47] | 168 mA ⋅g의 전류에서 20 사이클 후 1,110 mA ⋅h/g | 충전 사이클링 중 열화를 최소화합니다. 다황화물을 음극에 유지하기 위해 표면은 다황화물을 밀어내도록(소수성) 기능화되었습니다. 글라임 용매를 사용한 테스트에서 기존의 황 음극은 30주기 동안 96%의 황을 잃었고 실험 음극은 25%만 손실했습니다. |
| 리튬금속 | 황 코팅된 무질서한 탄소 중공 탄소 나노 섬유 | 2011 | 스탠퍼드 대학교[48][49] | 150 사이클 후 730 mA ⋅h/g (0.5 C에서) | 전해질 첨가제는 패러데이 효율을 85%에서 99% 이상으로 높였습니다. |
| 실리콘 나노와이어/탄소 | 황으로 코팅되고, 탄수화물로 만들어진 무질서한 탄소 나노튜브 | 2013 | CGS[50][51] | 400 사이클 후(1 C에서) 1,300 mA ⋅h/g | 재료의 마이크로파 가공과 전극의 레이저 프린팅. |
| 실리콘카본 | 유황 | 2013 | 프라운호퍼 재료 및 빔 기술 연구소 IWS[52] | ? 1,400 사이클 후에 | |
| 공중합황 | 2013 | 애리조나 대학교[53][54] | 823 mA⋅h/g at 100 cycles | 소량의 1,3-디이소프로필벤젠(DIB) 첨가제와 함께 대부분의 황에 "역 가황"을 사용합니다. | |
| 다공성 TiO 캡슐화된 2 황 나노입자 | 2013 | 스탠퍼드 대학교[55][56] | 721 mA⋅h/g at 1,000 cycles (0.5 C) | 쉘은 황-lithium 중간체를 전해질 용매로부터 보호합니다. 각 음극 입자의 직경은 800 나노미터입니다. 패러데이 효율 98.4%. | |
| 유황 | 2013년6월 | 오크리지 국립연구소 | 60 °C(0.1 C)에서 300 사이클에서 1200 mA·h/g 600 °C(1 C)[57]에서 300 사이클에서 800 mA·h/g | 고체 리튬 폴리설피도인산염 전해질. 일반적인 LIB의 전압의 절반입니다. 나머지 문제는 낮은 전해질 이온 전도도와 세라믹 구조의 취성을 포함합니다.[58][59] | |
| 리튬 | 스티렌-부타디엔-카르복시메틸 셀룰로오스 공중합체 바인더를 갖는 황-그래핀 산화물 나노복합체 | 2013 | 로렌스 버클리 국립 연구소[60] | 1,500 사이클에서 700 mA·h/g (0.05 C 방전) 1,500 사이클에서 400mA·h/g (0.5 C 충전/1 C 방전) | 충전 상태에 따라 약 1.7~2.5V 사이의 전압입니다. n메틸-(n-부틸)피롤리디늄 비스(트리플루오로메탄술포닐)-이미드(PYR14TFSI), 1M 리튬 비스-(트리플루오로메탄술포닐)이미드(LiTFSI), 1,3-디옥솔란(DOL), 디메톡시에탄(DME) 및 1M 리튬 비스-(트리플루오로메탄술포닐)이미드(LiTFSI 3)의 혼합물에 용해된 리튬 비스(트리플루오로메탄술포닐)이미드. 다공성이 높은 폴리프로필렌 분리막입니다. 비에너지는 1,500 사이클(C=1.0)에서 500 W ⋅h/kg(initial) 및 250 W ⋅h/kg입니다. |
| 리튬화 흑연 | 유황 | 2014년2월 | 태평양 북서부 국립 연구소 | 400사이클 | 코팅은 폴리설파이드가 양극을 파괴하는 것을 방지합니다.[61] |
| 리튬화 그래핀 | 황/리튬-황화 패시베이션층 | 2014 | 옥시스 에너지[62][63] | 240mA·h/g(1000사이클) 25 A·h/셀 | 패시베이션 층이 유황 손실을 방지합니다. |
| 리튬화 하드카본 | 황-공중합체(poly(S-co-DVB)) | 2019 | 충남대학교 | 3C에서 500 사이클 동안 400 mAh/g | 하드카본의 SEI는 양극에서 폴리설파이드의 침착을 방지하고 고속 성능을 가능하게 합니다.[64] |
| 리튬황 전지 | 탄소나노튜브/황 | 2014 | 칭화대학[65] | 17.3 mg ⋅cm의 황 부하에서 15.1 mA·h ⋅cm | 높은 면적의 황 로딩을 갖는 자유롭게 서 있는 CNT-S 종이 전극이 제작되었으며, 여기서 짧은 MWCNT는 근거리 전기 전도성 네트워크 역할을 하고 초장거리 CNT는 장거리 전도성 네트워크와 교차 결합기 역할을 모두 했습니다. |
| 구조적 지지를 위한 산화그래핀을 약간 환원시킨 유리코팅 황 | 2015 | 캘리포니아[66] 대학교 리버사이드 | 700mA ⋅h ⋅g (50사이클) | 유리 코팅으로 리튬 폴리설파이드가 전극으로 영구적으로 이동하는 것을 방지합니다. | |
| 리튬 | 유황 | 2016 | LeITAT | 500W ⋅h/kg | 양극, 음극, 전해질 및 분리막에 최적화된 새로운 구성 요소를 갖춘 자동차용 Li–S 배터리 개발 프로젝트 |
| 리튬금속 | 황화그래핀 | 2021 | 팔락 ý 대학교 CATRIN [1] | 644 mA⋅h⋅g−1 (250 cycles) | 황 함량이 높고 사이클링 안정성이 높은 Li-S 전지용 공유 황화 그래핀 음극을 제조하기 위한 효율적이고 간단한 방법.[68] |
| 황이 함유된 탄소나노튜브 | 2022 | 한국전기연구원[69] | 850mA ⋅h ⋅g (100사이클) | 인이 도핑된 활성탄 분리막 층을 사용하여 폴리설파이드 셔틀 효과를 최소화하는 동시에 접이식 배터리를 만듭니다. | |
| 리튬금속 | 티오인산리튬양극물 | 2023 | 다트머스 대학, | 1271mA ⋅h ⋅g (200사이클) | Li–S 음극 전해질에 오황화인을 첨가하면 방전 생성물(LiS2)을 수용하고 높은 사이클성과 저온 성능을 가능하게 하는 복합체가 형성됩니다. |
사업화
2021년 현재 산업 규모로 기술을 상용화할 수 있는 회사는 거의 없습니다. 사이온 파워와 같은 회사들은 그들의 리튬 유황 배터리 기술을 시험하기 위해 Airbus Defense and Space와 제휴를 맺었습니다. Airbus Defense and Space는 11일간의 비행 동안 실제 환경에서 낮에는 태양 에너지로 그리고 밤에는 리튬 유황 배터리로 작동하는 고고도 유사 위성(HAPS) 항공기의 원형을 성공적으로 발사했습니다. 시험 비행에 사용된 배터리는 350W ⋅h/kg을 제공하는 사이온 파워의 Li-S 셀을 사용했습니다. Sion은 원래 2017년 말까지 공급 가능한 물량을 생산하는 과정이라고 주장했지만, 최근에는 리튬-금속 배터리를 선호하여 리튬 황 배터리에 대한 작업을 중단한 것으로 볼 수 있습니다.[72][73]
영국 회사인 OXIS Energy는 리튬 황 배터리 시제품을 개발했습니다.[74][75] 임페리얼 칼리지 런던 및 크랜필드 대학교와 함께 셀에 대한 등가 회로 네트워크 모델을 발표했습니다.[76] 덴마크의 리튬 발란스(Lithium Balance)와 함께 그들은 주로 중국 시장을 위해 프로토타입 스쿠터 배터리 시스템을 개발했는데, 이 시스템은 10개의 아장수명 전지를 사용하여 1.2kWh의 용량을 가졌고, 범위가 크게 증가하여 납산 배터리보다 무게가 60% 적었습니다.[77] 그들은 또한 무게가 25kg에 불과하고 완전히 확장 가능하다고 알려진 3U, 3,000W의 ⋅h 랙 장착형 배터리를 만들었습니다. 그들은 그들의 리튬-황 배터리가 약 $200/k의 비용이 들 것이라고 주장했습니다.어떤 대량 생산.[79] 그러나 회사는 2021년 5월에 파산(부실) 상태에 진입했습니다.[80]
또한 최초의 리튬이온 배터리를 상용화한 소니는 2020년에 리튬-황 배터리를 시장에 선보일 계획이었으나, 2015년에 처음 발표된 이후 업데이트를 제공하지 않고 있습니다.[81]
호주 멜버른에 위치한 모나시 대학교 기계항공공학과는 독일 프라운호퍼 소재 및 빔 기술 연구소의 파트너들에 의해 제조된 초고용량 Li–S 배터리를 개발했습니다. 배터리가 5일 동안 스마트폰에 전원을 공급할 수 있다고 주장합니다.[82]
2022년 독일 회사인 Theion은 2023년에는 모바일 기기용, 2024년에는 차량용 리튬-황 배터리를 도입할 것을 주장했습니다.[83]
2023년 1월, 휴스턴, 텍사스 기업 제타 에너지는 유황-탄소 음극과 수직 정렬 탄소 나노 튜브 양극을 기반으로 리튬-황 배터리를 발전시키기 위해 미국 에너지부 ARPA-E 프로그램으로부터 400만 달러를 수여받았습니다.[84]
2023년 6월, 캘리포니아 산호세 회사 라이텐은 하루에 약 100개의 배터리를 만드는 시범 생산 라인을 시작했습니다.[85]
참고 항목
참고문헌
- ^ a b c "OXIS ENERGY SET TO MAKE SOLID-STATE LITHIUM-SULFUR CELL TECHNOLOGY A REALITY" (pdf). 20 April 2021. Retrieved 7 June 2021.
- ^ Zhang, Sheng S (2013). "Liquid electrolyte lithium/sulfur battery: Fundamental chemistry, problems, and solutions". Journal of Power Sources. 231: 153–162. doi:10.1016/j.jpowsour.2012.12.102.
- ^ 아모스, J. (2008년 8월 24일) "태양 비행기는 기록적인 비행을 한다" BBC 뉴스
- ^ Manthiram, Arumugam; Fu, Yongzhu; Su, Yu-Sheng (2013). "Challenges and Prospects of Lithium–Sulfur Batteries" (PDF). Acc. Chem. Res. 46 (5): 1125–1134. doi:10.1021/ar300179v. PMID 23095063. Archived from the original (PDF) on 2020-01-03.
- ^ Automotive Li-Ion Batteries: Current Status and Future Perspectives (Report). U.S. Department Of Energy. 2019-01-01. p. 26. Retrieved 15 March 2021.
- ^ "OXIS Energy's Lithium-Sulfur Battery Technology". Archived from the original on 28 June 2017. 2017년: "약 1500회 사이클링 가능" 앞으로 2년 안에 우리는 이것이 2500 사이클에 도달할 것으로 예상합니다." 2021년: "향후 2년 이내에 현재 사이클 수명을 두 배로 늘려 500 사이클 이상을 달성하는 것을 목표로 하고 있습니다."
- ^ Diao, Yan; Xie, Kai; Xiong, Shizhao; Hong, Xiaobin (August 2013). "Shuttle phenomenon – The irreversible oxidation mechanism of sulfur active material in Li–S battery". Journal of Power Sources. 235: 181–186. doi:10.1016/j.jpowsour.2013.01.132.
- ^ Eftekhari, Ali (2017). "The rise of lithium–selenium batteries". Sustainable Energy & Fuels. 1: 14–29. doi:10.1039/C6SE00094K.
- ^ Wang, J; Yang, J; Xie, J; Xu, N (2002). "A novel conductive polymer–sulfur composite cathode material for rechargeable lithium batteries". Advanced Materials. 14 (13–14): 963–965. doi:10.1002/1521-4095(20020705)14:13/14<963::AID-ADMA963>3.0.CO;2-P.
- ^ Salvatierra, Rodrigo V; James, Dustin K; Tour, James M (2022). Gupta, Ram K (ed.). Lithium-Sulfur Batteries: Materials, Challenges and Applications. Amsterdam: Elsevier. p. 241-270. ISBN 978-0-323-91934-0.
- ^ "Zeta Energy Receives Third-Party Verification that its Lithium-Sulfur Battery is Polysulfide Free". PR Newswire. May 1, 2023. Retrieved September 3, 2023.
- ^ 미국 특허 3043896, Danuta, Herbert & Juliusz, Ulam, "전기 건조 전지 및 축전지", 1962-07-10호, Electric Tech Corp에 할당
- ^ 미국 특허 3532543, Nole, Dominick A. & Moss, Vladimir, "비수성 전해질을 갖는 리튬-황 전극을 채용한 배터리", Aerojet Rocketdyne Inc.에 할당된 1970-10-06호
- ^ 미국 특허 3413154, Mlarur, Rao & Bhaskara, Lakshmanar, "Organic electrolyte cells, 1968-11-26 발행, Duracell Inc. USA에 할당
- ^ Peled, E.; Gorenshtein, A.; Segal, M.; Sternberg, Y. (May 1989). "Rechargeable lithium–sulfur battery (extended abstract)". Journal of Power Sources. 26 (3–4): 269–271. Bibcode:1989JPS....26..269P. doi:10.1016/0378-7753(89)80133-8.
- ^ Peled, E. (1989). "Lithium-Sulfur Battery: Evaluation of Dioxolane-Based Electrolytes". Journal of the Electrochemical Society. 136 (6): 1621–1625. Bibcode:1989JElS..136.1621P. doi:10.1149/1.2096981.
- ^ a b Bhargav, Amruth; Jiarui, He (2020). "Lithium-Sulfur Batteries: Attaining the Critical Metrics". Joule. 4 (2): 285–291. doi:10.1016/j.joule.2020.01.001.
- ^ Manthiram, Arumugam; Fu, Yongzhu; Chung, Sheng-Heng; Zu, Chenxi; Su, Yu-Sheng (2014). "Rechargeable Lithium–Sulfur Batteries". Chemical Reviews. 114 (23): 11751–11787. doi:10.1021/cr500062v. PMID 25026475.
- ^ Lavars, Nick (2021-09-13). "Sugar-doped lithium sulfur battery promises up to 5 times the capacity". New Atlas. Retrieved 2021-09-20.
- ^ Lavars, Nick (2022-02-28). "Porous battery layer pulls once-a-week EV charging a step closer". New Atlas. Retrieved 2022-03-01.
- ^ Lavars, Nick (2022-01-17). "Kevlar fibers fortify lithium-sulfur battery with 5x capacity of Li-ion". New Atlas. Retrieved 2022-04-07.
- ^ Pai, Rahul (2022-02-10). "Stabilization of gamma sulfur at room temperature to enable the use of carbonate electrolyte in Li-S batteries". Communications Chemistry. 5 (1): 17. doi:10.1038/s42004-022-00626-2. PMC 9814344. PMID 36697747. S2CID 246704531.
- ^ F.B. Tudron, J.R. Akridge, V.J. Puglisi(2004) "리튬-황 충전 배터리: 휴대용 전자기기의 특성, 발전 상태 및 적용 가능성"(Tucson, AZ: Sion Power)
- ^ Kumar, Rudra; Liu, Jie; Hwang, Jang-Yeon (2018). "Recent research trends in Li–S batteries". Journal of Materials Chemistry A. 6 (25): 11582–11605. doi:10.1039/C8TA01483C. Retrieved 2019-07-04.
- ^ Ould Ely, Teyeb; Kamzabek, Dana; Chakraborty, Dhritiman (2018-05-29). "Lithium–Sulfur Batteries: State of the Art and Future Directions". ACS Applied Energy Materials. 1 (5): 1783–1814. doi:10.1021/acsaem.7b00153.
- ^ Lin, Zhan; Liang, Chengdu (2015). "Lithium–sulfur batteries: from liquid to solid cells". Journal of Materials Chemistry A. 3 (3): 18. doi:10.1039/C4TA04727C. OSTI 1185628. Retrieved 2019-07-04.
- ^ Song, Min-Kyu; Cairns, Elton J.; Zhang, Yuegang (2013). "Lithium/sulfur batteries with high specific energy: old challenges and new opportunities". Nanoscale. 5 (6): 2186–204. Bibcode:2013Nanos...5.2186S. doi:10.1039/c2nr33044j. PMID 23397572. Retrieved 2019-07-04.
- ^ Bullis, Kevin (May 22, 2009). "Revisiting Lithium-Sulfur Batteries". Technology Review. Archived from the original on April 15, 2012. Retrieved August 12, 2016.
- ^ Eftekhari, A. (2017). "Cathode Materials for Lithium–Sulfur Batteries: A Practical Perspective". Journal of Materials Chemistry A. 5 (34): 17734–17776. doi:10.1039/C7TA00799J.
- ^ Choi, Y.J.; Kim, K.W. (2008). "Improvement of cycle property of sulfur electrode for lithium/sulfur battery". Journal of Alloys and Compounds. 449 (1–2): 313–316. doi:10.1016/j.jallcom.2006.02.098.
- ^ J.A. Dean, ed. (1985). Lange's Handbook of Chemistry (third ed.). New York: McGraw-Hill. pp. 3–5. ISBN 978-0-07-016192-4.
- ^ Choi, Y. J.; Chung, Y. D.; Baek, C. Y.; Kim, K. W.; Ahn, J. H. (March 4, 2008). "Effects of carbon coating on the electrochemical properties of sulfur cathode for lithium/sulfur cell". J. Power Sources. 184 (2): 548–552. Bibcode:2008JPS...184..548C. doi:10.1016/j.jpowsour.2008.02.053.
- ^ Islam, Md Mahbubul; Ostadhossein, Alireza; Borodin, Oleg; Yeates, A. Todd; Tipton, William W.; Hennig, Richard G.; Kumar, Nitin; Duin, Adri C. T. van (2015-01-21). "ReaxFF molecular dynamics simulations on lithiated sulfur cathode materials". Phys. Chem. Chem. Phys. 17 (5): 3383–3393. Bibcode:2015PCCP...17.3383I. doi:10.1039/c4cp04532g. PMID 25529209.
- ^ Brian Dodson, "새로운 리튬/황 전지는 리튬 이온의 에너지 밀도를 두 배로 증가시킵니다," New Atlas, 2013년 12월 1일
- ^ Islam; et al. (2015). "ReaxFF molecular dynamics simulations on lithiated sulfur cathode materials". Phys. Chem. Chem. Phys. 17 (5): 3383–3393. Bibcode:2015PCCP...17.3383I. doi:10.1039/C4CP04532G. PMID 25529209.
- ^ Jeong, S. S.; Lim, Y.; Choi, Y. T.; Kim, K. W.; Ahn, H. J.; Cho, K. K. (2006). "Electrochemical properties of lithium sulfur cells using PEO polymer electrolytes prepared under three different mixing conditions". J. Power Sources. 174 (2): 745–750. Bibcode:2007JPS...174..745J. doi:10.1016/j.jpowsour.2007.06.108.
- ^ Islam, Md Mahbubul; Bryantsev, Vyacheslav S.; van Duin, Adri CT (2014). "ReaxFF Reactive Force Field Simulations on the Influence of Teflon on Electrolyte Decomposition during Li/SWCNT Anode Discharge in Lithium-Sulfur Batteries" (PDF). Journal of the Electrochemical Society. 161 (8): E3009–E3014. doi:10.1149/2.005408jes. S2CID 52235837. Archived from the original (PDF) on 2019-02-21.
- ^ a b c Manthiram, Arumugam; Fu, Yongzhu; Chung, Sheng-Heng; Zu, Chenxi; Su, Yu-Sheng (2014-12-10). "Rechargeable Lithium–Sulfur Batteries". Chemical Reviews. 114 (23): 11751–11787. doi:10.1021/cr500062v. ISSN 0009-2665. PMID 25026475.
- ^ Zhang, Kintao (2018). Chemically Derived Graphene: Functionalization, Properties and Applications (illustrated ed.). Royal Society of Chemistry. p. 224. ISBN 978-1-78801-080-1. 224페이지 발췌
- ^ Song, Min-Kyu; Cairns, Elton J.; Zhang, Yuegang (2013). "Lithium/sulfur batteries with high specific energy: old challenges and new opportunities". Nanoscale. 5 (6): 2186–204. Bibcode:2013Nanos...5.2186S. doi:10.1039/c2nr33044j. ISSN 2040-3364. PMID 23397572.
- ^ Mikhaylik, Yuriy V.; Akridge, James R. (2004). "Polysulfide Shuttle Study in the Li/S Battery System". Journal of the Electrochemical Society. 151 (11): A1969. Bibcode:2004JElS..151A1969M. doi:10.1149/1.1806394.
- ^ a b Pai, Rahul; Singh, Arvinder; Tang, Maureen H.; Kalra, Vibha (10 February 2022). "Stabilization of gamma sulfur at room temperature to enable the use of carbonate electrolyte in Li-S batteries". Communications Chemistry. 5 (1): 17. doi:10.1038/s42004-022-00626-2. ISSN 2399-3669. PMC 9814344. PMID 36697747. S2CID 246704531.
- ^ Tao, Xinyong; Liu, Yayuan; Liu, Wei; Zhou, Guangmin; Zhao, Jie; Lin, Dingchang; Zu, Chenxi; Sheng, Ouwei; Zhang, Wenkui; Lee, Hyun-Wook; Cui, Yi (10 May 2017). "Solid-State Lithium–Sulfur Batteries Operated at 37 °C with Composites of Nanostructured Li 7 La 3 Zr 2 O 12 /Carbon Foam and Polymer". Nano Letters. 17 (5): 2967–2972. Bibcode:2017NanoL..17.2967T. doi:10.1021/acs.nanolett.7b00221. ISSN 1530-6984. PMID 28388080.
- ^ Yim, Taeeun; Park, Min-Sik; Yu, Ji-Sang; Kim, Ki Jae; Im, Keun Yung; Kim, Jae-Hun; Jeong, Goojin; Jo, Yong Nam; Woo, Sang-Gil (September 2013). "Effect of chemical reactivity of polysulfide toward carbonate-based electrolyte on the electrochemical performance of Li–S batteries". Electrochimica Acta. 107: 454–460. doi:10.1016/j.electacta.2013.06.039.
- ^ a b Scheers, Johan; Fantini, Sébastien; Johansson, Patrik (June 2014). "A review of electrolytes for lithium–sulphur batteries". Journal of Power Sources. 255: 204–218. Bibcode:2014JPS...255..204S. doi:10.1016/j.jpowsour.2014.01.023.
- ^ Akridge, J.R. (2001년 10월) "리튬 황 충전식 배터리 안전" 배터리 전원 제품 및 기술
- ^ a b 지규리, 이규태, 린다F. 나자르 (2009년 5월 17일)"리튬-설퍼 배터리를 위한 고도로 정렬된 나노 구조의 탄소-설퍼 음극." 네이처 머티리얼즈
- ^ Guangyuan, Zheng; Yuan Yang; Judy J. Cha; Seung Sae Hong; Yi Cui (14 September 2011). "Hollow Carbon Nanofiber-Encapsulated Sulfur Cathodes for High Specific Capacity Rechargeable Lithium Batteries" (PDF). Nano Letters. 11 (10): 4462–4467. Bibcode:2011NanoL..11.4462Z. doi:10.1021/nl2027684. PMID 21916442.
- ^ Keller, Sarah Jane (October 4, 2011). "Sulfur in hollow nanofibers overcomes challenges of lithium-ion battery design". Stanford News. Stanford University. Retrieved February 18, 2012.
- ^ Rosenberg, Sarah; Hintennach (1 April 2014). "Laser-printed lithium-sulphur micro-electrodes for Li/S batteries". Russian Journal of Electrochemistry. 50 (4): 327–335. doi:10.1134/S1023193514040065. S2CID 97154966.
- ^ Vandenberg, Aurelius; Hintennach (1 April 2014). "A novel design approach for lithium-sulphur batteries". Russian Journal of Electrochemistry. 50 (4): 317–326. doi:10.1134/S102319351306013X. S2CID 96826100.
- ^ "Researchers increase lifespan of lithium-sulfur batteries". Gizmag.com. 4 April 2013. Retrieved 2013-12-04.
- ^ Chung, W. J.; Griebel, J. J.; Kim, E. T.; Yoon, H.; Simmonds, A. G.; Ji, H. J.; Dirlam, P. T.; Glass, R. S.; Wie, J. J.; Nguyen, N. A.; Guralnick, B. W.; Park, J.; Somogyi, Á. D.; Theato, P.; MacKay, M. E.; Sung, Y. E.; Char, K.; Pyun, J. (2013). "The use of elemental sulfur as an alternative feedstock for polymeric materials". Nature Chemistry. 5 (6): 518–524. Bibcode:2013NatCh...5..518C. doi:10.1038/nchem.1624. PMID 23695634.
- ^ Caryl Richards (2013-04-16). "Radical approach to turn sulfur into polymers".
- ^ SLAC National Accelerator Laboratory (6 Posts) (2013-01-08). "World-Record Battery Performance Achieved With Egg-Like Nanostructures". CleanTechnica. Retrieved 2013-06-11.
{{cite web}}: CS1 main: 숫자 이름: 저자 목록 (링크) - ^ Wei Seh, Z.; Li, W.; Cha, J. J.; Zheng, G.; Yang, Y.; McDowell, M. T.; Hsu, P. C.; Cui, Y. (2013). "Sulphur–TiO2 yolk–shell nanoarchitecture with internal void space for long-cycle lithium–sulphur batteries". Nature Communications. 4: 1331. Bibcode:2013NatCo...4.1331W. doi:10.1038/ncomms2327. PMID 23299881.
- ^ Lin, Z; Liu, Z; Fu, W; Dudney, NJ; Liang, C (2013). "Lithium Polysulfidophosphates: A Family of Lithium-Conducting Sulfur-Rich Compounds for Lithium–Sulfur Batteries" (PDF). Angewandte Chemie International Edition. 52 (29): 7460–7463. doi:10.1002/anie.201300680. PMID 23737078. S2CID 37368147. Archived from the original (PDF) on 2016-09-10.
- ^ Lin, Z.; Liu, Z.; Fu, W.; Dudney, N. J.; Liang, C. (2013). "Lithium Polysulfidophosphates: A Family of Lithium-Conducting Sulfur-Rich Compounds for Lithium-Sulfur Batteries" (PDF). Angewandte Chemie International Edition. 52 (29): 7460–7463. doi:10.1002/anie.201300680. PMID 23737078. S2CID 37368147. Archived from the original (PDF) on 2016-09-10.
- ^ "All-solid lithium-sulfur battery stores four times the energy of lithium-ions". NewAtlas.com. 7 June 2013. Retrieved 2013-06-13.
- ^ "New lithium/sulfur battery doubles energy density of lithium-ion". NewAtlas.com. 2 December 2013. Retrieved 2013-12-04.
- ^ Lavars, Nick (February 20, 2014). "Hybrid anode quadruples the lifespan of lithium-sulfur batteries". Retrieved August 22, 2016.
- ^ "A whiff of brimstone". Economist. January 3, 2015. Retrieved August 22, 2016.
- ^ "Li–S battery company OXIS Energy reports 300 W⋅h/kg and 25 A⋅h cell, predicting 33 A⋅h by mid-2015, 500 W⋅h/kg by end of 2018". Green Car Congress. November 12, 2014. Retrieved August 22, 2016.
- ^ Nguyen, D.-T.; Hoefling, A.; Yee, M.; Nguyen, T. H. G.; Theato, P.; Lee, Y. J.; Song, S.-W. (2019). "Enabling high-rate and safe lithium ion-sulfur battery by effective combination of sulfur-copolymer cathode and hard-carbon anode". ChemSusChem. 12 (2): 480–486. doi:10.1002/cssc.201802430. PMID 30479038. S2CID 53771189.
- ^ Yuan, Zhe; Peng, Hong-Jie; Huang, Jia-Qi; Liu, Xin-Yan; Wang, Dai-Wei; Cheng, Xin-Bing; Zhang, Qiang (2014-10-01). "Hierarchical Free-Standing Carbon-Nanotube Paper Electrodes with Ultrahigh Sulfur-Loading for Lithium–Sulfur Batteries" (PDF). Advanced Functional Materials. 24 (39): 6105–6112. doi:10.1002/adfm.201401501. ISSN 1616-3028. S2CID 97124341. Archived from the original (PDF) on 2020-01-03.
- ^ Nealon, Sean (2015-03-03). "Glass coating for improved battery performance". R&D. Archived from the original on 2015-03-07. Retrieved August 22, 2016.
- ^ Nealon, Sean (March 2, 2015). "Glass coating improves battery performance". phys.org. Retrieved August 22, 2016.
- ^ Tantis, Iosif; Bakandritsos, Aristides; Zaoralová, Dagmar; Medveď, Miroslav; Jakubec, Petr; Havláková, Jana; Zbořil, Radek; Otyepka, Michal (2021). "Covalently Interlinked Graphene Sheets with Sulfur-Chains Enable Superior Lithium–Sulfur Battery Cathodes at Full-Mass Level". Advanced Functional Materials. 31 (30): 2101326. doi:10.1002/adfm.202101326. ISSN 1616-3028. S2CID 234870475.
- ^ Jo, Seong‐Chan; Hong, Jeong‐Won; Choi, Ik‐Hyeon; Kim, Min‐Ju; Kim, Byung Gon; Lee, You‐Jin; Choi, Hye Young; Kim, Doohun; Kim, TaeYoung; Baeg, Kang‐Jun; Park, Jun‐Woo (May 2022). "Multimodal Capturing of Polysulfides by Phosphorus‐Doped Carbon Composites for Flexible High‐Energy‐Density Lithium–Sulfur Batteries". Small. 18 (21): 2200326. doi:10.1002/smll.202200326. ISSN 1613-6810. PMID 35285157. S2CID 247437352.
- ^ Wang, Peiyu; Kateris, Nikolaos; Li, Baiheng; Zhang, Yiwen; Luo, Jianmin; Wang, Chuanlong; Zhang, Yue; Jayaraman, Amitesh S.; Hu, Xiaofei; Wang, Hai; Li, Weiyang (2023-08-17). "High-Performance Lithium–Sulfur Batteries via Molecular Complexation". Journal of the American Chemical Society. 145 (34): 18865–18876. doi:10.1021/jacs.3c05209. ISSN 0002-7863.
- ^ Kopera, J (2014년 9월) "시온파워의 리튬-황 배터리 파워 고고도 유사 위성 비행"시온파워사 보도자료
- ^ "Sion Power Delivers Next Generation Battery Performance Through Patented Licerion® Technology". 2016-10-03. Retrieved 4 October 2016.
- ^ "Sion Power Announces Launch of its Groundbreaking Licerion Rechargeable Lithium Battery, Sion Power". sionpower.com.
- ^ "Anesco and OXIS to Release Lithium Sulfur Battery Storage by 2016" (press release). OXIS Energy. July 14, 2015. Retrieved August 22, 2016.
- ^ "OXIS battery powers driverless vehicle for the UK Government's Smart City Gateway programme" (press release). OXIS Energy. February 22, 2015. Archived from the original on 2016-04-29. Retrieved August 22, 2016.
- ^ Propp, K.; Marinescu, M.; Auger, D. J.; et al. (August 12, 2016). "Multi-temperature state-dependent equivalent circuit discharge model for lithium-sulfur batteries". J. Power Sources. 328: 289–299. Bibcode:2016JPS...328..289P. doi:10.1016/j.jpowsour.2016.07.090.
- ^ "Lithium Sulfur batteries will be first commercialized by 2018 in electric bikes where energy density will be improved for eventual use in electric cars". nextbigfuture.com. 2016-06-10. Retrieved 2017-02-02.
- ^ "OXIS Rack-Mounted Battery" (PDF). OXIS Energy. Archived from the original (PDF) on August 26, 2018. Retrieved May 20, 2017.
- ^ "OXIS Energy Lithium-Sulfur Battery Technology Presentation". OXIS Energy. 2016-11-03. Retrieved May 20, 2017.
- ^ Scott, Alex (2021-06-26). "Oxis Energy files for bankruptcy". Chemical & Engineering News. Retrieved 2022-08-15.
- ^ "Sony battery to offer 40% longer phone life". Nikkei Asian Review. December 17, 2015. Retrieved August 22, 2016.
- ^ "'World's most efficient lithium-sulphur battery' set for launch". The Engineer. January 6, 2020. Retrieved January 9, 2020.
- ^ Morris, James. "Sulfur Battery Technology Could Make Electric Cars Go Three Times Further By 2024". Forbes. Retrieved 2022-08-28.
- ^ "Zeta Energy: Enabling Fast Charging Batteries with 3D Lithium Metal Architectures and Sulfurized Carbon Cathodes". United States Department of Energy. January 13, 2023. Retrieved September 28, 2023.
- ^ Avalos, George (2023-06-14). "Lyten launches San Jose pilot production for cutting-edge batteries - Company hopes lithium-sulfur batteries can revolutionize sector". San Jose Mercury News.
외부 링크
- "PolyPlus Lithium Sulfur". Polyplus.com. Archived from the original on 2013-04-20. Retrieved 2013-04-06.
- "Sion Power". Sion Power. Retrieved 2013-04-06.
- "Winston Battery Limited". En.winston-battery.com. Archived from the original on 2014-03-25. Retrieved 2013-04-06.
- EEMB 배터리. EEMB 배터리. 2018-04-13 회수


![{\displaystyle fc={\frac {k_{\text{s}}q_{\text{up}}[S_{\text{tot}}]}{I_{c}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/92767aff703c9811fcd59e4023389b4a8bdf304f)


