전기 촉매
Electrocatalyst전기 촉매란 전기 화학 반응에 참여하는 촉매다. 전기 촉매는 전극 표면에서 기능하거나, 가장 일반적으로 전극 표면 자체일 수 있는 특정한 형태의 촉매다. 전기 촉매는 플래틴화된 전극과 같이 이질적일 수 있다.[1] 수용성인 동질 전기 촉매들은 전극과 반응제 사이의 전자를 전달하거나 전체 반작용으로 설명되는 중간 화학적 변환을 돕는다.[2] 전기 촉매의 주요 과제는 연료 전지에 초점을 맞춘다.[3][4]
실용적인 전기 촉매
클로로칼리 공정
클로로칼리 공정은 전기 촉매를 사용하는 대규모 응용이다. 이 기술은 많은 산업에서 필요로 하는 염소와 수산화나트륨의 대부분을 공급한다. 음극은 혼합 금속 산화 피복 티타늄 양극(차원적으로 안정된 양극이라고도 함)[5][6]이다.

전기불화
많은 오르간오플루오린 화합물은 전기불화제에 의해 생성된다.[7] 이 기술의 한 가지 징후는 시몬스 과정으로, 다음과 같이 설명할 수 있다.
- RC3–H + HF → RC3–F2 + H
전형적 합성의 과정에서 이러한 반응은 전구체의 각 C-H 결합에 대해 한 번 발생한다. 세포 전위는 5-6V 가까이 유지된다. 전기 촉매인 양극은 니켈 도금된 것이다.
아크릴로니트릴의 하이드로디머화
아크릴로니트릴은 전기투석을 통해 산업 규모로 아디포니트릴로 전환된다.[1]
배경과 이론
일반적으로 촉매는 반응에 의해 소비되지 않고 화학 반응의 속도를 높이는 작용제다. 열역학적으로 촉매는 화학 반응이 일어나는 데 필요한 활성화 에너지를 낮춘다. 전기 촉매란 전기 화학 반응의 활성화 에너지에 영향을 미치는 촉매다.[8] 아래는 제품 및 반응물질의 에너지와 관련된 화학반응의 활성화 에너지 입니다. 전기화학 공정에서 활성화 에너지는 반응이 발생하는 전위, 즉 전압과 관련이 있다. 따라서 전기 촉매들은 산화 및 감소 과정이 관찰되는 전위를 자주 변화시킨다.[9] 또는 전기 촉매는 전극 표면에서 특정 화학적 상호작용을 촉진하는 작용제로 생각할 수 있다.[10] 전자가 한 화학 종에서 다른 화학 종으로 전달될 때 전기 화학 반응이 발생한다는 점을 고려할 때 전극 표면에서 유리한 상호작용은 전기 화학 변환 발생 가능성을 증가시켜 이러한 변환을 달성하는 데 필요한 잠재력을 감소시킨다.[10]
전기 촉매들은 활동성, 안정성, 선택성의 세 가지 수치에 따라 평가될 수 있다. 전기 촉매의 활성도는 얼마나 많은 전류 밀도가 생성되는지, 따라서 주어진 적용 전위에 대해 얼마나 빨리 반응이 발생하는지 이해함으로써 정량적으로 평가할 수 있다. 이 관계는 타펠 방정식과 함께 설명된다.[8] 전기 촉매의 안정성을 평가하기 위해서는 변환이 발생하는 전위를 견딜 수 있는 촉매의 능력이 중요하다. 전기 촉매의 선택성은 특정 기판과의 우선적 상호작용과 단일 제품의 생성을 말한다.[8] 선택성은 원하는 분석 물질 또는 기질에 대한 물질의 반응을 다른 간섭 물질에 대한 반응과 비교하는 선택성 계수를 통해 정량적으로 평가할 수 있다.[11]
갈바닉 셀, 연료 전지 및 다양한 형태의 전해질 셀을 포함한 많은 전기 화학 시스템에서, 높은 활성화 장벽으로 인해 고통을 받을 수 있는 단점이 있다. 이러한 활성화 장벽을 극복하기 위해 전용된 에너지가 열로 변환된다. 대부분의 발열 연소 반응에서 이 열은 단순히 촉매적으로 반응한다. 리독스 반응에서, 이 열은 시스템에 손실된 쓸모없는 부산물이다. 운동장벽을 극복하는 데 필요한 여분의 에너지는 대개 낮은 패러디 효율과 높은 잠재력 측면에서 설명된다.[8] 이러한 시스템에서 두 개의 전극과 관련 반전지 각각은 자체 특화된 전기 촉매가 필요할 것이다.[2]
다단계, 다단계, 다중 전자전달, 그리고 전체적인 화학적 변환에서 기체의 진화 또는 소비와 관련된 반작용은 상당한 운동장벽을 가지고 있는 경우가 많다. 게다가, 전극 표면에서 두 개 이상의 가능한 반응이 종종 있다. 예를 들어, 물의 전기분해 동안 양극은 2개의 전자 공정을 통해 과산화수소로, 또는 4개의 전자 공정을 통해 산소로 물을 산화시킬 수 있다. 전기 촉매의 존재는 두 반응 경로 중 하나를 촉진할 수 있다.[12]
균질 전기 촉매
동질 전기 촉매란 예를 들어 수용성 조정 복합체가 용액에서 전기화학적 변환을 촉진하는 것과 같은 물질의 동일한 단계에 존재하는 것을 말한다.[13][14] 이 기술은 상업적으로 행해지는 것이 아니라 연구에 관심이 있다.
합성조정단지
많은 콤플렉스가 전기화학반응을 촉진한다. 예를 들어, 코발트 포르피린과 코발트 폴리피리딘은 수소 진화 반응에 대해 높은 (>80%) 파라다이스 수율을 보인다.[13][14]
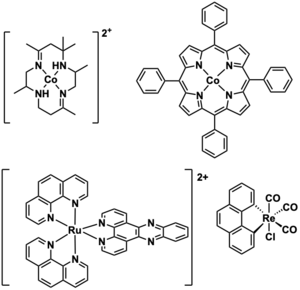
효소
어떤 효소는 전기 촉매 역할을 할 수 있다.[15] MoFe 군집을 포함하는 효소인 질소효소는 대기 질소를 고정하는 데 활용될 수 있다. 즉, 질소 가스를 암모니아와 같은 분자로 변환시킨다. 단백질을 전극 표면에 고정시키고 전자 중재자를 고용하면 이 과정의 효율성이 크게 향상된다.[16] 생체전기촉매의 효과는 일반적으로 효소의 활성 부위와 전극 표면 사이의 전자 이동의 용이성에 따라 결정된다.[15] 다른 효소들은 합성 촉매의 개발에 대한 통찰력을 제공한다. 예를 들어 니켈 함유 효소인 포메이트 탈수소효소는 CO2 감소에 사용할 수 있는 유사한 분자 구조를 가진 합성 복합체의 개발에 영감을 주었다.[17] 미생물 연료전지는 생물학적 시스템을 전기 촉매 응용에 활용할 수 있는 또 다른 방법이다.[15][18] 미생물 기반 시스템은 특정 효소의 활동보다는 전체 유기체의 대사 경로를 활용하는데, 이는 그들이 광범위한 화학 반응을 촉진시킬 수 있다는 것을 의미한다.[15] 미생물 연료전지는 포도당과 같은 기질 산화에 의해 전류를 얻을 수 있고,[18] CO2 감소와 같은 과정에 활용될 수 있다.[15]
이기종 전기 촉매
이질적인 전기 촉매란 예를 들어 고체 표면이 용액에서 반응을 촉진하는 것과 같이 반응 물질과는 다른 단계의 물질에 존재하는 것을 말한다. 상기의 다양한 유형의 이기종 전기 촉매 물질은 녹색으로 표시되어 있다. 이질적인 전기 촉매 반응에는 고체 촉매(일반적으로 금속)와 전해질 사이의 전자 전달이 필요하기 때문에 액체 용액이 될 수 있지만 이온 전도가 가능한 폴리머나 세라믹도 필요하기 때문에 반응 동력학은 촉매와 전해질 둘 다에 의존할 뿐만 아니라 그들 사이의 인터페이스에 의존한다.[10] 전기 촉매 표면의 특성은 비율과 선택도를 포함한 반응의 일부 특성을 결정한다.[10]
벌크 재료
전기 투석은 백금 금속과 같은 일부 벌크 물질의 표면에서 발생할 수 있다. 수소 생산을 위한 메탄올 분해에 금의 벌크 금속 표면이 사용되어 왔다.[2] 물 전기분해는 백금이나 이리듐과 같은 불활성 벌크 금속 전극에서 일반적으로 행해진다.[19] 전기 촉매의 활성은 일반적으로 두 개 이상의 금속을 합금하여 얻은 화학적 수정으로 조정할 수 있다. 이는 전자 구조의 변화, 특히 귀족 금속의 촉매 특성을 담당하는 것으로 간주되는 d밴드의 변화 때문이다.[20]
나노소재
나노입자
상용화된 것은 없지만 다양한 전기화학 반응을 촉진하기 위한 다양한 나노입자 재료가 입증되었다.[21] 이러한 촉매들은 표면 변형뿐만 아니라 크기와 형태에 따라 조정될 수 있다.[22]

또한 표면 원자의 배열을 정밀하게 제어함으로써 더 높은 반응률을 달성할 수 있다. 실제로 나노미터 시스템에서는 전기 촉매 활동을 추정하기 위해 사용 가능한 반응 지점의 수가 노출된 표면적보다 더 나은 매개변수다. 부위는 반응이 일어날 수 있는 위치들이다. 특정 부위에서 반응이 일어날 가능성은 촉매의 전자 구조에 따라 달라진다. 촉매는 아직 완전히 규명되지 않은 다른 많은 변수들과 함께 반응제의 흡착 에너지를 결정한다.[23]
TSK 모델에 따르면 촉매 표면 원자는 위치에 따라 테라스, 스텝 또는 꼬임 원자로 분류할 수 있으며, 각각 다른 조정 번호로 특징지어진다. 원칙적으로 조정 숫자가 낮은 원자는 반응성이 더 높기 때문에 반응체를 더 쉽게 흡착할 수 있다. 이는 운동학을 촉진할 수 있지만 흡착종이 반응체가 아닌 경우 이를 억제하여 촉매를 비활성화할 수도 있다. 나노기술의 발전은 촉매를 표면 설계하는 것을 가능하게 하여 원하는 크리스털 평면이 반응 물질에 노출되도록 하여 원하는 반응에 대한 유효 반응 지점의 수를 최대화한다.[21]
현재까지 모든 표면 효과가 강한 반작용 특이적이기 때문에 일반화된 표면의존성 메커니즘을 공식화할 수 없다. 표면의존성에 근거한 반응의 분류가[23] 제안되었지만, 여전히 그것들에 속하지 않는 많은 예외들이 있다.
입자 크기 효과
전기화학 공정에 대한 촉매 비용을 최대한 줄이려는 관심은 평균 입자 크기가 감소함에 따라 특정 표면적이 증가하기 때문에 미세 촉매 분말을 사용하게 되었다. 예를 들어, 대부분의 일반적인 PEM 연료전지와 전해질 설계는 전기 촉매로서 백금 나노입자에 충전된 고분자 막(일명 백금 흑백)에 기초한다.[24]
일반적으로 표면 면적 대 부피 비율은 전기 촉매 크기와 그 활성도를 연관시키는 주요 매개변수로 간주되지만, 입자 크기 효과를 이해하기 위해 다음과 같은 몇 가지 현상을 더 고려해야 한다.[23]
- 평형 모양: 나노입자의 어떤 크기에도 결정면을 정확하게 결정하는 평형 모양이 있다.
- 반응 부위의 상대적 수: 나노 입자의 주어진 크기는 특정 수의 표면 원자에 해당하며, 그 중 일부만 반응 부지를 주관한다.
- 전자구조: 일정 규모 이하에서는 나노입자의 작업기능이 변화하고 그 대역구조가 퇴보한다.
- 결함: 작은 나노입자의 결정 격자는 완벽하다. 따라서 입자 크기가 감소함에 따라 반응 부위가 느려질수록 반응 부위가 느려진다.
- 안정성: 작은 나노입자는 더 큰 입자를 향해 원자가 분산되어 질량이 감소하는 경향이 있는데, 이는 오스트왈드 숙성 현상에 따른 것이다.
- 캡핑제: 나노 입자를 안정화시키기 위해서는 캡팅 레이어가 필요하므로 표면의 일부는 반응제에 사용할 수 없다.
- 지지대: 나노입자는 제자리를 유지하기 위해 지지대에 고정되는 경우가 많으므로 표면의 일부를 반응제로 사용할 수 없다.
탄소 기반 재료
탄소 나노튜브와 그래핀 기반 재료를 전기 촉매로 사용할 수 있다.[25] 그래핀과 탄소 나노튜브의 탄소 표면은 특정 전기 촉매 반응을 촉진할 수 있는 많은 화학 종들의 흡착에 잘 맞는다.[26] 게다가, 그들의 전도성은 그들이 좋은 전극 재료라는 것을 의미한다.[26] 탄소 나노튜브는 표면적이 매우 높아서 전기화학 변형이 일어날 수 있는 표면적을 최대화한다.[27] 그래핀은 또한 단일 원자 촉매와 같은 다른 종류의 나노 물질로 합성물을 만드는 플랫폼 역할을 할 수 있다.[28] 탄소 기반 물질은 전도성 때문에 금속 전극을 대체하여 금속 무전기투석을 수행할 수 있다.[29]
프레임워크 재료
금속—유기체 프레임워크(MOF), 특히 전도성 프레임워크는 CO2 감소 및 물 분할과 같은 프로세스를 위한 전기 촉매로 사용될 수 있다. MOF는 금속 센터와 유기농 리간드 사이트 양쪽에 잠재적 활성 사이트를 제공한다.[30] 그것들은 또한 기능화 될 수도 있고 나노 입자와 같은 다른 물질들을 캡슐화 할 수도 있다.[30] MOF는 또한 전기 촉매를 형성하기 위해 탄소 기반 물질과 결합될 수 있다.[31] 특히 금속을 함유한 COF(covalent organic frameworks)는 전기 촉매 역할도 할 수 있다. 코발트 포르피린으로 구성된 COF는 이산화탄소를 일산화탄소로 줄일 수 있는 능력을 입증했다.[32]
그러나 많은 MOF는 화학적, 전기적 화학적 조건에서 불안정한 것으로 알려져 있어 MOF가 실제로 촉매인지 전촉매인지 구분하기 어렵다. 전기투석 시 MOF의 실제 활성 부위는 종합적으로 분석할 필요가 있다.[33]
전기투석 연구
물 갈라짐/수소 진화
수소와 산소는 연료전지의 사용으로 결합될 수 있다. 이 과정에서 반응은 별도의 전극에서 발생하는 두 개의 반작용으로 분해된다. 이 상황에서 반응제의 에너지는 직접 전기로 변환된다. 오토 열역학 사이클 기준 60%(압축비 10, 특정 열비 1.4)의 높은 효율을 가진 내연기관을 통해 이 반응의 열열로부터 유용한 에너지를 얻을 수 있다. 연료전지의 경우처럼 리독스 메커니즘을 통해 수소와 산소를 결합하는 것도 가능하다. 이 과정에서 반응은 별도의 전극에서 발생하는 두 개의 반작용으로 분해된다. 이 상황에서 반응제의 에너지는 직접 전기로 변환된다.[34][35]
수소의 표준 감소 잠재력은 0V로 정의되며, 흔히 표준 수소 전극(SHE)이라고 부른다.[36]
| 하프 리액션 | 감소 가능성 Eored(V) |
|---|---|
| 2H+ + 2e− → H2 (g) | ≡ 0 |
| O2(g) + 4H+ + 4e− → 2H2O(l) | +1.23 |
HER은[13] 많은 촉매에 의해 촉진될 수 있다.[13]
이산화탄소 감소
CO2 감소를 위한 전기 투석은 상업적으로 행해지는 것이 아니라 연구 의제로 남아 있다. CO를2 사용 가능한 제품으로 줄이는 것은 기후 변화에 대처하는 잠재적인 방법이다. 전기 촉매들은 메탄올과 다른 유용한 연료와 재고 화학 물질로 이산화탄소의 감소를 촉진할 수 있다. CO의2 가장 값진 감량 제품은 에너지 함량이 높은 제품으로 연료로 재사용할 수 있다는 의미다. 따라서 촉매 개발은 메탄이나 메탄올과 같은 제품의 생산에 초점을 맞춘다.[14] 이를 위해 효소[17], 합성 조정 콤플렉스[14] 등 균질 촉매제가 채용됐다. 탄소 기반 소재와 프레임워크 소재 등 CO2 감축을 위한 다양한 나노 소재도 연구됐다.[37]
에탄올 연료전지
메탄올의 수용액은 CO2 수소 가스와 물로 분해될 수 있다. 비록 이 과정이 열역학적으로 선호되지만 활성화 장벽은 극도로 높기 때문에 실제로는 이러한 반응이 일반적으로 관찰되지 않는다. 그러나, 전기 촉매들은 이 반응 속도를 크게 높여 메탄올을 연료 전지의 수소 저장으로 가는 가능한 경로로 만들 수 있다.[2] 금, 백금, 다양한 탄소 기반 물질과 같은 전기 촉매들이 이 과정을 효과적으로 촉매하는 것으로 나타났다. 탄소배출 주석-다이옥사이드 나노입자에 백금과 로듐의 전기촉매는 이산화탄소만을 부산물로 하여 실온에서 탄소 결합을 깨뜨릴 수 있어 에탄올이 전기를 만드는데 필요한 수소 이온과 전자로 산화될 수 있다.[38]
화학합성
전기 촉매들은 합성 제품을 얻기 위한 특정 화학 반응을 촉진하기 위해 사용된다. 그래핀과 그래핀 산화물은 합성을 위한 전기 촉매 물질로서 가능성을 보여주었다.[39] 전기 촉매법도 폴리머 합성 가능성이 있다.[40] 전기 촉매 합성 반응은 반응의 규모와 목적에 따라 일정한 전류, 일정한 전위 또는 일정한 세포 전압 조건에서 수행될 수 있다.[41]
추가 판독값
- Valenti, G.; Boni, A.; Melchionna, M.; Cargnello, M.; Nasi, L.; Bertoli, G.; Gorte, R. J.; Marcaccio, M.; Rapino, S.; Bonchio, M.; Fornasiero, P.; Prato, M.; Paolucci, F. (2016). "Co-axial heterostructures integrating palladium/titanium dioxide with carbon nanotubes for efficient electrocatalytic hydrogen evolution". Nature Communications. 7: 13549. Bibcode:2016NatCo...713549V. doi:10.1038/ncomms13549. PMC 5159813. PMID 27941752.
참고 항목
참조
- ^ a b Kotrel, Stefan; BrUninger, Sigmar (2008). "Industrial Electrocatalysis". Handbook of Heterogeneous Catalysis. doi:10.1002/9783527610044.hetcat0103. ISBN 978-3527312412.
- ^ a b c d Roduner, Emil (June 13, 2017). "Selected fundamentals of catalysis and electrocatalysis in energy conversion reactions—A tutorial". Catalysis Today. 309: 263–268. doi:10.1016/j.cattod.2017.05.091.
- ^ Debe, Mark K. (2012). "Electrocatalyst approaches and challenges for automotive fuel cells". Nature. 486 (7401): 43–51. Bibcode:2012Natur.486...43D. doi:10.1038/nature11115. S2CID 4349039.
- ^ Jiao, Yan; Zheng, Yao; Jaroniec, Mietek; Qiao, Shi Zhang (2015). "Design of electrocatalysts for oxygen- and hydrogen-involving energy conversion reactions". Chemical Society Reviews. 44 (8): 2060–2086. doi:10.1039/C4CS00470A. PMID 25672249.
- ^ Over, Herbert (2012). "Surface Chemistry of Ruthenium Dioxide in Heterogeneous Catalysis and Electrocatalysis: From Fundamental to Applied Research". Chemical Reviews. 112 (6): 3356–3426. doi:10.1021/cr200247n. PMID 22423981.
- ^ Landolt, D.; Ibl, N. (1972). "Anodic Chlorate Formation on Platinized Titanium". Journal of Applied Electrochemistry. Chapman and Hall Ltd. 2 (3): 201–210. doi:10.1007/BF02354977. S2CID 95515683.
- ^ Siegemund, Günter; Schwertfeger, Werner; Feiring, Andrew; Smart, Bruce; Behr, Fred; Vogel, Herward; McKusick, Blaine (2000). Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a11_349.
- ^ a b c d Jaramillo, Tom (September 3, 2014). "Electrocatalysis 101 GCEP Symposium - October 11, 2012". Youtube.com.
{{cite web}}: CS1 maint : url-status (링크) - ^ Bard, Allen J.; Larry R. Faulkner (2001). Electrochemical methods: fundamentals and applications (Second ed.). Hoboken, NJ. ISBN 0-471-04372-9. OCLC 43859504.
- ^ a b c d McCreery, Richard L. (July 2008). "Advanced Carbon Electrode Materials for Molecular Electrochemistry". Chemical Reviews. 108 (7): 2646–2687. doi:10.1021/cr068076m. ISSN 0009-2665.
- ^ Brown, Micah D.; Schoenfisch, Mark H. (2019-11-27). "Electrochemical Nitric Oxide Sensors: Principles of Design and Characterization". Chemical Reviews. 119 (22): 11551–11575. doi:10.1021/acs.chemrev.8b00797. ISSN 0009-2665.
- ^ Bard, Allen J.; Faulkner, Larry R. (January 2001). Electrochemical methods: fundamentals and applications. New York: Wiley. ISBN 978-0-471-04372-0. Retrieved 27 February 2009.
- ^ a b c d e Artero, Vincent; Chavarot-Kerlidou, Murielle; Fontecave, Marc (2011-08-01). "Splitting Water with Cobalt". Angewandte Chemie International Edition. 50 (32): 7238–7266. doi:10.1002/anie.201007987.
- ^ a b c d e Kinzel, Niklas W.; Werlé, Christophe; Leitner, Walter (2021-01-19). "Transition Metal Complexes as Catalysts for the Electroconversion of CO 2 : An Organometallic Perspective". Angewandte Chemie International Edition: anie.202006988. doi:10.1002/anie.202006988. ISSN 1433-7851. PMC 8248444.
- ^ a b c d e Chen, Hui; Simoska, Olja; Lim, Koun; Grattieri, Matteo; Yuan, Mengwei; Dong, Fangyuan; Lee, Yoo Seok; Beaver, Kevin; Weliwatte, Samali; Gaffney, Erin M.; Minteer, Shelley D. (2020-12-09). "Fundamentals, Applications, and Future Directions of Bioelectrocatalysis". Chemical Reviews. 120 (23): 12903–12993. doi:10.1021/acs.chemrev.0c00472. ISSN 0009-2665.
- ^ Milton, Ross D.; Minteer, Shelley D. (2019-12-17). "Nitrogenase Bioelectrochemistry for Synthesis Applications". Accounts of Chemical Research. 52 (12): 3351–3360. doi:10.1021/acs.accounts.9b00494. ISSN 0001-4842.
- ^ a b Yang, Jenny Y.; Kerr, Tyler A.; Wang, Xinran S.; Barlow, Jeffrey M. (2020-11-18). "Reducing CO 2 to HCO 2 – at Mild Potentials: Lessons from Formate Dehydrogenase". Journal of the American Chemical Society. 142 (46): 19438–19445. doi:10.1021/jacs.0c07965. ISSN 0002-7863.
- ^ a b Qiao, Yan; Bao, Shu-Juan; Li, Chang Ming (2010). "Electrocatalysis in microbial fuel cells—from electrode material to direct electrochemistry". Energy & Environmental Science. 3 (5): 544. doi:10.1039/b923503e. ISSN 1754-5692.
- ^ Carmo, Marcelo; Fritz, David L.; Mergel, Jürgen; Stolten, Detlef (March 14, 2013). "A comprehensive review on PEM water electrolysis". International Journal of Hydrogen Energy. 38 (12): 4901–4934. doi:10.1016/j.ijhydene.2013.01.151.
- ^ Mistry, H.; Varela, A.S.; Strasser, P.; Cuenya, B.R. (2016). "Nanostructured electrocatalysts with tunable activity and selectivity". Nature Reviews Materials. 1 (4): 1–14. Bibcode:2016NatRM...116009M. doi:10.1038/natrevmats.2016.9.
- ^ a b Kleijn, Steven E. F.; Lai, Stanley C. S.; Koper, Marc T. M.; Unwin, Patrick R. (2014-04-01). "Electrochemistry of Nanoparticles". Angewandte Chemie International Edition. 53 (14): 3558–3586. doi:10.1002/anie.201306828.
- ^ Luo, Mingchuan; Guo, Shaojun (September 26, 2017). "Strain-controlled electrocatalysis on multimetallic nanomaterials". Nature Reviews Materials. 2 (11): 17059. doi:10.1038/natrevmats.2017.59. ISSN 2058-8437.
- ^ a b c Koper, M.T.M. (2011). "Structure sensitivity and nanoscale effects in electrocatalysis". Nanoscale. The Royal Society of Chemistry. 3 (5): 2054–2073. Bibcode:2011Nanos...3.2054K. doi:10.1039/c0nr00857e. PMID 21399781.
- ^ Carmo, M.; Fritz, D.L.; Mergel, J.; Stolten, D. (2013). "A comprehensive review on PEM water electrolysis". International Journal of Hydrogen Energy. 38 (12): 4901–4934. doi:10.1016/j.ijhydene.2013.01.151.
- ^ Wang, Xin (19 January 2008). "CNTs tuned to provide electrocatalyst support". Nanotechweb.org. Archived from the original on 22 January 2009. Retrieved 27 February 2009.
- ^ a b McCreery, Richard L. (June 17, 2008). "Advanced Carbon Electrode Materials for Molecular Electrochemistry". Chemical Reviews. 108 (7): 2646–2687. doi:10.1021/cr068076m. ISSN 0009-2665.
- ^ Wildgoose, Gregory G.; Banks, Craig E.; Leventis, Henry C.; Compton, Richard G. (November 30, 2005). "Chemically Modified Carbon Nanotubes for Use in Electroanalysis". Microchimica Acta. 152 (3–4): 187–214. doi:10.1007/s00604-005-0449-x. ISSN 0026-3672.
- ^ Zhang, Qin; Zhang, Xiaoxiang; Wang, Junzhong; Wang, Congwei (2021-01-15). "Graphene-supported single-atom catalysts and applications in electrocatalysis". Nanotechnology. 32 (3): 032001. doi:10.1088/1361-6528/abbd70. ISSN 0957-4484.
- ^ Dai, Liming (June 13, 2017). "Carbon-based catalysts for metal-free electrocatalysis". Current Opinion in Electrochemistry. 4 (1): 18–25. doi:10.1016/j.coelec.2017.06.004.
- ^ a b Jiao, Long; Wang, Yang; Jiang, Hai-Long; Xu, Qiang (November 27, 2017). "Metal-Organic Frameworks as Platforms for Catalytic Applications". Advanced Materials. 30 (37): 1703663. doi:10.1002/adma.201703663.
- ^ Singh, Chanderpratap; Mukhopadhyay, Subhabrata; Hod, Idan (January 5, 2021). "Metal–organic framework derived nanomaterials for electrocatalysis: recent developments for CO2 and N2 reduction". Nano Convergence. 8 (1): 1. doi:10.1186/s40580-020-00251-6. ISSN 2196-5404. PMC 7785767. PMID 33403521.
- ^ Sharma, Rakesh Kumar; Yadav, Priya; Yadav, Manavi; Gupta, Radhika; Rana, Pooja; Srivastava, Anju; Zbořil, Radek; Varma, Rajender S.; Antonietti, Markus; Gawande, Manoj B. (2020). "Recent development of covalent organic frameworks (COFs): synthesis and catalytic (organic-electro-photo) applications". Materials Horizons. 7 (2): 411–454. doi:10.1039/C9MH00856J. ISSN 2051-6347.
- ^ Zheng, Weiran; Liu, Mengjie; Lee, Lawrence Yoon Suk (3 January 2020). "Electrochemical Instability of Metal–Organic Frameworks: In Situ Spectroelectrochemical Investigation of the Real Active Sites". ACS Catalysis. 10 (1): 81–92. doi:10.1021/acscatal.9b03790.
- ^ Kunze, Julia; Ulrich Stimming (2009). "Electrochemical Versus Heat-Engine Energy Technology: A Tribute to Wilhelm Ostwald's Visionary Statements". Angewandte Chemie International Edition. 48 (49): 9230–9237. doi:10.1002/anie.200903603. PMID 19894237.
- ^ Haverkamp, Richard (3 June 2008). "What is an electrocatalyst?" (QuickTime video and transcript). Science learning New Zealand. Retrieved 27 February 2009.
- ^ Elgrishi, Noémie; Rountree, Kelley J.; McCarthy, Brian D.; Rountree, Eric S.; Eisenhart, Thomas T.; Dempsey, Jillian L. (2018-02-13). "A Practical Beginner's Guide to Cyclic Voltammetry". Journal of Chemical Education. 95 (2): 197–206. doi:10.1021/acs.jchemed.7b00361. ISSN 0021-9584.
- ^ Pan, Fuping; Yang, Yang (2020). "Designing CO 2 reduction electrode materials by morphology and interface engineering". Energy & Environmental Science. 13 (8): 2275–2309. doi:10.1039/D0EE00900H. ISSN 1754-5692.
- ^ Harris, Mark (26 January 2009). "Booze-powered cars coming soon". techradar.com. Archived from the original on 2 March 2009. Retrieved 27 February 2009.
- ^ Sachdeva, Harshita (2020-09-30). "Recent advances in the catalytic applications of GO/rGO for green organic synthesis". Green Processing and Synthesis. 9 (1): 515–537. doi:10.1515/gps-2020-0055. ISSN 2191-9550.
- ^ Siu, Juno C.; Fu, Niankai; Lin, Song (2020-03-17). "Catalyzing Electrosynthesis: A Homogeneous Electrocatalytic Approach to Reaction Discovery". Accounts of Chemical Research. 53 (3): 547–560. doi:10.1021/acs.accounts.9b00529. ISSN 0001-4842. PMC 7245362. PMID 32077681.
- ^ Holade, Yaovi; Servat, Karine; Tingry, Sophie; Napporn, Teko W.; Remita, Hynd; Cornu, David; Kokoh, K. Boniface (2017-10-06). "Advances in Electrocatalysis for Energy Conversion and Synthesis of Organic Molecules". ChemPhysChem. 18 (19): 2573–2605. doi:10.1002/cphc.201700447. ISSN 1439-4235.







