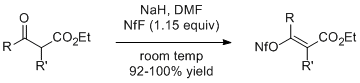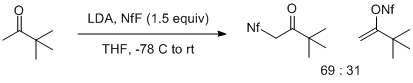페르플루오로부탄술포닐플루오르화물
Perfluorobutanesulfonyl fluoride | |
| 이름 | |
|---|---|
| 우선 IUPAC 이름 1,2,3,4,4-노나플루오로부탄-1-술포닐플루오르화물 | |
| 식별자 | |
3D 모델(JSmol) | |
| 약어 | NfF |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.006.175 |
| EC 번호 |
|
PubChem CID | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| C4F10O2S | |
| 몰 질량 | 302.09g/140 |
| 밀도 | 1.682 g/mL[1] |
| 녹는점 | -120 °C 미만(-184 °F, 153 K) |
| 비등점 | 65 ~ 66 °C (149 ~151 °F, 338 ~339 K)[2] |
| 관련 화합물 | |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
페르플루오로부탄술포닐플루오르화물(Nonafluorobutanesulforyl fluoride, NfF)은 물과 용해되지 않지만 일반적인 유기 용제에 용해되는 무색의 휘발성 액체이다.술폴란의 전기화학적 불소화에 의해 제조됩니다.NfF는 팔라듐 촉매 교차 커플링 반응에서 전자 친필로서 가치가 있는 비플루오로부탄술폰산염(nonaflates)의 진입점 역할을 합니다.NfF는 과플루오로알킬술포닐레이팅제로서 더 자주 사용되는 무수삼산에 비해 저비용과 높은 안정성의 이점을 제공한다.플루오르화물 이탈기는 아민, 페녹사이드, 에놀레이트 등의 친핵성 물질로 쉽게 치환되어 술폰아미드, 아릴노아플레이트, 알케닐노아플레이트를 각각 생성한다.단, 물의 공격을 받지 않는다(pH<12로 안정적이다).수산화바륨에 의한 가수분해는 Ba(ONF)2를 생성하며, 황산으로 처리하면 과플루오로부탄술폰산과 불용성 황산바륨을 생성한다.
정화
시판되는 NfF는 제조 과정에서 유래한 6~10몰%의 과불화황산에 오염되어 있습니다.이는 KPO와24 KHO의 농축34 수용액을 96시간 동안 1:1 몰비로 강하게 교반하여 쉽게 제거할 수 있습니다.이 처리 후 수성층을 제거하고 PO에서25 증류하면 99 mol% 이상의 NfF를 함유한 제품을 거의 양적으로 [3]회수할 수 있습니다.
아릴과 알케닐 비아프레이트의 합성
앞에서 설명한 바와 같이 팔라듐 촉매 크로스 커플링 반응에서 아릴 및 알케닐 논아플레이트는 전자 친필로서 유용하다.이들의 반응성은 일반적으로 흔히 볼 수 있는 삼산염 전자동물의 반응성을 반영하지만, 비아프레이트는 케톤(알케닐 술폰산염의 경우)과 페놀(아릴 술폰산염의 경우)에 대한 가수분해 경향이 덜하다.가수 분해에 대한 저항성으로 인해 비아프레이트가 Buckwald-Hartwig 커플링에서 우수한 전자 친필을 만들 수 있으며, 여기서 이러한 부작용은 원하는 제품의 [4]수율에 유해할 수 있습니다.
β-케토에스테르의 나트륨 에놀레이트는 1.15 당량의 NfF와 반응하여 해당 알케닐 비아프레이트를 높은 수율로 생성한다.에틸 2-메틸아세테이트(R=R'=Me)는 기하학적으로 순수한 E 이성체를 제공한다.[5]
단순 알데히드 및 케톤은 DBU 또는 포스파젠과 같은 염기의 존재 하에서 NfF와 반응하여 이산 에놀레이트를 형성하지 않고 높은 수율로 알케닐 노아플레이트를 생성한다.P포스파젠 염기를2 -30~20°C에서 사용하면 덜 치환된 알케닐 비아프레이트와 비대칭 치환된 [3]케톤을 얻을 수 있다.삼산 무수물과 유사한 반응을 보이려면 일반적으로 높은 수율을 달성하기 위해 고가의 2,6-di-tert-부틸피리딘을 사용해야 한다.
에놀레이트와 NfF의 반응은 에놀레이트의 구조와 그 금속 대향소 둘 다에 의해 크게 좌우됩니다.메틸케톤의 리튬 에놀레이트는 에놀레이트의 O(예상치 않은) 또는 C(예상치 않은) 원자에 대한 친전자 공격에서 파생된 생성물의 혼합물을 제공합니다.이러한 효과는 특히 Pinacolone의 리튬 에놀라트(enolate)에서 뚜렷하게 나타나며, 이는 C-공격에 유리한 2:1 혼합물을 제공합니다.보다 치환된 리튬 에놀레이트는 가변 [6]수율에서 O 술포닐화 생성물만 제공합니다.
트리메틸실릴에놀에테르와 NfF는 주변온도에 대해 0°C의 준이성계 불소원 존재 하에서 반응하여 적당한 수율에서 양호한 수율로 알케닐노아플레이트를 생성한다.건조 [6]BuF는4 한 연구에서 선호되는 불소 공급원이었지만,[7] CsF는 어려운 경우에 사용되어 우수한 결과를 얻었다.
아릴노아플레이트는 탄산칼륨[8] 및3[4] EtN 등의 염기의 존재 하에서 페놀 및 NfF로부터 거의 정량적인 수율로 직접 제조할 수 있다.NaH나[9] BuLi와 같은 더 강한 염기도 사용할 수 있지만, 그들은 다소 낮은 수율을 주는 경향이 있다.
알코올과의 반응
NfF와 알코올의 반응은 알킬 비아프레이트의 가능성을 강조합니다. 대부분의 경우 반응의 최종 산물은 플루오르화 알킬(중간 알킬 비아프레이트에 대한 F 공격−) 또는 올레핀(중간 비아프레이트에서 NfOH를 제거함)입니다.
비스-노플루오로부탄술포니미드(NfNH2) 합성
NfF는 아세토니트릴에 트리에틸아민이 존재하는 상태에서 염화암모늄과 반응하여 초산성 비스-노플루오로부탄술포니미드의 트리에틸암모늄염을 97%의 수율로 얻는다.해당 칼륨염은 트리에틸암모늄염의 메타놀 용액을 [10]KOH로 처리하여 얻는다.이 산은 트리에틸암모늄염의 이온 교환 크로마토그래피와 Amberlite IR-100, 메탄올을 용리제로 [11]하여 얻어진다.후자의 과정에서 생성된 실제 종은 MeOH NfN일2− 가능성이2+ 높다.
레퍼런스
- ^ "Perfluoro-1-butanesulfonyl fluoride". Retrieved 22 July 2012.
- ^ "1,1,2,2,3,3,4,4,4-nonafluorobutane-1-sulphonyl fluoride". National Institute of Standards and Technology. Retrieved 22 July 2012.
- ^ a b Vogel, Michael A. K.; Christian B. W. Stark; Ilya M. Lyapkalo (2007). "A Straightforward Synthesis of Alkenyl Nonaflates from Carbonyl Compounds Using Nonafluorobutane-1-sulfonyl Fluoride in Combination with Phosphazene Bases". Synlett. 2007 (EFirst): 2907–2911. doi:10.1055/s-2007-991084. ISSN 0936-5214.
- ^ a b Meadows, Rebecca E.; Simon Woodward (2008-02-11). "Steric effects in palladium-catalysed amination of aryl triflates and nonaflates with the primary amines PhCH(R)NH2 (R=H, Me)". Tetrahedron. 64 (7): 1218–1224. doi:10.1016/j.tet.2007.11.074. ISSN 0040-4020.
- ^ Bellina, Fabio; Donatella Ciucci; Renzo Rossi; Piergiorgio Vergamini (1999-02-12). "Synthesis of vinyl nonaflates derived from β-ketoesters, β-diketones or α-diketones and their palladium-catalyzed cross-coupling reactions with organozinc halides". Tetrahedron. 55 (7): 2103–2112. doi:10.1016/S0040-4020(98)01221-6. ISSN 0040-4020.
- ^ a b Lyapkalo, Ilya M.; Matthias Webel; Hans-Ulrich Reißig (2002). "An Expedient and Stereoselective Synthesis of Alkenyl Nonaflates from Silyl Enol Ethers: Optimization, Scope and Limitations". European Journal of Organic Chemistry. 2002 (6): 1015–1025. doi:10.1002/1099-0690(200203)2002:6<1015::AID-EJOC1015>3.0.CO;2-K. ISSN 1099-0690.
- ^ Bräse, Stefan (1999). "Synthesis of Bis(enolnonaflates) and their 4-exo-trig-Cyclizations by Intramolecular Heck Reactions". Synlett. 1999 (10): 1654–1656. doi:10.1055/s-1999-2892. ISSN 0936-5214.
- ^ Shekhar, Shashank; Travis B. Dunn; Brian J. Kotecki; Donna K. Montavon; Steven C. Cullen (2011). "A General Method for Palladium-Catalyzed Reactions of Primary Sulfonamides with Aryl Nonaflates". J. Org. Chem. 76 (11): 4552–4563. doi:10.1021/jo200443u. ISSN 0022-3263. PMID 21510695.
- ^ Uemura, Minoru; Hideki Yorimitsu; Koichiro Oshima (2008-02-18). "Cp∗Li as a base: application to palladium-catalyzed cross-coupling reaction of aryl-X or alkenyl-X (X=I, Br, OTf, ONf) with terminal acetylenes". Tetrahedron. 64 (8): 1829–1833. doi:10.1016/j.tet.2007.11.095. hdl:2433/88969. ISSN 0040-4020.
- ^ Quek, Ser Kiang; Ilya M. Lyapkalo; Han Vinh Huynh (2006-03-27). "Synthesis and properties of N,N′-dialkylimidazolium bis(nonafluorobutane-1-sulfonyl)imides: a new subfamily of ionic liquids". Tetrahedron. 62 (13): 3137–3145. doi:10.1016/j.tet.2006.01.015. ISSN 0040-4020.
- ^ Hashmi, A. Stephen K.; Tobias Hengst; Christian Lothschütz; Frank Rominger (2010). "New and Easily Accessible Nitrogen Acyclic Gold(I) Carbenes: Structure and Application in the Gold-Catalyzed Phenol Synthesis as well as the Hydration of Alkynes". Advanced Synthesis & Catalysis. 352 (8): 1315–1337. doi:10.1002/adsc.201000126. ISSN 1615-4169.