파라메손프릭 덕트
Paramesonephric duct| 파라메손프릭 덕트 | |
|---|---|
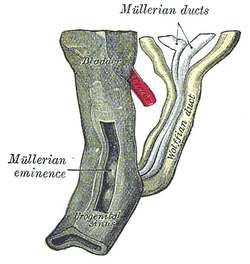 | |
 8주 반부터 9주까지 인간 배아의 꼬리 끝. | |
| 세부 사항 | |
| 카네기 무대 | 17 |
| 전구체 | 중간 중간 중간자 |
| 식별자 | |
| 라틴어 | 도토스 파라메손프리쿠스 |
| 메슈 | D009095 |
| TE | duct_by_E5.7.2.3.0.0.3 E5.7.2.3.0.0.3 |
| 해부학적 용어 | |
파라메손프릭 덕트(또는 뮐러 덕트)는 태아의 쌍체 덕트로서, 요로성 능선의 횡측면을 타고 내려가 원시 요로성 부비동맥동의 부비동결절에서 종착한다. 암컷에서는 나팔관, 자궁, 자궁, 자궁경부, 그리고 질 윗부분의 1/3을 형성하도록 발달할 것이다.
개발
여성 생식 체계는 두 개의 발생학적 부분으로 구성되어 있다: 요산성 부비동과 파라메손프릭 덕트. 두 사람은 정맥동결절에 결합되어 있다.[1][2] 파라메손프릭 덕트는 남녀의 배아에 존재한다.[2][3] 암컷에서만 생식기로 발달한다. 그들은 특정 종의 수컷에서 퇴화하지만, 인접한 중뇌 도관은 수컷의 생식기로 발달한다. 생식기에 대한 파라메손프릭 도관의 기여에 있어서 성별에 기초한 차이는 뮐러식 억제 인자의 존재와 존재 정도에 기초한다.
생식계통이 형성되는 동안 파라메손프릭 덕트는 수정 후 6주 후에 암컷과 수컷 배아 양쪽의 중상피 덕트에 바로 측면으로 형성된다. 이 기간 동안 원시 세균 세포는 노른자 주머니에서 고나달 능선으로 이동한다. 메소네프로스에서 발생하여 평행하게 흐르는 메센키메의 영역이다. 파라메손프릭 덕트는 세 번째 흉부에서 요골정맥동의 후벽까지 이어지는 굵은 코엘로믹 상피 리본이 두개골 삽입에 의해 형성된다. 파라메손프릭 덕트의 카우달 부분은 축농성결핵에서 요로상동맥동의 등측면으로 직접 내측으로 흐르기 전에 자궁내막 영장류라고 알려진 단일 튜브로 융합된다.
뮐러방지호르몬
The development of the paramesonephric (Müllerian) ducts is controlled by the presence or absence of anti-Müllerian hormone (AMH; also known as Müllerian-inhibiting substance, "MIF" for "Müllerian-inhibiting factor", "MIH" for "Müllerian-inhibiting hormone", or "APH" for anti-paramesonephric hormone).[4][5]
| 수태생식 | 개발 중인 고환에서 AMH가 생성되어 파라메손피크 덕트가 퇴행한다. | 교란은 뮐러 덕트 증후군을 지속시킬 수 있다. | 도관은 흔적 질 남성성과 맹장 고환을 제외하고는 사라진다. |
| 여성 발생증 | AMH의 부재는 자궁관, 자궁, 질 상부 2/3으로 파라메손피관이 발달하는 결과를 낳는다. | 발달장애는 자궁 부재(뮐러 아제네시스)나 자궁 기형을 유발할 수 있다. | 덕트는 위 질, 자궁, 자궁관으로 발달한다. |
AMH는 SRY 발현에 대응하여 형태적 분화를 시작할 때 남성에게서 지속적 세포(세르톨리 세포)에 의해 분비되는 당단백질 호르몬이다. AMH는 8주경에 분비되기 시작하며, 이는 8주에서 10주 사이에 파라메손프릭 덕트가 매우 빠르게 퇴행하게 한다. 그러나 작은 파라메손프릭 덕트는 여전히 확인될 수 있으며, 그 잔해는 고환과 연관된 조직의 작은 캡인 맹장 고환에 위치한 성인 남성에서 검출할 수 있다. 파라메손프릭 덕트의 잔해물도 정수리 중심부에 있는 전립요도의 팽창인 전립유티클에서 발견될 수 있다.
Misr-II라고도 알려진 AMH 수용체형 II(AMHR-II)는 AMH가 덕트의 상피에 직접 작용하기보다는 파라메손프릭 덕트를 둘러싼 중피세포에 간접적으로 작용하게 한다.[6] 이 수용체 활성화는 덕트가 퇴행하도록 유도한다. 메센치메 대 에피델리알 신호의 중요성은 메센치메에서 AMHR-II 표현을 유지하는 것이다. 덕트가 퇴행함에 따라 덕트 상피 내에 Wnta7a가 없을 경우 덕트 AMHR-II 표현은 상실되고, 남아 있는 파라메손프릭 덕트는 남성에게 유지되어 요로체계가 떨어져 나가게 된다.
AMH와 AMHR-II 유전자 돌연변이로 인해 인간 남성에서 구강 헤르니아를 동반한 암호 해독증(무경화 고환) 또는 extopic testis가 확인되었다. 연구 결과 AMH가 TgfB/Bmp 가족 구성원인 것을 근거로 또 다른 AMH 수용체 집단인 AMH 수용체형 I(AMHR-I)가 밝혀졌다. 연구에 따르면 알크2, 알크3(또는 Bmpr1a), 알크6은 모두 AMHR-I 수용체 역할을 한다. 파라메손프릭 덕트 중간합금 내 생쥐에서 이러한 수용체가 막히거나 녹아웃되면 AMH 유도 파라메손프릭 덕트 회귀 분석은 상실된다.
함수
암컷의 경우 파라메손프릭 덕트는 자궁관, 자궁, 질 윗부분이 생기며, 중피관은 남성 안드로겐의 부재로 퇴화한다. 이와는 대조적으로, 파라메손프릭 덕트는 앞서 언급한 구조들을 형성하기 위해 두개골-주발적 진행으로 증식하고 분화하기 시작한다. 이 시기에 단층 파라메손피질 상피질은 자궁관의 각질상피에서부터 질 내의 층화된 편평상피에 이르기까지 다른 구조로 구분된다.[6]
파라메손프릭 덕트와 메손프릭 덕트는 홉스 유전자 발현으로 인해 같은 중간크기의 대부분을 공유한다. 표현된 유전자는 여성 생식관의 두개골-카우달 축을 따라 발견되는 구조물의 지역적 특성화를 매개하는 데 중요한 역할을 한다.
임상적 유의성
AMH의 돌연변이
46, XY이며 AMH 또는 AMH 수용체 유전자의 돌연변이에 양성반응을 보인 개인은 파라메손프릭 덕트가 퇴행하지 못하여 지속성 뮐러 덕트 증후군에 나타나는 특징을 보이는 것으로 알려져 있다. 이런 일이 일어날 때 개인은 파라메손피크 덕트에서 파생된 구조와 또한 중간피크 덕트에서 파생된 구조물을 개발한다. 뮐러식 덕트 증후군이 지속되는 수컷은 상부 질, 자궁, 자궁관뿐 아니라 덕터스 배변도 남성 외부 성기와 함께 있을 수 있다. 여성 장기는 정확한 해부학적 위치에 있지만 고환의 위치는 다양하다. 검출된 사례의 60~70%는 두 고환이 난소의 정상적인 위치에 놓여질 것이다. 약 20~30%는 고환 중 하나가 난자낭 내에 있는 반면, 다른 경우에는 두 고환이 동일한 난자낭 내에 놓여질 것이다. 그러나 개인이 지속적인 뮐러 덕트 증후군을 보일 때마다 덕터스 배변은 자궁의 측면부를 따라 흐를 것이다.[6]
파라메손프릭 덕트 이상
파라메손프릭 덕트 시스템 내에서 발생하는 이상현상은 산부인과 의사들과 산부인과 의사들을 계속해서 퍼즐로 만들고 매혹시킨다. 파라손피관은 여성 생식관에 중요한 역할을 하며 자궁경관뿐만 아니라 자궁관, 자궁, 우수한 질까지 형성하기 위해 분화한다. 자궁과 질 아젠다에서부터 자궁과 질에서 원치 않는 세포의 복제에 이르기까지 이 체계가 교란될 때 많은 종류의 장애가 발생할 수 있다. 파라메손프릭 기형은 대개 신골격계 및 축골격계 이상과 관련이 있다.[6] 난소의 오작동 및 노화 시작 이상현상도 대부분의 파라메손프릭 덕트와 연관될 수 있다. 대부분의 이상 증상은 외부 성기가 더 이상 가면을 쓰지 않고 내부 생식기관 이상이 드러나면 인식되는 경우가 많다. 매우 광범위한 이상 현상으로 인해 파라메손프릭 덕트 이상을 진단하는 것은 매우 어렵다.[7]
수술 기구와 기술 향상으로 인해 파라메손피리성 이상 여성이 정상적인 성관계를 가질 수 있다. 베키에티와 엠클도 절차를 통해 여성들이 성행위를 할 수 있다.[7] 또 다른 관점에서, 많은 다른 외과적 발전은 산부인과 결과뿐만 아니라 출산 가능성을 엄청나게 향상시켰다. 보조 생식기술은 파라메손피질 도관 이상을 가진 일부 여성들이 건강한 아기를 임신하고 출산하는 것을 가능하게 한다.
역사
그것들은 1830년 "Bildungsgeschichte der Genalien"이라는 글에서 이러한 관을 설명한 생리학자 요하네스 피터 뮐러의 이름을 따서 이름 지어졌다.
참고 항목
참조
- ^ Yasmin Sajjad (2011-07-27). "Development of the genital ducts and external genitalia in the early human embryo". The Journal of Obstetrics and Gynaecology Research. 36 (5): 929–937. doi:10.1111/j.1447-0756.2010.01272.x. PMID 20846260. S2CID 27710882.
- ^ a b Moore, Keith; Persaud, T; Torchia, Mark (2013). The Developing Human: Clinically Oriented Embryology (9 ed.). Philadelphia: Elsevier Saunders. pp. 269–271. ISBN 978-1-4377-2002-0.
- ^ Rey R, Grinspon R (2011-07-27). "Normal male sexual differentiation and aetiology of disorders of sex development". Male Reproductive Endocrinology. 25 (2): 221–238. doi:10.1016/j.beem.2010.08.013. PMID 21397195.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ Ball B, Conley A, Grundy S, Sabeur K, Liu I (27 July 2011). "Expression of anti-Mullerian hormone (AMH) in the equine testis". Theriogenology. 69 (5): 624–631. doi:10.1016/j.theriogenology.2007.11.009. PMID 18242669.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ Minkoff, Eli; Baker, Pamela (2004). Biology Today: An Issues Approach (Third ed.). New York: Garland Science. p. 296. ISBN 1136838759.
- ^ a b c d Schoenwolf, Gary C. (2008). Larsen's Human Embryology. Churchill Livingstone. pp. 509, 510504, 518, 520. ISBN 9780443068119.
- ^ a b Amesse, Ibrahim. "Mullerian Duct Anomalies". Retrieved 2012-11-29.
외부 링크
- 성기-010—North Carolina 대학의 엠브리오 이미지
- 신체의 작동 방식/성 발달/성별 차별화/덕트 차별화 - 아픈 어린이들을 위한 병원(GTA - 토론토, 캐나다 온타리오)
- 뮐러 덕트 이상 현상
- 뮐러 덕트

