리신2,3-아미노무타아제
Lysine 2,3-aminomutase| 리신2,3-아미노무타아제 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| EC 번호 | 5.4.3.2 | ||||||||
| CAS 번호 | 9075-20-1 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| |||||||||
리신 2,3-아미노무타아제(KAM 또는 LAM)(EC 5.4.3.2)는 아미노산 리신의 베타 [1][2]리신으로의 전환을 촉진하는 래디칼 SAM 효소이다.[3][4] S-아데노실 메티오닌(SAM) 활성화 래디칼 반응 [1]경로에서 형성된 3개의 보조 인자와 5'-디옥시아데노실 래디칼을 사용하여 이러한 상호 변환을 달성한다.일반화된 반응은 다음과 같습니다.
구조.
오른쪽은 리신 2,3-아미노무타아제 단백질의 3차원 구조이다.이 구조는 X선 결정학에서 2.1 앵스트롬 분해능으로 결정되었으며 호모테트라머로 [2]결정되는 것으로 확인되었다.KAM은 리신 대사 연구를 위해 클로스트리듐 서브 말단에서 먼저 정제되고 특성화되었다.
보조 요인
리신 2,3-아미노무타아제 효소에 의해 촉매되는 반응에는 4가지 핵심 보조인자가 필요하다.다음과 같은 것이 있습니다.
- S-아데노실메티오닌(SAM): [5]전자를 빌려 래디칼 중간체를 생성하는데 도움이 됩니다.
- PLP(Pyridoxal phosphate): 반응 중 아미노산의 결합을 담당합니다.이 분자의 pi-system은 아지리디닐 라디칼의 형성 동안 급진적인 탈국소화를 촉진한다.구조는 다음과 같습니다.
- 아연 금속: 단백질 내 이합체 간의 조정에 필요합니다.
- 철-황 클러스터: 5'-디옥시아데노실 라디칼을 형성하기 위해서는 4철-4황 클러스터가 필요하다.이 라디칼은 반응 메커니즘에서 아미노산으로 전달되는 "안정적인" 라디칼 운반체 역할을 합니다.
반응 메커니즘
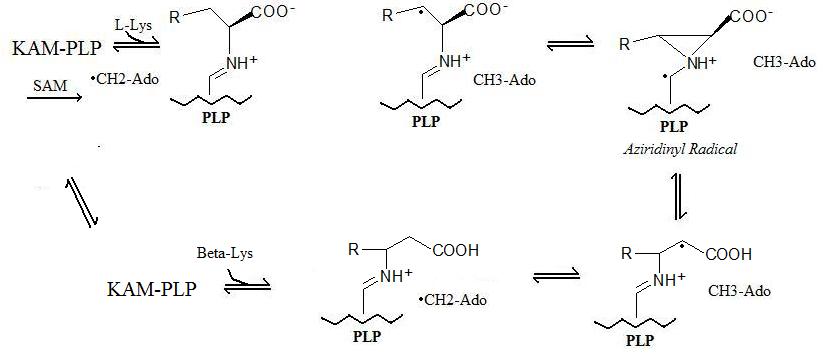
일반화된 반응은 5단계로 이루어집니다.
- 래디칼 형성: S-아데노실 메티오닌이 5'-디옥시아데노실 래디칼을 형성하는 래디칼 SAM 메커니즘을 통해 "안정적인" 래디칼을 형성한다.
- 효소 결합:리신 2,3-아미노무타아제는 피리독살 인산염(PLP)에 결합한다.
- 아미노산 결합:아미노산(전방향 또는 역방향 반응에 따라 리신 또는 베타-리신)은 피리독살 인산염에 결합한다.
- 래디컬 전송:5'-디옥시아데노실라디칼은 아미노산으로 전달되어 아지리디닐라디칼이 형성된다.이 형태에서 라디칼은 인산피리독살 파이계에 의해 안정화된다.
- 아미노산 변환:마지막 단계에서는 새로운 아미노산을 형성하고 5'-디옥시아데노실 상에서 보다 안정된 상태로 되돌린다.
위에서 설명한 반응 메커니즘은 다음과 같습니다.
레퍼런스
- ^ Frey PA (May 1993). "Lysine 2,3-aminomutase: is adenosylmethionine a poor man's adenosylcobalamin?". FASEB Journal. 7 (8): 662–70. doi:10.1096/fasebj.7.8.8500691. PMID 8500691. S2CID 33374466.
- ^ Lepore BW, Ruzicka FJ, Frey PA, Ringe D (September 2005). "The x-ray crystal structure of lysine-2,3-aminomutase from Clostridium subterminale". Proceedings of the National Academy of Sciences of the United States of America. 102 (39): 13819–24. Bibcode:2005PNAS..10213819L. doi:10.1073/pnas.0505726102. PMC 1236562. PMID 16166264.
- ^ Aberhart DJ, Gould SJ, Lin HJ, Thiruvengadam TK, Weiller BH (1981). "Stereochemistry of lysine 2,3-aminomutase". J. Am. Chem. Soc. 103 (22): 6750–6752. doi:10.1021/ja00412a040.
- ^ Zappia V, Barker HA (June 1970). "Studies on lysine-2,3-aminomutase. Subunit structure and sulfhydryl groups". Biochimica et Biophysica Acta. 207 (3): 505–13. doi:10.1016/s0005-2795(70)80013-7. PMID 5452674.
- ^ Bhandari DM, Fedoseyenko D, Begley TP (2018). "Mechanistic Studies on the Radical SAM Enzyme Tryptophan Lyase (NosL)". Radical SAM Enzymes. Methods in Enzymology. Vol. 606. pp. 155–178. doi:10.1016/bs.mie.2018.06.008. ISBN 9780128127940. PMID 30097091.
외부 링크
- 미국 국립 의학 도서관 의학 주제 제목(MeSH)의 Lysine+2,3-aminomutase