데스마르틴피오르이난
Dess–Martin periodinane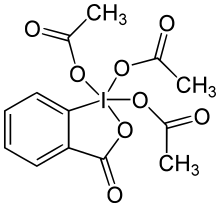 | |
 | |
| 이름 | |
|---|---|
| 기본 설정 IUPAC 이름 3-Oxo-1λ5,2-benziodoxole-1,1,1(3H)-triyl triacetate | |
| 기타이름 데스마르틴피오르이난 | |
| 식별자 | |
3D 모델(Jsmol) | |
| 켐스파이더 | |
| ECHA 인포카드 | 100.197.885 |
펍켐 CID | |
| 유니아이 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C13H13IO8 | |
| 어금니 질량 | 424.14 g/mol |
| 외모 | 흰 가루, 칩, 수정 또는 결정체 가루 및/또는 덩어리 |
| 밀도 | 1.362 g/cm3 solid |
| 융점 | 103 to 133 °C (217 to 271 °F; 376 to 406 K) |
| 관련 화합물 | |
관련 화합물 | 2-요오드옥시벤조산 |
달리 명시된 경우를 제외하고는 표준 상태(25°C [77°F], 100kPa)에 있는 재료에 대한 데이터가 제공됩니다. | |
DMP(Dess-Martin periodinane)는 Dess-Martin 산화에 사용되는 화학 시약으로, 1차 알코올을 알데히드로, 2차 알코올을 케톤으로 산화시킵니다.[1][2] 이 페리오디난은 크롬 및 DMSO 기반 산화제에 비해 몇 가지 이점을 가지고 있으며, 여기에는 더 온화한 조건(실온, 중성 pH), 더 짧은 반응 시간, 더 높은 수율, 단순화된 작업, 높은 화학 선택성, 민감한 작용기의 내성 및 긴 저장 수명이 포함됩니다. 그러나 비용과 잠재적인 폭발성으로 인해 산업 규모에서 사용하기가 어렵습니다.[3] 1983년 시약을 개발한 미국의 화학자 다니엘 벤자민 데스와 제임스 컬렌 마틴의 이름을 따서 지어졌습니다. IBX를 기반으로 하지만 중심 요오드 원자에 붙은 아세테이트 그룹으로 인해 DMP는 IBX보다 훨씬 반응성이 높고 유기 용매에 훨씬 잘 녹습니다.[4]
준비
IBX의 가장 친근한 합성은 물에서 2-요오드벤조산을 옥손과 함께 3시간 동안 고온에서 처리하는 것으로 결정되었습니다.[5] 그런 다음 원래 절차에서 아일랜드와 Liu의 수정을 사용하여 IBX를 아실화합니다. 이러한 수정을 통해 더 높은 수율과 단순화된 워크업 절차가 가능했습니다. 생성된 고체는 여과 및 에테르로 세척하여 얻을 수 있습니다. 아일랜드와 Liu는 촉매량의 토실산을 사용하여 반응이 2시간 이내에 완료될 수 있었고(기존 합성에 비해 24시간 사용) 90%를 초과하는 수율로 완료되었습니다.
R. K. Boeckman과 J. J. Mullins가[7] 제시한 고전적인 방법은 IBX(1-하이드록시-1,2-벤조옥솔-3(1H)-1-옥사이드,2-아이오도벤조산)를 공급하기 위해 브롬산칼륨, 황산, 2-아이오도벤조산 용액을 가열하는 것이었습니다. 그런 다음 IBX를 아세트산과 아세트산 무수물을 사용하여 아실화했습니다.
구조.
Dess-Martin periodinane은 기본 위치에 4개의 헤테로 원자와 1개의 정점 페닐 그룹이 있는 정사각형 피라미드 기하학을 가지고 있습니다.
산화 메커니즘
Dess–Martin periodinane은 주로 복합적이고 민감하며 다기능적인 알코올의 산화제로 사용됩니다. 그 효과의 이유 중 하나는 알코올이 리간드 교환을 빠르게 할 수 있게 해주는 하이드록실기의 착화에 대한 높은 선택성 때문입니다. 산화 반응의 첫 단계입니다.
양성자 NMR은 1당량의 알코올을 사용하면 중간체인 디아세톡시알콕시피로디난을 형성한다는 것을 나타냈습니다. 그런 다음 아세테이트는 알코올로부터 α-H를 탈양성자화하여 카르보닐 화합물, 요오디난 및 아세트산을 공급하는 염기 역할을 합니다.
디올이나 1당량 이상의 알코올을 사용하면 대신 아세톡시디알콕시피로디난이 생성됩니다. 이 특정한 페리오디난의 불안정한 특성 때문에 산화가 훨씬 더 빨리 일어납니다.[4]
슈라이버와 동료들은 물이 산화 반응의 속도를 증가시킨다는 것을 보여주었습니다.[8] Dess와 Martin은 원래 에탄올의 추가 당량이 있을 때 에탄올의 산화가 증가하는 것을 관찰했습니다. 하이드록실기의 전자 공여 능력(따라서 I-OAc 결합을 약화시키는 것) 때문에 요오드로부터 최종 아세테이트 리간드의 해리 속도가 증가하는 것으로 생각됩니다.[4]
화학선택성
표준 Dess-Martin periodinane 조건을 사용하면 알코올이 푸란 고리, 황화물, 비닐 에테르 및 2차 아미드에 영향을 미치지 않고 알데히드/케톤으로 산화될 수 있습니다.[4] 일반적으로 일반적인 산화제를 사용하여 각각의 카르보닐로 전환하기 어려운 DMP를 사용하여 알릴 알코올을 쉽게 산화시킵니다.[9]
Myers와 동료들은 DMP가 에피머화(Swern oxidation을 포함한 대부분의 다른 산화제와 달리) 없이 N-보호된 아미노 알코올을 산화시킬 수 있다고 결정했습니다. 이러한 보호된 아미노 알코올은 제약 산업에서 매우 중요할 수 있습니다.[10]
벤질 및 알릴 알코올은 포화 알코올보다 더 빠르게 반응하는 반면,[4] DMP는 알독심 및 케톡심을 각각의 알데히드 및 케톤으로 산화시켜 각각의 카르보닐로 1차, 2차 또는 벤질 알코올보다 더 빠르게 반응합니다.[11]
Dess-Martin 산화의 한 예는 민감한 α-β-불포화 알코올을 상응하는 알데히드로 변형시키는 것을 포함합니다. 이 부분은 여러 천연 제품에서 발견되었으며 기능성이 높기 때문에 유기 합성에서 귀중한 합성 구성 요소가 될 수 있습니다. Thongsonkleeb와 Danheiser는 Dess Martin Oxidation을 사용하고 워크업 절차를 변경하여 반응 과정에서 생성된 아세트산을 제거하고 증류를 통해 여과 및 농축하여 이 민감한 알코올을 산화시켰습니다.[12]
t-Butyl DMP
디플루오로와 모노플루오로 알코올은 산화되기가 더 어렵습니다. 스완 산화가 사용되었지만, 과량의 산화제를 사용해야 했고, 어떤 경우에는 재현 가능한 결과를 제공하지 못했습니다. Linderman and Graves는[13] DMP가 대부분의 경우에 성공적이었지만 알코올에 친핵성 작용기가 존재하는 것을 견딜 수 없다는 것을 발견했습니다. 이들은 아세테이트를 대체함으로써 DMP와 반응했기 때문입니다. 아래에 표시된 화합물을 사용하면 입체 벌크로 인해 tert-butoxy 그룹을 추가하면 이러한 부반응이 최소화되므로 원하는 카르보닐을 높은 수율로 생성할 수 있습니다.
참고 항목
- 알코올 산화
- 클로로크롬산피리디늄
- 존스 산화
- 오페나우어 산화
- 피츠너-모팻 산화
- 파리크-도링 산화
- 올브라이트-골드만 산화
- 스완 산화
- 코리-김산화
- 레이 산화(TPAP 산화)
- TEMPO 산화
참고문헌
- ^ Dess, D. B.; Martin, J. C. (1983). "Readily accessible 12-I-5 oxidant for the conversion of primary and secondary alcohols to aldehydes and ketones". J. Org. Chem. 48 (22): 4155–4156. doi:10.1021/jo00170a070.
- ^ Boeckman, Robert J.; George, Kelly M. (2009). "1,1,1-Triacetoxy-1,1-dihydro-1,2-benziodoxol-3(1H)-one". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rt157m.pub2. ISBN 978-0471936237.
- ^ Plumb, J.B.; Harper, D.J. (1990). "Chemical Safety: 2-Iodoxybenzoic acid". Chem. Eng. News. 68: 3. doi:10.1021/cen-v068n029.p002.
- ^ a b c d e Dess, D. B.; Martin, J. C. (1991). "A useful 12-I-5 triacetoxyperiodinane (the Dess-Martin periodinane) for the selective oxidation of primary or secondary alcohols and a variety of related 12-I-5 species". J. Am. Chem. Soc. 113 (19): 7277–7287. doi:10.1021/ja00019a027.
- ^ Frigerio, M.; Santagostino, M.; Sputore, S. (1999). "A User-Friendly Entry to 2-Iodoxybenzoic Acid (IBX)". J. Org. Chem. 64 (12): 4537–4538. doi:10.1021/jo9824596.
- ^ Ireland, R. E.; Liu, L. (1993). "An improved procedure for the preparation of the Dess-Martin periodinane". J. Org. Chem. 58 (10): 2899. doi:10.1021/jo00062a040.
- ^ Boeckman Jr., R. K.; Shao, P.; Mullins, J. J. (2004). "The Dess-Martin Periodinane". Organic Syntheses.; Collective Volume, vol. 10, p. 696
- ^ Meyer, S. D.; Schreiber, S. L. (1994). "Acceleration of the Dess-Martin Oxidation by Water". J. Org. Chem. 59 (24): 7549–7552. doi:10.1021/jo00103a067.
- ^ Lawrence, N.J.; Crump, J.P.; McGown, A.T.; Hadfield, J.A. (2001). "Reaction of Baylis-Hillman products with Swern and Dess-Martin oxidants". Tetrahedron Lett. 42 (23): 3939–3941. doi:10.1016/S0040-4039(01)00587-1.
- ^ Myers, A.G.; et al. (2000). "Synthesis of highly epimerizable N-protected _-amino aldehydes of high enantiomeric excess". Tetrahedron Lett. 41: 1359. doi:10.1016/S0040-4039(99)02293-5.
- ^ Chaudhari, S.S.; Akamanchi, K.G. (1999). "A mild, chemoselective, oxidative method for deoximation using Dess-Martin periodinane". Synthesis. 1999 (5): 760–764. doi:10.1055/s-1999-3476.
- ^ Thongsornkleeb, C.; Danheiser, R.L. (2005). "A Practical Method for the Synthesis of 2-Alkynylpropenals". J. Org. Chem. 70 (6): 2364–2367. doi:10.1021/jo047869a. PMC 2897060. PMID 15760233.
- ^ Linderman, R.J.; Graves, D.M. (1989). "Oxidation of Fluoroalkyl-Substituted Carbinols by the Dess-Martin reagent". J. Org. Chem. 54 (3): 661–668. doi:10.1021/jo00264a029.









