과산화모노황산칼륨
Potassium peroxymonosulfate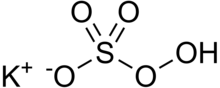 | |
| 이름 | |
|---|---|
| IUPAC 이름 과산화황산칼륨 | |
| 기타 이름 | |
| 식별자 | |
| |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.030.158 |
펍켐 CID | |
| 유니 |
|
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| KHSO5 | |
| 어금질량 | 152.2 g/m³ (614.76 g/m³ 3중 소금) |
| 외관 | 오프화이트 파우더 |
| 디컴포스 | |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | 산화제, 부식성 |
| NFPA 704(화재 다이아몬드) | |
| 안전 데이터 시트(SDS) | 드구사 카루아트 MSDS |
| 관련 화합물 | |
관련 화합물 | 과황산칼륨 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
과산화모노황산칼륨은 산화제로 널리 사용된다. 과록시모노술푸르산의 칼륨염이다. 보통 과산화모노황산칼륨은 옥소라고 알려진 삼중소금을 말한다.
과산화모노황산칼륨의 표준 전극 전위는 +1.81V이며,[5] 황산수소를 생성하는 반작용(pH = 0):
- HSO5− + 2 H+ + 2− e → HSO4− + HO2
옥소네
과산화모노황산칼륨(peroxymonosulfate per se)은 비교적 잘 알려지지 않은 소금이지만, 옥소라고 불리는 그 파생상품은 상업적 가치가 있다. 옥소는 3중염 2KHSO·5KHSO·4KSO를24 말하며, 옥소는 과산화모노황산칼륨보다 유통기한이 길다. 흰색, 수용성 고체, 황소는 매달 산화력의 1%를 잃는다.[6]
생산
옥손은 과산화수소와 오일을 혼합해 현장에서 생성되는 과산화황산으로부터 생산된다. 수산화칼륨으로 이 용액을 조심스럽게 중성화시키면 삼중소금의 결정화가 가능하다.
사용하다
청소
황소는 청소용으로 널리 쓰인다. 틀니를 희게 하고,[7] 수영장을 소독하고, 마이크로 전자공학 제조용 칩을 세척한다.[7][8][9]
유기 화학
옥소네는 유기합성에 있어서 다용도 산화제다. 그것은 알데히드를 카복실산으로 산화시킨다. 알코올 용제가 있는 곳에서 에스테르를 얻을 수 있다.[10] 내부 연골은 2개의 카르복실산(아래 참조)으로 분할할 수 있으며, 단자 연골은 에폭시화 할 수 있다. 황화물은 황화를, 제3의 아민은 아민산화를, 인산염은 인산산염을 낸다.
이 소금의 산화력을 더 잘 보여주는 것은 아세리딘 유도체를 해당 아세리딘-N-산화물로 변환한 것이다.[11]
옥소는 황화물을 황산화물로 산화시킨 다음 황화물로 산화시킨다.[12]
옥소네는 케톤을 다이옥시레인으로 변환한다. 아세톤으로부터의 디메틸디오시라네(DMDO) 합성이 대표적이다. 다이옥시레인은 다용도 산화제로 올레핀의 에폭시드를 위해 사용될 수 있다. 특히 출발 케톤이 치랄인 경우 에폭시드가 항항증적으로 생성될 수 있어 시 에폭시드의 기초를 형성한다.[13]
참조
- ^ Wu, Mingsong; Xu, Xinyang; Xu, Xun (November 2014). "Algicidal and Bactericidal Effect of Potassium Monopersulfate Compound on Eutrophic Water". Applied Mechanics and Materials. 707: 259. doi:10.4028/www.scientific.net/AMM.707.259.
- ^ Pool School. Trouble Free Pool. p. PT4. Retrieved November 30, 2018.
- ^ Dull, Harold (2004). Watsu: Freeing the Body in Water. p. 197. ISBN 9781412034395. Retrieved November 30, 2018.
- ^ "DuPont MSDS" (PDF). Archived from the original (PDF) on 2014-08-15. Retrieved 2012-01-26.
- ^ Spiro, M. (1979). "The standard potential of the peroxosulphate/sulphate couple". Electrochimica Acta. 24 (3): 313–314. doi:10.1016/0013-4686(79)85051-3. ISSN 0013-4686.
- ^ Crandall, Jack K.; Shi, Yian; Burke, Christopher P.; Buckley, Benjamin R. (2001). Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd. doi:10.1002/047084289x.rp246.pub3. ISBN 978-0-470-84289-8.
- ^ a b Harald Jakob; Stefan Leininger; Thomas Lehmann; Sylvia Jacobi; Sven Gutewort. "Peroxo Compounds, Inorganic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_177.pub2.
- ^ UNITED STATES ENVIRONMENTAL PROTECTION AGENCY (2020-03-11). Peroxy Compounds Human Health and Ecological Draft Risk Assessment DP 455445, 455446 (Report). p. 9-10. Retrieved 2021-09-24.
- ^ (2017) (2017-12-15). "Peroxy Compounds Human Health and Ecological Draft Risk Assessment DP 455445, 455446". Chemical Engineering Journal. 330: 44–62. doi:10.1016/j.cej.2017.07.132.CS1 maint: 숫자 이름: 작성자 목록(링크)
- ^ Benjamin R. Travis; Meenakshi Sivakumar; G. Olatunji Hollist & Babak Borhan (2003). "Facile Oxidation of Aldehydes to Acids and Esters with Oxone". Organic Letters. 5 (7): 1031–4. doi:10.1021/ol0340078. PMID 12659566.
- ^ Thomas W. Bell, Young-Moon Cho, Albert Firestone, Karin Healy, Jia Liu, Richard Ludwig, Scott D. Rothenberger (1990). "9-n-Butyl-1,2,3,4,5,6,7,8-Octahydroacridin-4-ol". Organic Syntheses. 69: 226. doi:10.15227/orgsyn.069.0226.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ James R. McCarthy, Donald P. Matthews, John P. Paolini (1995). "Reaction of Sulfoxides with Diethylaminosulfur Trifluoride". Organic Syntheses. 72: 209. doi:10.15227/orgsyn.072.0209.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ Frohn, Michael; Shi, Yian (2000). "Chiral Ketone-Catalyzed Asymmetric Epoxidation of Olefins". Synthesis. 2000 (14): 1979–2000. doi:10.1055/s-2000-8715.






