보호 그룹
Protecting group보호기 또는 보호기를 작용기의 화학적 수식에 의해 분자에 도입하여 후속 화학반응에서 화학선택성을 얻는다.다단계 유기 [1]합성에 중요한 역할을 합니다.
섬세한 유기화합물의 많은 준비에서 분자의 일부 특정 부분은 필요한 시약이나 화학적 환경에서 살아남을 수 없습니다.그런 다음 이러한 부품 또는 그룹을 보호해야 합니다.예를 들어, 수소화 리튬 알루미늄은 반응성이 높지만 에스테르를 알코올로 환원할 수 있는 유용한 시약입니다.그것은 항상 카르보닐기와 반응하며, 이것은 어떠한 방법으로도 억제될 수 없다.카르보닐이 존재하는 상태에서 에스테르를 환원해야 할 경우 카르보닐에 대한 수소화물의 공격을 방지해야 한다.예를 들어 카르보닐은 아세탈로 전환되며, 아세탈은 수소화물과 반응하지 않는다.아세탈은 카르보닐의 보호기라고 불린다.수소화물을 포함한 공정이 완료된 후 아세탈을 제거하고(수산과 반응시켜) 원래의 카르보닐을 환원한다.이 단계를 보호 해제라고 합니다.
보호 그룹은 산업 생산 공정보다 소규모 실험실 작업 및 초기 개발에서 더 일반적으로 사용됩니다. 보호 그룹은 프로세스에 추가 단계와 재료 비용을 추가하기 때문입니다.그러나 값싼 키랄 구성 요소를 이용할 수 있으면 이러한 추가 비용(예: 오셀타미비르의 시키미산)을 극복할 수 있다.
일반적인 보호 단체
술을 보호하는 그룹
알코올 보호:
- 아세틸(Ac) – 산 또는 염기에 의해 제거된다(Actoxy기 참조).
- 벤조일(Bz) – 산 또는 염기에 의해 제거되며 Ac기보다 안정적입니다.
- 벤질(Bn) – 수소 분해로 제거됨.Bn기는 설탕과 뉴클레오시드 화학에 널리 사용된다.
- β-메톡시에톡시메틸에테르(MEM)– 산에 의해 제거된다.
- 디메톡시트리텔, [bis-(4-메톡시페닐)페닐메틸](DMT) – 약산에 의해 제거됨.DMT기는 뉴클레오시드에서 특히 올리고뉴클레오티드 합성에 5'-히드록시기 보호에 널리 사용된다.
- 메톡시메틸에테르(MOM) – 산에 의해 제거됨.
- 메톡시트리텔 [(4-메톡시페닐)디페닐메틸](MMT) – 산 및 수소 분해로 제거됨.
- p-메톡시벤질 에테르(PMB) – 일반적으로 DDQ와 함께 산, 수소 분해 또는 산화에 의해 제거된다.
- p-메톡시페닐에테르(PMP)– 산화에 의해 제거된다.
- 메틸티오메틸 에테르 – 산에 의해 제거됨.
- 피발로일(Piv) – 산, 염기 또는 환원제에 의해 제거된다.그것은 다른 아실 보호 그룹보다 상당히 안정적이다.
- 테트라히드로피라닐(THP)– 산에 의해 제거됩니다.
- 테트라히드로프랑(THF) – 산에 의해 제거됨.
- 트리틸(트리페닐메틸, Tr) – 산과 수소 분해로 제거됨.
- 시릴 에테르(가장 인기 있는 것은 트리메틸실릴(TMS), 테르트부틸디메틸실릴(TBDMS 또는 TBS), 트리이소프로필실릴(TOM) 및 트리이소프로필실릴(TIPS) 에테르)– 산 또는 플루오르화물 이온에 의해 제거됨.(예를 들어 NaF, TBAF(불화테트라-n-부틸암모늄, HF-Py 또는 HF-NET3) 등).TBDMS 및 TOM 그룹은 뉴클레오사이드, 특히 올리고뉴클레오티드 합성에 있어 2-히드록시 기능의 보호에 사용된다.
- 메틸 에테르 – 분해는 디클로로메탄, 아세토니트릴 또는 클로로포름에서 TMSI에 의해 이루어집니다.메틸에테르를 분해하는 대체 방법은 DCM의 BBr이다3.
- 에톡시에틸에테르(EE) – 단순 에테르보다 더 사소한 분해(예: 1N 염산[2])
Amine 그룹을 보호하는
아민 보호:
- 카르보벤질옥시(Cbz)기 – 수소 분해로 제거됨
- p-메톡시벤질카르보닐(Moz 또는 MeOZ)기 – 수소 분해에 의해 제거되며, Cbz보다 유연성이 높다.
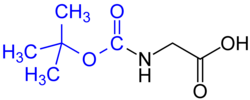
- Tert-Butyloxycarbonyl(BOC) 그룹(고상펩타이드 합성에 공통) – 농축 강산3(HCl 또는 CFCOOH 등) 또는 80°C 이상으로 가열하여 제거한다.
- 9-플루오레닐메틸옥시카르보닐(Fmoc)기(고상펩타이드 합성에 공통)– 피페리딘 등 염기별로 제거
- 아세틸(Ac) 그룹은 시토신에서 N4를 보호하고 아데닌 핵염기에서 N6을 보호하기 위해 올리고뉴클레오티드 합성에 흔하며, 대부분의 경우 수성 또는 기체 암모니아 또는 메틸아민으로 처리함으로써 제거된다.Ac는 지방족 아미드로부터 쉽게 제거되기에는 너무 안정적이다.
- 벤조일(Bz) 그룹은 시토신의 N4 및 아데닌 핵염기의 N6 보호를 위한 올리고뉴클레오티드 합성에 공통적이며, 염기로 처리함으로써, 대부분 수성 또는 기체 암모니아 또는 메틸아민으로 제거된다.Bz는 너무 안정적이어서 지방족 아미드에서 쉽게 제거되지 않는다.
- 벤질(Bn)기 – 수소 분해로 제거됨
- 카르바메이트 그룹 – 산성과 약한 가열로 제거됨.
- p-메톡시벤질(PMB) – 수소 분해에 의해 제거되며 벤질보다 유연성이 높다.
- 3,4-디메톡시벤질(DMPM)– 수소분해로 제거되며 p-메톡시벤질보다 더 유연함
- p-메톡시페닐(PMP)기– 암모늄 세륨(암모늄)에 의해 제거됨IV) 질산염(CAN)
- 토실(Ts)기 – 농축산(HBr, HSO24) 및 강환원제(액상 암모니아 또는 나프탈렌화나트륨 중 나트륨)로 제거
- Troc(트리클로로에틸클로로포름산)군 – 초산이 있는 상태에서 Zn 삽입으로 제거
- 기타 술폰아미드(Nosyl & Nps)군 – 요오드화 사마륨, 티오페놀 또는 기타 연질 티올 핵친위체 또는 트리부틸틴 하이드라이드에[3] 의해 제거됨
카보닐기 그룹을 보호하는
카르보닐기 보호:
- 아세탈 및 케탈 – 산에 의해 제거됨.일반적으로 비환식 아세탈은 고리형 아세탈보다 분할이 쉽다.
- 아실랄 – 루이스산에 의해 제거됨.
- 디티아네스 – 금속염 또는 산화제에 의해 제거됩니다.
Carboxylic 산성 그룹을 보호하는
카르본산 보호:
- 메틸에스테르 – 산 또는 염기에 의해 제거됩니다.
- 벤질 에스테르 – 수소 분해로 제거됨.
- Tert-Butyl 에스테르 – 산, 염기 및 일부 환원제에 의해 제거된다.
- 2,6-디메틸페놀의 에스테르(2,6-디메틸페놀, 2,6-디이소프로필페놀, 2,6-디테르트-부틸페놀) – 고압 [4]조건에서 DBU 촉매 메타노 분해를 통해 상온에서 제거됨.
- 시릴 에스테르 – 산, 염기 및 유기 금속 시약에 의해 제거됩니다.
- Orthoesters – 순한 수산에 의해 제거되어 에스테르를 형성하며, 에스테르 성질에 따라 제거됩니다.
- 옥사졸린 – 강한 열산(pH < 1, T > 100 °C) 또는 알칼리(pH > 12, T > 100 °C)에 의해 제거되지만, 예:LiAlH4, 유기석 시약 또는 그리냐드(유기 마그네슘) 시약
Phosphate 그룹을 보호하는
말단 알킨 보호군
- 프로파길 알코올이 Favoreskii 반응으로 반응하고,
- 실릴기, 특히 아세틸렌 [5]자체를 보호하기 위해.
다른.
직교 보호
직교 보호는 다중 보호 구조에서 한 보호 그룹의 특정 보호를 다른 그룹에 영향을 미치지 않고 해제할 수 있는 전략입니다.예를 들어 아미노산 티로신은 카르복실기 벤질 에스테르, 아민기 플루오레닐메틸엔옥시카르바메이트, 페놀기 테르트부틸에테르로 보호될 수 있다.벤질 에스테르는 수소 분해, 플루오레닐메틸엔옥시기(Fmoc)는 염기(예: 피페리딘) 및 페놀계 tert-부틸에테르(예: 트리플루오로아세트산)로 분해하여 제거할 수 있다.
이 응용의 일반적인 예인 Fmoc-펩타이드 합성은 용액과 고체상에서 펩타이드가 배양되는 것이 매우 중요하다.[6]반응시간, 온도, 시약 등의 반응조건에 대한 고체합성 보호기는 기계에 의해 수행되도록 표준화 할 수 있으며 수율은 99%를 훨씬 넘을 수 있다.그렇지 않으면 반응 생성물의 혼합물을 분리하는 것은 사실상 불가능하다.[7]
이 기술은 1977년 [8]로버트 브루스 메리필드에 의해 펩타이드 합성 분야에서 도입되었다.개념의 증거로서 직교 탈보호는 [9]운동 동위원소 효과를 이용한 트리메틸실릴디아조메탄에 의한 광화학 변환에서 입증된다.
이 효과로 인해 우측 에스테르 그룹의 보호를 해제하기 위한 양자 수율이 감소하여 그대로 유지됩니다.중수소 원자를 좌측 에스테르기 옆에 배치하거나 파장을 254 nm로 변경함으로써 다른 모노아렌을 얻을 수 있다.
비판
보호단체의 사용은 널리 퍼져있지만 [10]비난이 없는 것은 아니다.실제적인 측면에서 이들의 사용은 합성에 두 단계(보호-보호 해제 시퀀스)를 추가하며, 둘 중 하나 또는 둘 다 화학 수율을 크게 낮출 수 있다.결정적으로, 추가된 복잡성은 약물 발견에서 합성 전체 합성의 사용을 방해한다.반대로 생체모방 합성은 보호 그룹을 사용하지 않는다.대안으로, Baran은 화합물 하팔린돌 U의 새로운 보호군 프리 합성을 제시했다.Baran에 따르면 이전에 발표된[11][12][13] 합성에는 다중 보호 그룹 조작을 포함한 20개의 단계가 포함되어 있었다(2개 확인).
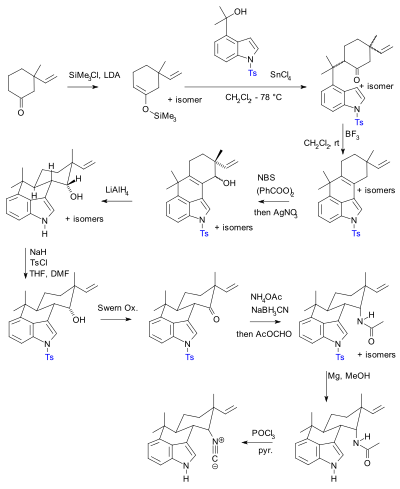 1990년 무라타케 히데아키의 토실 보호군(파란색으로 표시)을 이용한 합성. | 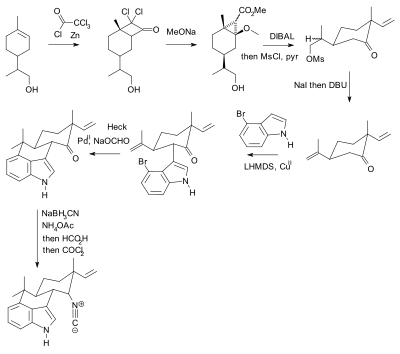 2007년에 보고된 필 바란의 보호 집단 자유 합성. |
산업용 응용 프로그램
산업 합성에서는 보호 그룹의 사용이 선호되지 않지만, 다음과 같은 산업 맥락에서 여전히 사용되고 있다.
- Roche에 의한 Oseltamivir(항바이러스제 Tamiflu) 합성
- 수크랄로스(감미료)
레퍼런스
- ^ Theodora W. Greene, Peter G. M. Wuts (1999). Protecting Groups in Organic Synthesis (3 ed.). J. Wiley. ISBN 978-0-471-16019-9.
{{cite book}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Kamaya, Yasushi; T Higuchi (2006). "Metabolism of 3,4-dimethoxycinnamyl alcohol and derivatives by Coriolus versicolor". FEMS Microbiology Letters. 24 (2–3): 225–229. doi:10.1111/j.1574-6968.1984.tb01309.x.
- ^ Moussa, Ziad; D. Romo (2006). "Mild deprotection of primary N-(p-toluenesufonyl) amides with SmI2 following trifluoroacetylation". Synlett. 2006 (19): 3294–3298. doi:10.1055/s-2006-951530.
- ^ Romanski, J.; Nowak, P.; Kosinski, K.; Jurczak, J. (September 2012). "High-pressure transesterification of sterically hindered esters". Tetrahedron Lett. 53 (39): 5287–5289. doi:10.1016/j.tetlet.2012.07.094.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2000). Organic Chemistry. Oxford University Press. pp. 1291. ISBN 978-0198503460.
- ^ Chan, Weng C.; White, Peter D. (2004). Fmoc Solid Phase Peptide Synthesis. Oxford University Press. ISBN 978-0-19-963724-9.
- ^ Weng C. Chan, Peter D.흰색: Fmoc 고체상 펩타이드 합성, S. 10–12.
- ^ Merrifield, R. B.; Barany, G.; Cosand, W. L.; Engelhard, M.; Mojsov, S. (1977). "Proceedings of the 5th American Peptide Symposium". Biochemical Education. 7 (4): 93–94. doi:10.1016/0307-4412(79)90078-5.
- ^ Blanc, Aurélien; Bochet, Christian G. (2007). "Isotope Effects in Photochemistry: Application to Chromatic Orthogonality" (PDF). Org. Lett. 9 (14): 2649–2651. doi:10.1021/ol070820h. PMID 17555322.
- ^ Baran, Phil S.; Maimone, Thomas J.; Richter, Jeremy M. (22 March 2007). "Total synthesis of marine natural products without using protecting groups". Nature. 446 (7134): 404–408. Bibcode:2007Natur.446..404B. doi:10.1038/nature05569. PMID 17377577. S2CID 4357378.
- ^ 해양 알칼로이드 하팔린돌에 대한 합성 연구. 제1부 (±)-하팔린돌 J와 M 사면체, 제46권, 1990년 제18호, 무라타케 히데아키와 나츠메 미쓰타카 도이:10.1016/S0040-4020(01)96005-3페이지, 제6331권
- ^ 해양 알칼로이드 하팔린돌에 대한 합성 연구. 파트 2 인돌핵 4면체와 결합된 전자부 탄소-탄소 이중 결합의 수소화 리튬 알루미늄 환원, 제46권, 제18호, 1990, 6343–6350쪽, 무라타케 히데아키 및 나츠메 도이 미쓰타카:10.1016/S0040-4020(01)6-5
- ^ 해양 알칼로이드 하팔린돌에 대한 합성 연구. 제3부 - 하팔린돌 H와 U 사면체의 총합성, 제46권, 1990년 제18호, 무라타케 히데아키, 구마가미 하루미, 나츠메 미쓰타카 도이:10.1016/S0040-4020(01)96007-7