아나바신
Anabaseine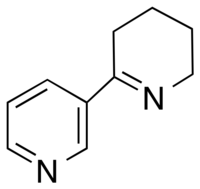 | |
| 이름 | |
|---|---|
| 우선 IUPAC 이름 3,4,5,6-테트라히드로-2,3'-비피리딘 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
| 케그 | |
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| C10H12N2 | |
| 몰 질량 | 160.220 g/g−1/g |
| 외모 | 기름 |
| 냄새 | 무취 |
| 비등점 | 110-120℃ |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
아나바세인(3,4,5,6-테트라히드로-2,3µ-비피리딘)은 네메르틴과 아프네가스터 [1]개미에 의해 생성되는 알칼로이드 독소이다.그것은 구조적으로 니코틴과 아나바신과 [2]유사하다.마찬가지로, 그것은 중추신경계와 [2]말초신경계의 대부분의 니코틴성 아세틸콜린 수용체에 작용제로 작용하는 것으로 나타났다.
작용 메커니즘
아나바세인의 이미늄 형태는 말초 신경계와 중추 신경계 모두에서 대부분의 니코틴성 아세틸콜린 수용체와 결합합니다.그러나 골격근 [3]수용체뿐만 아니라 α7 서브유닛을 가진 뇌 수용체에 대한 결합 친화력이 더 높다.결합은 뉴런의 탈분극을 유발하고 도파민과 [2]노르에피네프린의 방출을 유도한다.
생물학적 영향
아나바세인은 말초 신경근 니코틴성 아세틸콜린 [2]수용체에 작용제 역할을 함으로써 갑각류와 곤충에서는 마비를 일으키지만 척추동물에서는 그렇지 않다.
구조.
아나바신 분자는 3-피리딜 고리의 세 번째 탄소에 연결된 비방향족 테트라히드로피리딘 고리로 구성됩니다.그것은 생리학적 pH에서 케톤,[2] 이민 또는 이미늄 구조의 세 가지 형태로 존재할 수 있다.이민과 3-피리딜 고리 사이의 결합으로 인해 아나바세인은 거의 코플라 분자로 존재한다.
합성
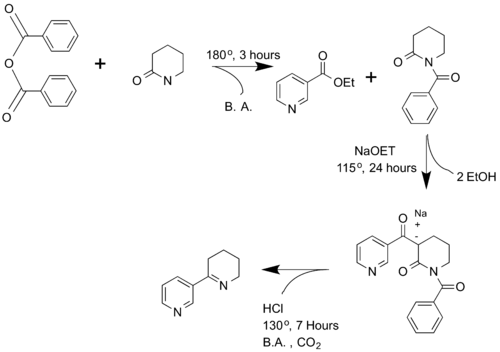
스파스와 마몰리는 [4]1936년에 아나바세인을 처음 합성했다.연구진은 벤조산 무수물과 γ-발레롤락탐을 반응시켜 N-벤조일피페리돈을 생성했다.다음으로 N-벤조일피페리돈과 니코틴산에틸에스테르를 반응시켜 α-니코티노일-N-벤조일-2-피페리돈을 생성한다.이 생성물은 탈탄산되고, 고리 폐쇄를 거쳐 아미드 가수분해를 거쳐 아나바세인을 형성한다.
Bloom,[5] Zoltewicz,[6] Smith [7]및 Villemin에 [8]의해 추가적인 합성 전략이 개발되었습니다.
파생상품
아나바세인의 니코틴성 아세틸콜린 수용체에 대한 상당히 비특이적인 결합으로 인해, 그 분자는 연구나 의학에서 유용한 도구로서 대부분 폐기되었다.그러나 아나바신 유도체는 보다 선택적 α7 결합 프로파일로 확인되었다.그러한 유도체 중 하나(GTS-21, 3-(2,4-디메톡시벤질리덴)-아나바세인)는 특히 정신분열증과 관련된 인지 및 기억력 결손의 약물 후보로서 연구되어 왔다.[9] 이는 단계 III로 진행되지 않고 단계 II 임상 시험에서 연구되었다.또한 아나바신 피리딘핵의 개조는 α3β4 니코틴성 아세틸콜린 수용체 서브타입에 [10]대한 결합 및 기능적 선택성을 부여한 새로운 유도체를 얻는 것으로 이어졌다.
레퍼런스
- ^ Wheeler, JW; Olubajo, O; Storm, CB; Duffield, RM (6 March 1981). "Anabaseine: venom alkaloid of aphaenogaster ants". Science. 211 (4486): 1051–2. Bibcode:1981Sci...211.1051W. doi:10.1126/science.211.4486.1051. PMID 17744933.
- ^ a b c d e Kem, William; Soti, Ferenc; Wildeboer, Kristin; LeFrancois, Susan; MacDougall, Kelly; Wei, Dong-Qing; Chou, Kuo-Chen; Arias, Hugo R. (2006-04-06). "The Nemertine Toxin Anabaseine and Its Derivative DMXBA (GTS-21): Chemical and Pharmacological Properties". Marine Drugs. 4 (3): 255–273. doi:10.3390/md403255. PMC 3663414.
- ^ Kem, WR; Mahnir, VM; Papke, RL; Lingle, CJ (December 1997). "Anabaseine is a potent agonist on muscle and neuronal alpha-bungarotoxin-sensitive nicotinic receptors". The Journal of Pharmacology and Experimental Therapeutics. 283 (3): 979–92. PMID 9399967.
- ^ Padilla, Edited by Dean F. Martin [and] George M. (1973). Marine pharmacognosy; action of marine biotoxins at the cellular level (First ed.). New York: Academic Press. pp. 54–55. ISBN 978-0124745506.
{{cite book}}:first1=범용명(도움말)이 있습니다. - ^ Bloom, Linda. "Influence of solvent on the ring-chain hydrolysis equilibrium of anabaseine and synthesis of anabaseine and nicotine analogues". University of Florida. Retrieved 5 May 2015.
- ^ Zoltewicz, John A.; Cruskie, Michael P. (August 1995). "A Superior Synthesis of Cholinergic Anabaseine". Organic Preparations and Procedures International. 27 (4): 510–513. doi:10.1080/00304949509458490.
- ^ Smith, Aaron. "Synthesis and Radiolabeling of Potassium Trifluoroborate Benzilidene Anabaseine Derivatives". University of Tennessee - Knoxville.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ Villemin, Didier; Hachemi, Messaoud (2001). "Cesium Fluoride on Calcium Oxide as a Strongly Basic Catalyst. Synthesis of Flavones and Tobacco Alkaloids". Reaction Kinetics and Catalysis Letters. 72 (1): 3–10. doi:10.1023/A:1010597826749. S2CID 92416597.
- ^ Celanire, Sylvain; Poli, Sonia (2014-10-13). Small Molecule Therapeutics for Schizophrenia. Springer. p. 248. ISBN 9783319115023. Retrieved 2015-04-20.
- ^ Matera, Carlo; Quadri, Marta; Sciaccaluga, Miriam; Pomè, Diego Yuri; Fasoli, Francesca; De Amici, Marco; Fucile, Sergio; Gotti, Cecilia; Dallanoce, Clelia (2016-01-27). "Modification of the anabaseine pyridine nucleus allows achieving binding and functional selectivity for the α3β4 nicotinic acetylcholine receptor subtype". European Journal of Medicinal Chemistry. 108: 392–405. doi:10.1016/j.ejmech.2015.11.045. PMID 26706350.