SOS 응답
SOS response
SOS 응답은 세포주기가 정지되고 DNA 복구와 돌연변이가 유도되는 DNA 손상에 대한 글로벌 반응이다.이 시스템은 RecA 단백질(진핵생물에서는 Rad51)을 포함합니다.단일 가닥 DNA에 의해 자극된 RecA 단백질은 SOS 반응 유전자의 억제제(LexA) 불활성화에 관여하여 반응을 유도한다.다양한 종에서 관찰된 DNA 변화에 크게 기여하는 오류 발생 가능성이 높은 수리 시스템입니다.
검출
SOS 응답은 1975년 [3]미로슬라브 래드먼에 의해 발견되고 명명되었다.
메커니즘
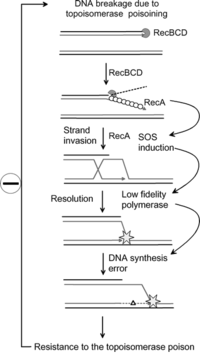
정상 성장 중에 SOS 유전자는 LexA 억제 단백질 이합체에 의해 음의 조절을 받습니다.정상 조건에서 LexA는 이러한 유전자에 대한 연산자 영역의 20-bp 컨센서스 배열(SOS 박스)에 결합한다.이들 SOS 유전자 중 일부는 SOS 박스에 대한 LexA의 친화력에 따라 억제된 상태에서도 일정 수준에서 발현된다.SOS 유전자의 활성화는 DNA 중합효소가 차단되는 레플리케이션 포크에 생성된 단일 가닥(sssDNA) 영역의 축적에 의한 DNA 손상 후에 일어난다.RecA는 ATP 의존적인 방식으로 이러한 ssDNA 영역 주위에 필라멘트를 형성하고 [4]활성화된다.활성화된 형태의 RecA는 [4][5]LexA 억제기와 상호 작용하여 조작자로부터 LexA 억제기의 자가 분리를 용이하게 한다.
일단 LexA의 풀이 감소하면 SOS [4]박스에 대한 LexA 친화력 수준에 따라 SOS 유전자의 억제가 감소한다.LexA를 약하게 바인드하는 연산자가 가장 먼저 완전히 표현됩니다.이러한 방식으로 LexA는 순차적으로 다양한 수리 메커니즘을 활성화할 수 있습니다.약한 SOS박스(lexA, recA, uvrA, uvrB, uvrD 등)를 가진 유전자는 약한 SOS 유도 치료에도 반응하여 충분히 유도된다.따라서 유도되는 첫 번째 SOS 복구 메커니즘은 뉴클레오티드 절제 복구(NER)이며, 그 목적은 본격적인 SOS 응답에 관여하지 않고 DNA 손상을 복구하는 것이다.그러나 NER가 손상을 복구하기에 충분하지 않으면 LexA 농도는 더욱 감소하므로 보다 강력한 LexA 박스를 가진 유전자 발현(sulA, umuD, umuC 등 늦게 발현됨)이 [4]유도된다.SulA는 이 과정에서 개시 단백질인 FtsZ와 결합함으로써 세포[4] 분열을 막는다.이로 인해 필라멘테이션이 발생하고 UmuDC 의존형 돌연변이 유발 수복의 유도가 발생합니다.이러한 성질의 결과로, 일부 유전자는 DNA 손상의 내생적 수준에 반응하여 부분적으로 유도될 수 있는 반면, 다른 유전자는 세포 내에 높거나 지속적인 DNA 손상이 존재할 때만 유도되는 것으로 보인다.
항생제 내성
연구에 따르면 SOS 응답 시스템은 항생제에 [6]대한 내성을 유발하는 돌연변이를 일으킬 수 있다.SOS 응답 중 돌연변이 증가율은 다음과 같은 세 가지 저충실도 DNA 중합효소 때문에 발생합니다.Pol II, Pol IV, Pol V.[7][6] 연구원들은 현재 SOS 복구를 막는 약물을 만들 목적으로 이 단백질을 목표로 하고 있다.이를 통해 병원성 세균이 항생제 내성을 진화시키는 데 필요한 시간을 연장할 수 있어 일부 항생제의 [8]장기 생존성을 향상시킬 수 있다.
SOS 응답은 유전적 저항뿐만 아니라 표현형 저항도 촉진할 수 있습니다.여기서 게놈은 보존되고 다른 비유전 인자는 박테리아가 생존할 수 있도록 변화한다.예를 들어 SOS 의존성 tisB-istR 독소-항독소 시스템은 DNA 손상 의존성 과시스터 세포 유도와 [9]관련이 있다.
유전독성 테스트
대장균에서는 위와 같이 다양한 종류의 DNA 손상제가 SOS 응답을 시작할 수 있다.락오페론(락토스를 분해하는 단백질인 베타갈락토시드가수분해효소)을 SOS 관련 단백질의 제어 하에 두는 오퍼론 융접을 이용하여 유전독성에 대한 간단한 색도 측정이 가능하다.이 세균에 유당 유사체를 첨가하여 베타갈락토시드가수분해효소에 의해 분해함으로써 분광광도법으로 정량적으로 측정할 수 있는 착색화합물을 생성한다.발색 정도는 생성된 베타-갈락토시다아제의 간접 측정값으로, 그 자체가 DNA 손상량과 직접적인 관련이 있다.
대장균은 절제 수리에 부족한 균주를 만드는 uvrA 돌연변이, 특정 DNA 손상 물질에 대한 반응을 증가시키는 rfa 돌연변이를 포함한 많은 돌연변이를 가지기 위해 추가로 수정되며, 특정 화학 물질의 더 나은 확산을 가능하게 한다.SOS [10]응답을 유도하기 위한 셀.유전자 손상에 대한 대장균 세포의 1차 반응을 측정하는 시판 키트를 사용할 수 있으며 특정 물질에 [11]대한 Ames 테스트와 높은 상관 관계를 가질 수 있습니다.
기타 이미지
SOS 응답은 세균 DNA가 복구될 때까지 격막 형성을 억제하며 현미경으로 세포를 검사하면 필라멘테이션으로 관찰할 수 있다(이미지 우측 상단).
「 」를 참조해 주세요.
레퍼런스
- ^ Little JW, Mount DW (May 1982). "The SOS regulatory system of Escherichia coli". Cell. 29 (1): 11–22. doi:10.1016/0092-8674(82)90085-X. PMID 7049397. S2CID 12476812.
- ^ Michel B (July 2005). "After 30 years of study, the bacterial SOS response still surprises us". PLOS Biology. 3 (7): e255. doi:10.1371/journal.pbio.0030255. PMC 1174825. PMID 16000023.

- ^ Radman, M (1975). "Phenomenology of an inducible mutagenic DNA repair pathway in Escherichia coli: SOS repair hypothesis". Basic Life Sciences. 5A: 355–367. doi:10.1007/978-1-4684-2895-7_48. PMID 1103845.
- ^ a b c d e Maslowska, K. H.; Makiela-Dzbenska, K.; Fijalkowska, I. J. (May 2019). "The SOS system: A complex and tightly regulated response to DNA damage". Environmental and Molecular Mutagenesis. 60 (4): 368–384. doi:10.1002/em.22267. PMC 6590174. PMID 30447030.
- ^ Nelson DL, Cox MM (2004년 4월) 레닝거 생화학 원리 제4판뉴욕: W.H. Freeman and Company. 1098쪽.
- ^ a b Cirz, RT; Chin, JK; Andes, DR; De Crécy-Lagard, V; Craig, WA; Romesberg, FE; et al. (June 2005). "Inhibition of mutation and combating the evolution of antibiotic resistance". PLOS Biology. 3 (6): e176. doi:10.1371/journal.pbio.0030176. PMC 1088971. PMID 15869329.

- ^ Jaszczur, M; Bertram, JG; Robinson, A; van Oijen, AM; Woodgate, R; Cox, MM; Goodman, MF (April 2016). "Mutations for Worse or Better: Low Fidelity DNA Synthesis by SOS DNA Polymerase V is a Tightly-Regulated Double-Edged Sword". Biochemistry. 55 (16): 2309–2318. doi:10.1021/acs.biochem.6b00117. PMC 4846499. PMID 27043933.
- ^ Lee, AM; Ross, CT; Zeng, BB; Singleton, SF; et al. (July 2005). "A molecular target for suppression of the evolution of antibiotic resistance: Inhibition of the Escherichia coli RecA Protein by N6-(1-Naphthyl)-ADP". Journal of Medicinal Chemistry. 48 (17): 5408–5411. doi:10.1021/jm050113z. PMID 16107138.
- ^ Dörr, T; Vulić, M; Lewis, K (February 2010). "Ciprofloxacin Causes Persister Formation by Inducing the TisB toxin in Escherichia coli". PLOS Biology. 8 (2): e1000317. doi:10.1371/journal.pbio.1000317. PMC 2826370. PMID 20186264.
- ^ Quillardet P, Hofnung M (October 1993). "The SOS chromotest: A review". Mutation Research. 297 (3): 235–279. doi:10.1016/0165-1110(93)90019-J. PMID 7692273.
- ^ Quillardet P, Hofnung M (June 1985). "The SOS chromotest, a colorimetric bacterial assay for genotoxins: validation study with 83 compounds". Mutation Research. 147 (3): 79–95. doi:10.1016/0165-1161(85)90021-4. PMID 3923333.