폐마이크로바이오타
Lung microbiota이 글은 검증을 위해 인용구가 추가로 필요하다.– · · 책· · (2011년 9월)(이 템플릿 |
폐 미생물군(Pulmicrobiota)은 하부 호흡기에서 특히 점막층과 상피 표면에서 발견되는 다양한 미생물로 구성된 폐 미생물 집단이다. 이러한 미생물은 박테리아, 곰팡이, 바이러스, 박테리오파지 등을 포함한다. 마이크로바이오타의 박테리아 부분은 더 면밀하게 연구되었다. 프레보텔라, 스핑고모나스, 필로모나스, 아시네토박터, 후소박테리움, 메가스페라, 베요넬라, 포도상구균, 스트렙토코쿠스 등 9개 생물의 핵심으로 구성되어 있다.[1][2][3] 그것들은 에어로브 뿐만 아니라 혐기성, 에어로볼러성 박테리아다. 미생물 집단은 특히 개인과 140여 개의 개별적인 가족으로 구성될 때 매우 다양하다. 예를 들어 기관지 트리는 cm2 표면당 평균 2000개의 박테리아 게놈을 포함하고 있다. 유해하거나 잠재적으로 유해한 박테리아는 호흡기 표본에서도 일상적으로 검출된다. 가장 중요한 것은 모락셀라 카타할리스, 해모필루스 인플루언제, 그리고 스트렙토코쿠스 폐렴이다. 그것들은 특별한 조건, 즉 인간의 면역체계가 손상되었을 때 호흡기 질환을 일으키는 것으로 알려져 있다. 건강한 개인에서 그들이 낮은 기도로 지속하는 메커니즘은 알려져 있지 않다.
흔히 발견되는 진균성 생식체는 폐의 미생물인 폐균을 구성하고, 칸디다, 맬라세지아, 네오사르토리아, 사카로미세스, 아스페르길루스 등이 있다.[4][5]
상피장벽의 역할
기도 상피와 대식세포는 대식세포와 함께 박테리아 물질이 공기와 함께 낮은 기도로 들어가는 것을 최초로 인식하는 데 큰 역할을 한다. 이러한 제품들 중 일부는 강력한 소염 자극제이기 때문에 면역체계가 병원균과 비병원성 진통제를 구별하는 것이 매우 중요하다. 이것은 지속적인 염증의 발달을 막고 무해한 미생물들에 대한 내성을 형성한다.[6]
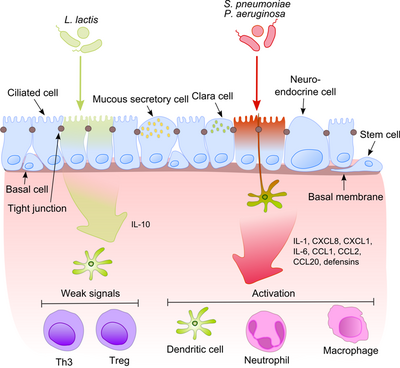
이 과정은 보통 균등들이 그들의 표면 분자를 병원균과 공유한다는 것을 고려할 때 훨씬 더 흥미로워진다. 상피세포에는 다양한 미생물 구조요소를 인식하는 레티노산유도유도유도유도유도유도유도유도유도유도유도유도유체(RLR) 등 매우 민감한 인식도구가 탑재돼 있다. 병원성 박테리아 소염경로 인정 후, 적응성 및 선천성 면역의 세포 구성요소를 감염 현장에 모집한다.[7] 이 과정에서 한 가지 중요한 조절기는 세포질에서 핵으로 전이되어 상피세포와 대식세포에서 프로염증 유전자를 활성화시키는 NF-κB이다. DNA 결합 단백질 복합체는 다양한 반응 유전자의 업스트림 영역에서 이산 뉴클레오티드 시퀀스(5'-GGGG ACT TTC T-3')를 인식한다. 박테리아 세포벽이나 염증성 사이토카인 같은 여러 자극에 의해 NF-κB가 활성화되면 핵으로 변환된다.
이와는 대조적으로, 무해한 박테리아는 NF-170B가 핵으로 변환되는 것을 유발하지 않기 때문에 동일한 미세 생물 관련 분자 패턴(MAMP)을 표현할 수 있지만 염증을 예방한다. 이러한 효과를 설명하는 한 가지 가능한 메커니즘은 비병원성 S. 장티푸륨 PhoPc와 S. Pullorum이 B-cells 억제제 알파(IκB-κ)[8]에서 NF-κB 경량 폴리펩타이드 유전자 증진제의 NF-κB 억제제 분자 핵 인자의 편재화를 금지할 수 있다는 것을 보여주는 니쉬에 의해 제안되었다. 상피의 균등 내성에 대한 또 다른 설명은 하나 이상의 유비퀴틴(Ub) 단량체의 공동 부착에 의한 단백질의 변환 후 수정을 말한다. 편재성 억제(IκB-message)는 폴리우비퀴티드(Polyubiquititized, IκB-message는 26 S 프로테아솜에 의한 열화를 목표로 하기 때문에 염증 감소로 이어지며, NF-162B의 핵으로의 변환을 허용하고 이펙터 유전자의 전사(예를 들면 IL-8)를 활성화한다. 유산균과 같은 프로바이오틱스 박테리아는 상피세포에서 반응성 산소종(ROS) 생성을 유도해 ub-단백질 계통의 활성을 조절할 수 있다. 포유류 세포에서, ROS는 소염증 시토카인에 반응하는 다중 신호 전달 경로에서 중요한 두 번째 전달자 역할을 하는 것으로 나타났다. 박테리아 유도 ROS는 Ub 12의 촉매 시스테인 잔류물의 산화 불활성화를 유발하여 불완전하지만 일시적인 컬린-1 네드딜화의 손실과 그로 인한 NF-168B 및 β-카테닌 신호에 대한 영향을 초래한다. 또 다른 유사종인 B. The taiotaomicron은 과산화수소 증식기 활성 수용체 γ(PAR-γ) 의존 경로를 통해 NF-κB 서브유닛 RelA의 핵 수출을 촉진하여 친염증 시토카인 발현을 약화시킨다. PPAR-target은 전사로 활성 Rel A를 달성하고 NF-timeB 작용 기간을 제한하는 조기 핵 정지를 유도한다.
병원균과 균등 사이의 균형은 호흡기의 동점선 유지에 매우 중요하다.
생리학
기도는 수많은 미생물에 지속적으로 노출되며, 그 중 일부는 지속적이고 심지어 호흡기를 식민지화할 수 있다. 이는 영양소, 산소, 최적의 성장 온도 등이 존재하기 때문에 가능하다. 미생물 거주자를 위한 숙주 유래 영양소로는 기도상피세포(특히 괴혈세포)에서 분비된 분비물, 수액선으로부터 분비된 분비물, 혈장으로부터 전이된 것 등 여러 가지가 있다. 게다가, 이용 가능한 영양소의 풀은 마이크로바이오타의 일부 구성원의 활동으로 증가한다. 호흡기 분비물의 고분자성분(단백질, 당단백질, 지질, 핵산)은 영양분(예: 탄수화물, 아미노산)으로 전환된다. 따라서, 현재의 박테리아의 신진대사 활동은 새로운 종의 식민지화를 가능하게 한다. 균일균은 비병원성이며 병원균으로부터 우리의 항로를 방어한다. 몇 가지 가능한 메커니즘이 있다. 콤멘살은 병원성 박테리아의 토착 경쟁자로, 왜냐하면 그들은 인체의 내부와 동일한 생태적 틈새를 점유하는 경향이 있기 때문이다. 둘째로, 그들은 병원균의 성장을 억제하는 박테리오신이라고 불리는 항균 물질을 생산할 수 있다.
제네라 바실러스, 유산균, 락토코커스, 포도상구균, 스트렙토코커스, 스트렙토코커스, 스트렙토코시스 등이 호흡기에 있는 세균의 주산물이다. 더욱이, 균사체는 Th1 반응과 항염증 인터루킨(IL)-10, 항균 펩타이드, FOXP3, 분비 면역글로불린 A(SigA) 생산을 유도하는 것으로 알려져 있다.
임상적 유의성
미생물 공동체 구성의 변화는 만성폐쇄성폐질환(COPD), 천식, 낭포성 섬유증 같은 폐질환의 진행에 영향을 미치는 것으로 보인다.[9][10] 인간에게 있어 S. aureus는 상부 호흡기와 피부 [11]위와 내장에 존재하는 정상 미생물종의 일부분이다.[12] S. aureus는 식민지화하고 공생적으로 행동할 수 있지만 그들이 식민지화한 조직을 차지하기 시작하거나 다른 조직을 침범하기 시작하면 질병을 일으킬 수 있는 유사한 종과 함께 "pathobionts"[11]라고 불려왔다. MRSA는 비슷하게 사람들을 아프게 하지 않고 그들을 식민지로 만들 수 있다.[13] 마이코플라즈마, 필로모나스, 포도상구균과 같은 제네라의 존재는 안정적인 COPD 상태와 상관관계가 있다. 반면 프레보텔라, 메소르히조비움, 마이크로박테리움, 마이크로코커스, 베요넬라, 리조비움, 스테노트로포모나스, 락토코쿠스는 대부분 건강한 개별 코호트에 존재한다. 프로테오박테리아의 상대적 풍부함은 천식아동들에게서 증가한다. 녹농균, 포도상구균 아우레우스, 버크홀더시아 세페시아는 낭포성 섬유증 환자에게서 가장 많이 발견된다.
고투과 염기서열 분석 및 전체 게놈 염기서열 분석 접근법은 하부 호흡기에 있는 균등균의 복잡성과 생리적 함의에 대한 추가 정보를 제공할 것이다.
참고 항목
참조
- ^ Erb-Downward, John R.; Thompson, Deborah L.; Han, Meilan K.; Freeman, Christine M.; McCloskey, Lisa; Schmidt, Lindsay A.; Young, Vincent B.; Toews, Galen B.; et al. (2011). Bereswill, Stefan (ed.). "Analysis of the Lung Microbiome in the "Healthy" Smoker and in COPD". PLOS ONE. 6 (2): e16384. Bibcode:2011PLoSO...616384E. doi:10.1371/journal.pone.0016384. PMC 3043049. PMID 21364979.
- ^ Hilty, Markus; Burke, Conor; Pedro, Helder; Cardenas, Paul; Bush, Andy; Bossley, Cara; Davies, Jane; Ervine, Aaron; et al. (2010). Neyrolles, Olivier (ed.). "Disordered Microbial Communities in Asthmatic Airways". PLOS ONE. 5 (1): e8578. Bibcode:2010PLoSO...5.8578H. doi:10.1371/journal.pone.0008578. PMC 2798952. PMID 20052417.
- ^ Beck, James M.; Young, Vincent B.; Huffnagle, Gary B. (1 February 2012). "The microbiome of the lung". Translational Research. 160 (4): 258–66. doi:10.1016/j.trsl.2012.02.005. PMC 3440512. PMID 22683412.
- ^ Cui L, Morris A, Ghedin E (July 2013). "The human mycobiome in health and disease". Genome Med. 5 (7): 63. doi:10.1186/gm467. PMC 3978422. PMID 23899327.
Figure 2: Distribution of fungal genera in different body sites
{{cite journal}}: 외부 링크 위치quote= - ^ Richardson, M; Bowyer, P; Sabino, R (1 April 2019). "The human lung and Aspergillus: You are what you breathe in?". Medical Mycology. 57 (Supplement_2): S145–S154. doi:10.1093/mmy/myy149. PMC 6394755. PMID 30816978.
- ^ Kumar, Himanshu; Kawai, Taro; Akira, Shizuo (2011). "Pathogen Recognition by the Innate Immune System". International Reviews of Immunology. 30 (1): 16–34. doi:10.3109/08830185.2010.529976. PMID 21235323. S2CID 42000671.
- ^ Sha, Q.; Truong-Tran, AQ; Plitt, JR; Beck, LA; Schleimer, RP (2004). "Activation of Airway Epithelial Cells by Toll-Like Receptor Agonists". American Journal of Respiratory Cell and Molecular Biology. 31 (3): 358–64. CiteSeerX 10.1.1.314.5790. doi:10.1165/rcmb.2003-0388OC. PMID 15191912.
- ^ Kumar, Amrita; Wu, Huixia; Collier-Hyams, Lauren S; Hansen, Jason M; Li, Tengguo; Yamoah, Kosj; Pan, Zhen-Qiang; Jones, Dean P; Neish, Andrew S (2007). "Commensal bacteria modulate cullin-dependent signaling via generation of reactive oxygen species". The EMBO Journal. 26 (21): 4457–66. doi:10.1038/sj.emboj.7601867. PMC 2063476. PMID 17914462.
- ^ Huang, Yvonne J.; Kim, Eugenia; Cox, Michael J.; Brodie, Eoin L.; Brown, Ron; Wiener-Kronish, Jeanine P.; Lynch, Susan V. (2010). "A Persistent and Diverse Airway Microbiota Present during Chronic Obstructive Pulmonary Disease Exacerbations". OMICS: A Journal of Integrative Biology. 14 (1): 9–59. doi:10.1089/omi.2009.0100. PMC 3116451. PMID 20141328.
- ^ Cox, Michael J.; Allgaier, Martin; Taylor, Byron; Baek, Marshall S.; Huang, Yvonne J.; Daly, Rebecca A.; Karaoz, Ulas; Andersen, Gary L.; et al. (2010). Ratner, Adam J. (ed.). "Airway Microbiota and Pathogen Abundance in Age-Stratified Cystic Fibrosis Patients". PLOS ONE. 5 (6): e11044. Bibcode:2010PLoSO...511044C. doi:10.1371/journal.pone.0011044. PMC 2890402. PMID 20585638.
- ^ a b Schenck, LP; Surette, MG; Bowdish, DM (November 2016). "Composition and immunological significance of the upper respiratory tract microbiota". FEBS Letters. 590 (21): 3705–3720. doi:10.1002/1873-3468.12455. PMC 7164007. PMID 27730630.
- ^ Wollina, U (2017). "Microbiome in atopic dermatitis". Clinical, Cosmetic and Investigational Dermatology. 10: 51–56. doi:10.2147/ccid.s130013. PMC 5327846. PMID 28260936.
- ^ Uhlemann, AC; Otto, M; Lowy, FD; DeLeo, FR (January 2014). "Evolution of community- and healthcare-associated methicillin-resistant Staphylococcus aureus". Infection, Genetics and Evolution. 21: 563–74. doi:10.1016/j.meegid.2013.04.030. PMC 3884050. PMID 23648426.
외부 링크
| 위키피아는 마이크로바이오와 관련된 정보를 가지고 있다. |



