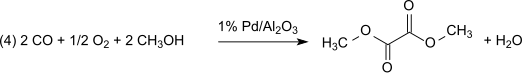디메틸옥살레이트
Dimethyl oxalate | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 디메틸옥살레이트 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.008.231 |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C4H6O4 | |
| 어금질량 | 118.088 g·1998−1 |
| 외관 | 화이트 크리스털 |
| 녹는점 | 53~55°C(127~131°F, 326~328K)[1] |
| 비등점 | 166~167°C(331~333°F, 439~440K)[1] |
자기 감수성(magnetic susibility) | -55.7·10cm−63/190cm |
| 관련 화합물 | |
관련 화합물 | 디페닐옥살레이트 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
디메틸옥살산염은 이 공식23(COCH)을 가진 유기 화합물이다.2옥살산의 디메틸 에스테르다.디메틸옥살레이트(Dimethyl oxalate)는 무색 또는 백색 고체로 물에 녹는다.
생산
디메틸 옥살산염은 황산을 촉매로 사용하여 옥살산을 메탄올과 에스테르화하여 얻을 수 있다.[2]
산화탄화 경로
산화성 카보닐화에 의한 조제는 C1 전구체만을 필요로 하기 때문에 관심을 끌었다.[3]
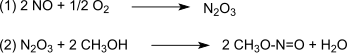
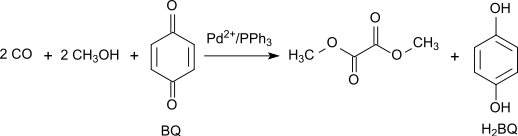
그 반응은 Pd에2+ 의해 촉매제가 된다.[4][5]합성 가스는 대부분 석탄이나 바이오매스에서 얻는다.산화는 일산화탄소와 산소의 (1)에 따라 형성된 후 (2)에 따라 메탄올을 형성하여 질산 메틸 메틸과 반응하는 삼산화질소를 통해 진행된다.[6]
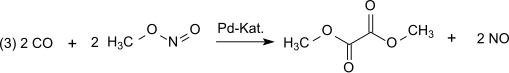
디카르보닐화의 다음 단계에서 일산화탄소는 대기압과 팔라듐 촉매를 통해 80-120°C의 온도에서 증기 단계에서 아질산 메틸과 디메틸 옥살레이트(dimethyl oxalate)와 반응한다.
합 방정식:
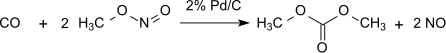
이 방법은 실질적으로 산화성분의 매개체 역할을 하는 아질산 메틸과 관련하여 무손실이다.단, 형성된 물은 반드시 제거하여 디메틸옥살산물의 가수분해를 방지해야 한다.1% Pd/α-AlO23 디메틸 옥살산염은 디카르보닐화 반응에서 선택적으로 생성되며 2% Pd/C 디메틸 탄산염은 단가르보닐화에 의해 생성된다.
또는 메탄올의 산화성 카보닐화는 시스템 Pd(OAC)/2PPH3/벤조퀴논에서 산화제로서 1,4벤조퀴논을 높은 수율과 선택성으로 수행할 수 있으며 질량비율은 65°C 및 70Amtm CO에서 1/100이다.[5]
반응
디메틸옥살레이트(및 관련 디에틸에스테르)는 다양한 응축 반응에 사용된다.[7]예를 들어, 디에틸 옥살산염은 피멜산의 전구체인 디케토-에스테르를 주기 위해 시클로헥사논과 응축된다.[8]직경이 있으면 옥살산의 다이제터는 주기적인 직경을 주기 위해 응축된다.Quinoxalineione은 디메틸록살레이트 및 o-페닐렌디아민의 응결에 의해 생성된다.
- CO22(OMe)2 + CH64(NH2)2 → CH64(NHCO)2 + 2 Me오호
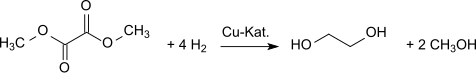
수소는 에틸렌 글리콜을 생성한다.[9]디메틸옥살산염은 에틸렌글리콜로 높은 수율(94.7%)[10][11]으로 환산할 수 있다.
형성된 메탄올은 산화성 카보닐화 과정에서 재활용된다.[12]그 밖에 연간 총 연산 100만톤 이상의 에틸렌 글리콜을 생산할 계획이다.
디페닐 옥살산염은 티타늄 촉매가 존재하는 곳에서 페놀과 트랜세스터화하여 얻는데,[14] 이것은 액체나 가스 단계에서 다시 디파르보닐 탄산염으로 디파르보닐화된다.
참조
- ^ a b P. P. T. Sah와 S-L.치엔, 1931년, 53년, 3901년-3903년 미국화학회지.
- ^ Everett Bowden (1930). "Methyl Oxalate". Organic Syntheses. 10: 78. doi:10.15227/orgsyn.010.0078.
- ^ 한스 위르겐 아르페:Industrielle Organizationche Chemie: Bedeutende Vor- und Zwischen produckte, S. 168; ISBN 978-3-527-31540-6.
- ^ US 4467109, 다하라 외 연구진, "옥살산 다이스터의 연속적인 준비를 위한 프로세스"는 1983-05-19를 발행하여 우베 인더스트리즈에 배정하고 EP 108359, K. 마스나가 외 연구진은 우베 인더스트리즈 EP 425197에 배정되었다. Nishihira & K. Mizutare, "Process for preparing diester of carbonic acid", published 1991-05-2, assigned to Ube IndustriesUS 4451666, J.A. Sofranko, A.M. Gaffney, "Synthesis of oxalate esters by the oxidative carbonylation of alcohols", published 1984-05-29, assigned to Atlantic Richfield Co.
- ^ a b 아마디오 E.Pd(II)-인산 복합체에 의해 촉매된 알칸올의 산화성 카보닐화, PhD 논문, Ca'Foscari University Benice, 2009.
- ^ X.-Z. Jiang, Palladium 지원 CO + RONO 반응, Platinum Metals Rev, 1990, 34, (4), 178–180
- ^ Bergman, Jan; Norrby, Per-Ola; Sand, Peter (1990). "Alkylation with Oxalic Esters. Scope and mechanism". Tetrahedron. 46 (17): 6113–6124. doi:10.1016/S0040-4020(01)87933-3.
- ^ H. R. Snyder, L. A. Brooks, S. H. Shapiro, A. Müller (1931). "Pimelic Acid". Organic Syntheses. 11: 42. doi:10.15227/orgsyn.011.0042.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ Nexant/Chemsystems, : CS1 maint:bot: 원본 URL 상태 알 수 없음(링크) (PDF; 5,4MB), 2011년 Propectus
- ^ 983 EP 046 983, S. 타하라 외 연구진, "에틸렌 글리콜을 지속적으로 준비하는 과정"을 우베 산업과 H. T. 테우니센과 C. J. 엘스비에, 루테늄은 디메틸옥살레이트 수소화를 에틸렌 글리콜, J. Chem. Chem.에 촉매로 작용했다.Soc, Chem.Communic, 1997, 667-668), DOI:10.1039/A700862G.
- ^ S. Zhang et al., Highly-Dispersed Copper-Based Catalysts from Cu–Zn–Al Layered Double Hydroxide Precursor for Gas-Phase Hydrogenation of Dimethyl Oxalate to Ethylene Glycol, Catalysis Letters, Sept. 2012, 142 (9), 1121–1127, DOI:10.1007/s10562-012-0871-8.
- ^ "Individual news".
- ^ US 4544507, P. 폴리 "옥살산염 다이제터로부터 탄산염 다이제터 생산", 셀란즈 코퍼레이션에 할당
- ^ US 5834614, K. 니시히라 외, 「탄산염 일지 생산 공정」, 우베 인더스트리즈·X.B.에 할당.Ma et al., 중국 화학 TS-1 촉매에 페놀로 디메틸 옥살산염의 트랜세스테르화에 의한 디페닐 옥살산염 준비.Let, 14 (5), 461–464 (2003), DOI:10.1016/s0378-3820(03)00075-4.