카비큘린
Cavicularin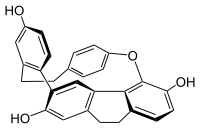 | |
| 이름 | |
|---|---|
| IUPAC 이름 9,10,18,19-테트라히드로-5,8:15,17-디에테노벤조[g]나프스[1,8-bc]옥시클로테트라딘-3,12,21-트리올 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| C28H22O4 | |
| 몰 질량 | 422.140 g/120−1 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
Cavicularin은 간엽 Cavicularia densa에서 분리된 천연 페놀성 2차 대사물입니다.이 매크로 사이클은 평면 키라리티와 축 키라리티의 존재만으로 광학 활동을 보이는 최초의 화합물이었기 때문에 특이하다.(+)-카비큘린의 비회전도는 +168.2°[1]이다.그것은 또한 매우 긴장된 분자이다.파라 치환 페놀 고리는 평탄성으로부터 약 15° 구부러져 있으며, 다소 보트 같은 형상을 채택하고 있습니다.방향족 화합물의 이러한 각도 변형은 일반적으로 합성 사이클로판을 위해 남겨집니다.
간장은 시코쿠 지방의 이시즈치산에서 입수했다.이 물질을 하루 건조시킨 후 분말로 갈아 5g을 메탄올에 4개월 동안 환류하여 컬럼 크로마토그래피 및 준비 TLC 후 2.5mg(0.049%)의 캐비큘린을 생성하였다.
종합합성
2005년과[2] [3]2011년에도 이 화합물은 변형되지 않은 화합물 리카르딘 C와 함께 전체 합성에 의해 제조되었다.2013년, 여러 다른[4][5] 합성물과 라세미 [6]합성이 보고되었다.
레퍼런스
- ^ M. Toyota; T. Yoshida; Y. Kan; S. Takaoka; Y. Asakawa (1996). "(+)-Cavicularin: A Novel Optically Active Cyclic Bibenzyl-Dihydrophenanthrene Derivative from the Liverwort Cavicularia densa Steph". Tetrahedron Letters. 37 (27): 4745–4748. doi:10.1016/0040-4039(96)00956-2.[데드링크]
- ^ David C. Harrowven; Timothy Woodcock; Peter D. Howes (2005). "Total Synthesis of Cavicularin and Riccardin C: Addressing the Synthesis of an Arene That Adopts a Boat Configuration". Angewandte Chemie. 44 (25): 3899–3901. doi:10.1002/anie.200500466. PMID 15900530.
- ^ Kostiuk, S. L.; Woodcock, T.; Dudin, L. F.; Howes, P. D.; Harrowven, D. C. (2011). "Unified Syntheses of Cavicularin and Riccardin C: Addressing the Synthesis of an Arene Adopting a Boat Configuration". Chemistry: A European Journal. 17 (39): 10906–10915. doi:10.1002/chem.201101550. PMID 21932232.
- ^ Takiguchi, H.; Ohmori, K.; Suzuki, K. (2013). "Synthesis and Determination of the Absolute Configuration of Cavicularin by a Symmetrization/Asymmetrization Approach". Angew. Chem. Int. Ed. 52 (40): 10472–10476. doi:10.1002/anie.201304929. PMID 23956143.
- ^ Zhao, Peng; Beaudry, Christopher M. (2013). "Total Synthesis of (±)-Cavicularin: Control of Pyrone Diels–Alder Regiochemistry Using Isomeric Vinyl Sulfones". Organic Letters. 15 (2): 402–405. doi:10.1021/ol303390a. PMID 23301524.
- ^ Harada, Kenichi; Makino, Kosho; Shima, Naoki; Okuyama, Haruka; Esumi, Tomoyuki; Kubo, Miwa; Hioki, Hideaki; Asakawa, Yoshinori; Fukuyama, Yoshiyasu (2013). "Total synthesis of riccardin C and (±)-cavicularin via Pd-catalyzed Ar–Ar cross couplings". Tetrahedron. 69 (34): 6959–6968. doi:10.1016/j.tet.2013.06.064.



