전환 상태 아날로그
Transition state analog전환 상태 아날로그(전환 상태 아날로그)는 효소 촉매 화학 반응에서 기질 분자의 전환 상태를 닮은 화학 구조를 가진 화학 화합물이다.효소는 변형이나 왜곡을 통해 기질과 상호작용하여 기질을 전이 상태로 이동시킨다.[1]전환 상태 아날로그는 효소의 활성 부위를 차단하여 효소 촉매 반응에서 억제제로 사용할 수 있다.이론은 전이 상태 구조를 닮은 효소 억제제가 실제 기질보다 효소에 더 단단하게 결합될 것이라는 것을 시사한다.[2]전환 상태 아날로그 억제제인 약의 예로는 에이즈 치료 시 뉴라미니드아제 억제제 오셀타미비르, 에이즈 치료 시 HIV 프로테아제 억제제 사퀴나비르 등의 독감 치료제가 있다.
전환 상태 아날로그
구조물의 전환 상태는 채권의 파괴와 형성의 에너지가 전환 상태에서 반응제 또는 생산물로 역방향으로 이동할 수 있는 동등한 확률을 갖는 통계적 역학에 관해서 가장 잘 설명될 수 있다.효소 분석 반응에서, 효소가 높은 에너지 전환 상태를 중간에서 안정화시킬 때 반응의 전반적인 활성화 에너지가 낮아진다.전환 상태 아날로그는 이 높은 에너지 중간을 모방하지만 촉매 화학 반응을 일으키지 않으며 따라서 단순한 기질이나 제품 아날로그보다 훨씬 강한 효소에 결합할 수 있다.
전환 상태 아날로그 설계
전환 상태 아날로그를 설계하기 위해 중추적인 단계는 예를 들어 운동동위원소 효과와 같은 실험 방법을 사용하여 특정 관심 효소에 대한 기질의 전환 상태 구조를 결정하는 것이다.또한, 전환 상태 구조는 KIE의 보완으로서 계산 접근방식으로도 예측할 수 있다.우리는 이 두 가지 방법을 간략히 설명할 것이다.
운동 동위원소 효과
키네틱 동위원소 효과(KIE)는 보다 일반적인 자연 기질에 대한 동위원소 라벨 반응물질의 반응률을 측정하는 것이다.운동동위원소 효과 값은 회전수의 비율이며 반응의 모든 단계를 포함한다.[3]본질적인 운동 동위원소 값은 지면상태의 반응물질에서 원자의 결합 진동환경과 원자의 전환상태의 환경의 차이에서 기인한다.[3]운동 동위원소 효과를 통해 전환 상태가 효소 분석 반응의 어떤 모습인지에 대한 많은 통찰력을 얻을 수 있으며 전환 상태 아날로그의 개발을 이끌 수 있다.
계산 시뮬레이션
계산적 접근방식은 효소의 작용 메커니즘을 해명하는 유용한 도구로 간주되어 왔다.[4]분자역학 자체는 유기반응의 기본인 전자전자를 예측할 수 없지만 분자역학 시뮬레이션은 촉매반응 중 단백질의 유연성을 고려해 충분한 정보를 제공한다.보완 방법은 결합된 분자역학/양자역학 시뮬레이션(QM/MM) 방법이 될 것이다.[5]이 접근법으로 촉매 영역에서 효소 반응을 일으키는 원자들만 양자역학으로 키우고 나머지 원자들은 분자역학으로 처리하게 된다.[6]
전환 상태 아날로그 설계의 예
KIE 또는 연산 시뮬레이션을 사용하여 전환 상태 구조를 결정한 후, 결정된 전환 상태 구조 또는 중간자에 따라 억제제를 설계할 수 있다.다음의 세 가지 예는 기능 그룹을 변경하여 억제제가 전환 상태 구조를 어떻게 모방하는지를 전환 상태 구조의 기하학적 구조와 정전기 분포에 대응하는지 보여준다.
메틸티오아데노신 뉴클레오시다아제 억제제
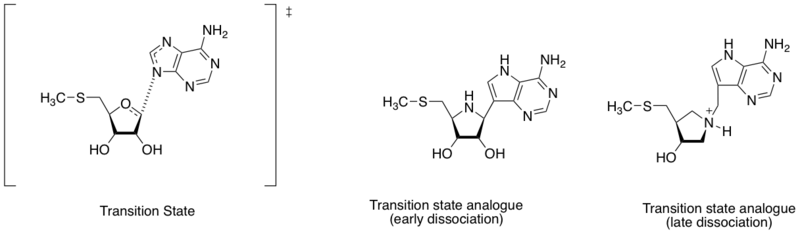
메틸티오아데노신 뉴클레오시디아제는 5'-메틸티오아데노신과 S-아데노실로시스테인의 수성 데데닐화 반응을 촉진하는 효소다.또한 박테리아의 대사 체계에서 중요하고 박테리아에 의해서만 생산되기 때문에 항균 약물 발견의 중요한 대상으로 간주된다.[7]아데닌의 질소 원자와 리보스 변이성 탄소 사이의 다른 거리를 고려할 때(이 섹션의 도표 참조), 전환 상태 구조는 초기 또는 후기 분리 단계에 의해 정의될 수 있다.슈람과 동료들은 서로 다른 전환 상태 구조의 발견에 기초하여 초기 및 후기 분산 전환 상태를 모방한 두 개의 전환 상태 유사점을 설계했다.초기 및 후기 전환 상태 아날로그는 각각 360 pM과 140 pM의 결합 친화력(Kd)을 보였다.[8]
열성신억제제
테르톨리신은 바실러스 열전단백질균이 생산한 효소로 소수성 아미노산을 함유한 펩타이드의 가수분해를 촉진한다.[9]따라서 항균제의 표적이 되기도 한다.효소 반응 메커니즘은 작은 펩타이드 분자를 형성하기 시작하고 아연 결합 물 분자를 열성신 글루143 쪽으로 대체한다.물 분자는 아연 이온과 글루143 잔류물에 의해 활성화되며 카보닐 탄소를 공격하여 사면 전환 상태를 형성한다(그림 참조).홀든과 동료들은 일련의 인포나미드산 펩타이드 유사물을 설계하기 위해 사면체 전이 상태를 모방했다.합성된 아날로그 중 R = L-Leu가 가장 강력한 억제 활성(Ki = 9.1nM)을 가지고 있다.[10]
아르기나제억제제
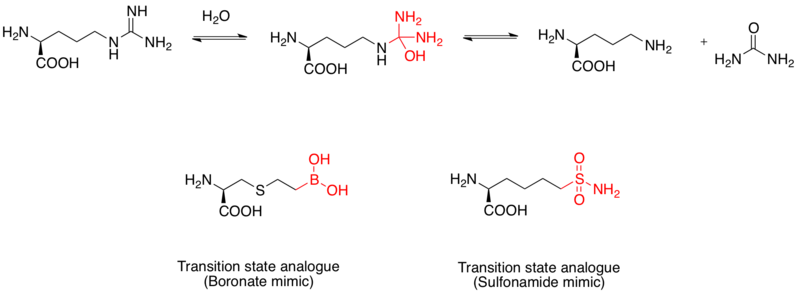
아르기나아제는 L-arginine의 가수분해를 L-ornithine과 요소까지 촉매하는 이핵망간 금속단백질이다.천식 치료의 약물 표적으로도 간주되고 있다.[11]L-arginine의 가수분해 메커니즘은 물에 의한 구아니디노 그룹에 대한 핵포착 공격을 통해 수행되며, 4면 중간을 형성한다.보론산 모이티는 사면체 구성을 채택하고 억제제 역할을 한다는 연구결과가 나왔다.또한, Sulfonamide 기능 그룹도 전환 상태 구조를 모방할 수 있다.[12]보론산의 증거는 X선 결정 구조에 의해 해명된 인간 아르기나제 1의 전환 상태 아날로그 억제제로서 모방한다.[13]
참고 항목
참조
- ^ Silverman, Richard B. (2004). The Organic Chemistry of Drug Design and Drug Action. San Diego, CA: Elsevier Academic Press. ISBN 0-12-643732-7.
- ^ Copeland, R.A.; Davis, J.P.; Cain, G.A.; Pitts, W.J.; Magolda, R.L. (1996). "The Immunosuppressive Metabolite of Leflunomide is a Potent Inhibitor of Human Dihydroorotate Dehydrogenase". Biochemistry. 35 (4): 1270–3. doi:10.1021/bi952168g. PMID 8573583.
- ^ a b Schramm, Vern L (2011). "Enzymatic Transition States, Transition-State Analogs, Dynamics, Thermodynamics, and Lifetimes". Annu. Rev. Biochem. 80 (1): 703–732. doi:10.1146/annurev-biochem-061809-100742. PMC 5502542. PMID 21675920.
- ^ Peter, Kollman; Kuhn, B.; Peräkylä, M. (2002). "Computational Studies of Enzyme-Catalyzed Reactions: Where Are We in Predicting Mechanisms and in Understanding the Nature of Enzyme Catalysis?". J. Phys. Chem. B. 106 (7): 1537–1542. doi:10.1021/jp012017p.
- ^ Hou, G; Hou, G.; Cui, Q. (2011). "QM/MM Analysis Suggests that Alkaline Phosphatase (AP) and Nucleotide Pyrophosphatase/Phosphodiesterase Slightly Tighten the Transition State for Phosphate Diester Hydrolysis Relative to Solution: Implication for Catalytic Promiscuity in the AP Superfamily". J. Am. Chem. Soc. 134 (1): 229–246. doi:10.1021/ja205226d. PMC 3257412. PMID 22097879.
- ^ Schwartz, S; Saen-oon, S.; Quaytman-Machleder, S.; Schramm, V. L.; Schwartz, S. D. (2008). "Atomic Detail of Chemical Transformation at the Transition State of an Enzymatic Reaction". PNAS. 105 (43): 16543–16545. Bibcode:2008PNAS..10516543S. doi:10.1073/pnas.0808413105. PMC 2575456. PMID 18946041.
- ^ Singh, Vipender; Singh V; Lee JE; Núñez S; Howell PL; Schramm VL. (2005). "Transition state structure of 5'-methylthioadenosine/S-adenosylhomocysteine nucleosidase from Escherichia coli and its similarity to transition state analogues". Biochemistry. 44 (35): 11647–11659. doi:10.1021/bi050863a. PMID 16128565.
- ^ Guitierrez, Jemy; Luo, M.; Singh, V.; Li, L.; Brown, R. L.; Norris, G. E. (2007). "Picomolar Inhibitors as Transition-State Probes of 5′-Methylthioadenosine Nucleosidases". ACS Chemical Biology. 2 (11): 725–734. doi:10.1021/cb700166z. PMID 18030989.
- ^ S, Endo (1962). "Studies on protease produced by thermophilic bacteria". J. Ferment. Technol. 40: 346–353.
- ^ Holden, Hazel; Tronrud, D. E.; Monzingo, A. F.; Weaver, L. H. (1987). "Slow-and fast-binding inhibitors of thermolysin display different modes of binding: crystallographic analysis of extended phosphoramidate transition-state analogs". Biochemistry. 26 (26): 8542–8553. doi:10.1021/bi00400a008. PMID 3442675.
- ^ Maarsingh, Harm; Johan Zaagsma; Herman Meurs (October 2009). "Arginase: a key enzyme in the pathophysiology of allergic asthma opening novel therapeutic perspectives". Br J Pharmacol. 158 (3): 652–664. doi:10.1111/j.1476-5381.2009.00374.x. PMC 2765587. PMID 19703164.
- ^ E, Cama; Shin H; Christianson DW. (2003). "Design of amino acid sulfonamides as transition-state analogue inhibitors of arginase". J Am Chem Soc. 125 (43): 13052–7. doi:10.1021/ja036365b. PMID 14570477.
- ^ Shishova, Ekaterina; Luigi Di Costanzo; David E. Cane; David W. Christianson (2009). "Probing the Specificity Determinants of Amino Acid Recognition by Arginase". Biochemistry. 48 (1): 121–131. doi:10.1021/bi801911v. PMC 2665027. PMID 19093830.