EDDS
EDDS | |
| 이름 | |
|---|---|
| IUPAC 이름 에틸렌디아민-N,N′-디부신산[citation needed] | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| 메슈 | N,N'-에틸렌디아민+디부신+아시드 |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C10H16N2O8 | |
| 어금질량 | 292.244 g·190−1 |
| 밀도 | 1.44 g mL−1 |
| 녹는점 | 220 ~ 222 °C(428 ~ 432 °F, 493 ~ 495 K) |
| 산도(pKa) | 2.4 |
| 기본성(pKb) | 11.6 |
| 열화학 | |
의 성 엔탈피 대형화 (ΔfH⦵298) | −1.9541–−1.9463 MJ mol−1 |
의 성 엔탈피 연소시키다 (ΔcH⦵298) | −4.2755–−4.2677 MJ mol−1 |
| 관련 화합물 | |
관련 알카노산 | EDTA |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
에틸렌디아민-N, N'-디스쿠신산(EDDS)은 아미노폴리카르복실산이다.그것은 많은 용도에서 현재 대규모로 사용되고 있는 EDTA에 대해 생물 분해 가능한 대안을 제공할 수 있는 킬레이트화제로 사용되는 무색 고체다.
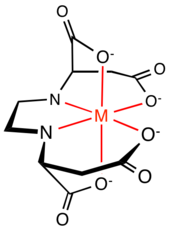
구조 및 특성
EDDS에는 두 개의 치랄 센터가 있으며, 이와 같이 세 개의 스테레오 아토마(steoroomer)가 있다.[1]이들은 항항성(R,R)과 (S,S) 이소머와 아치랄 메소(R,S) 이소머다.EDTA의 생분해성 대체물로서, 오직 (S,S) 입체체만이 관심 대상이다.(R,S)와 (R,R) 입체체는 생분해성이 낮은 반면, (S,S) 입체체는 오염도가 높은 토양에서도 매우 효과적으로 생분해된 것으로 나타났다.[2]
합성
EDDS는 수산과 에틸렌디아민으로부터 처음 합성되었다.[3][4]일부 미생물은 에틸렌디아민과 후마산 또는 말레산으로부터 (S,S)-EDDS의 산업적 규모의 합성을 위해 조작되었으며, 다음과 같이 진행된다.[5]
아스파르트산으로부터
(S,S)-EDDS는 특히 에틸렌디브로마이드를 L-aspartic acid와 알키플레이션하여 생산된다.인종적 EDDS는 에틸렌디아민의 후마산 또는 수산과 반응하여 생성된다.
조정화학
(III) 철분(chilating agents)으로서 (S,S)-EDDS 대 EDTA의 효과를 비교할 때:
| 포메이션 리액션 | 포메이션 상수 |
| [Fe(H2O)6]3+ + (S,S)-EDDS4− → Fe[(S,S)-EDDS]− + 6 H2O | KEDDS = 1020.6 |
| [Fe(H2O)6]3+ + EDTA4− → Fe(EDTA)− + 6 H2O | KEDTA = 1025.1 |
[Fe(S,S)-EDDS]−의 안정성이 낮기 때문에 유용한 범위는 대략 3<pH(S,S)-EDDS<9>와 2<pHEDTA<11>이다.그러나 이 범위는 대부분의 애플리케이션에 충분하다.[6]
(S,S)-EDDS와 EDTA 간에 이루어질 수 있는 또 다른 비교는 킬레이트 단지의 구조다. EDTA의 6개 기증 부지는 금속 이온 주위에 5mb의 첼레이트 링 5개, NCOFe2 링 4개, CNFe22 링 1개를 형성한다.CNFe22 링과 두 개의 NCOFe2 링은 평면을 정의하며, 두 개의 NCOFe2 링은 C-대칭2 축을 포함하는 평면에 수직이다.5mmmb의 고리가 약간 팽팽하다.EDDS의 6개 기증 부위는 금속 이온 둘레에 5mb와 6mb의 첼레이트 링을 형성한다: 2개의 NCOFe2 링, 2개의 NCOFe3 링, 1개의 CNFe22 링.Fe[(S,S)-EDDS]− 복합체의 결정 구조에 관한 연구 결과에 따르면 5mb의 NCOFe3 고리 2개가 복합체 평면 밖으로 투영되어 Fe[EDTA]− 복합체에 존재하는 적도 고리의 변형을 감소시킨다고 한다.[7]이2 단지는 C 대칭도 가지고 있다.
사용하다
(S,S)-EDDS는 EDTA의 대안을 제공하는 생분해성 킬레이트화제로, 이 중 연간 8000만 킬로그램이 생산된다.자연상태에서 EDTA는 에틸렌디아미나메트리아세트산으로 전환한 뒤 지속적인 유기오염물질로 환경에 축적되는 디케토피페라진(Diketopiperazine)으로 사이클화한 것으로 밝혀졌으며,[8][9] (S,S)-EDDS는 생분해성 첼레이터로 상업적으로 개발되어 세제 및 화장품 제형에 안정화제가 되었다.[10]언제 EDDSchemical-enhanced 토양 환경 복원에 과도한 경우(예를 들어,ex-situ 토양 세척을 위해 적용되)적용되면 중금속에 대한 높은 추출 효율성과 추출의 양이 EDDS 복용량으로 독립적이다;반면에[11]는 지속적인 홍조, 금속 extr에 포함되어 있는 토양 환경 복원 중에 달성할 수 있다.교류종종 EDDS의 양에 의해 제한된다.EDDS 결핍에서는 중금속의 초기 비선택적 추출이 관찰되었고, 이어 중금속 교환과 EDDS로 안정성이 상수인 중금속의 재흡수가 관찰되었다.[12]
외부 링크
참조
- ^ Neal, J. A.; Rose, N. J. (1968). "Stereospecific Ligands and Their Complexes. I. A Cobalt(III) Complex of Ethylenediaminedisuccinic Acid". Inorganic Chemistry. 7 (11): 2405–2412. doi:10.1021/ic50069a043.
- ^ Tandy, S.; Ammann, A.; Schulin, R.; Nowack, B. (2006). "Biodegredation and speciation of residual SS-ethylenediaminedisuccinic acid (EDDS) in soil solution left after soil washing". Environmental Pollution. 142 (2): 191–199. doi:10.1016/j.envpol.2005.10.013. PMID 16338042.
- ^ Barbier, M.; et al. (1963). "Synthese und Eigenschaften eines Analogen des Lycomarasmins und der Aspergillomarasmine". Liebigs Annalen. 668: 132–138. doi:10.1002/jlac.19636680115.
- ^ 미국 특허권 3158635, 케제리안, 찰스; 램지, 윌리엄 M, "직경과 불포화산의 비사덕트" 1964-11-24를 발행했다.
- ^ Takahashi, R.; et al. (1999). "Production of (S,S)-Ethylenediamine-N,N'-disuccinic Acid from Ethylenediamine and Fumaric Acid by Bacteria". Biosci. Biotechnol. Biochem. 63 (7): 1269–1273. doi:10.1271/bbb.63.1269. PMID 27380235.
- ^ Orama, M.; Hyvönen, H.; Saarinen, H.; Aksela, R. (2002). "Complexation of [S,S] and mixed stereoisomers of N,N'-ethylenediaminedisuccinic acid (EDDS) with Fe(III), Cu(II), Zn(II) and Mn(II) ions in aqueous solution". J. Chem. Soc., Dalton Trans. (24): 4644–4648. doi:10.1039/b207777a.
- ^ Pavelčík, F; Majer, J. (1978). "The crystal and molecular structure of lithium [(S,S)-N,N'-ethylenediaminedisuccinato]cobaltate(III) trihydrate". Acta Crystallographica B. 34 (12): 3582–3585. doi:10.1107/S0567740878011644.
- ^ Yuan, Z.; VanBriesen, J. M. (2006). "The Formation of Intermediates in EDTA and NTA Biodegradation". Environmental Engineering Science. 23 (3): 533–544. doi:10.1089/ees.2006.23.533.
- ^ Yip, T.C.M.; Tsang, D.C.W.; Ng, K.T.W.; Lo, I.M.C. (2009). "Kinetic interactions of EDDS with soils. 1. Metal resorption and competition under EDDS deficiency". Environ. Sci. Technol. 43 (3): 831–836. Bibcode:2009EnST...43..831Y. doi:10.1021/es802030k. PMID 19245023.
- ^ Schowanek, D.; Feijtel, T.C.J.; Perkins, C.M.; Hartman, F.A.; Federle, T.W.; Larson, R.J. (1997). "Biodegradation of (S,S), (R,R) and mixed stereoisomers of ethylene diamine disuccinic acid (EDDS), a transition metal chelator". Chemosphere. 34 (11): 2375–2391. doi:10.1016/S0045-6535(97)00082-9. PMID 9192467.
- ^ Yip, T.C.M.; Tsang, D.C.W.; Ng, K.T.W.; Lo, I.M.C. (2009). "Empirical modeling of heavy metal extraction by EDDS from single-metal and multi-metal contaminated soils". Chemosphere. 74 (2): 301–307. Bibcode:2009Chmsp..74..301Y. doi:10.1016/j.chemosphere.2008.09.006. PMID 18851868.
- ^ Tsang, D.C.W.; Yip, T.C.M.; Lo, I.M.C. (2009). "Kinetic interactions of EDDS with soils. 2. Metal-EDDS complexes in uncontaminated and metal-contaminated soils". Environ. Sci. Technol. 43 (3): 837–842. Bibcode:2009EnST...43..837T. doi:10.1021/es8020292. PMID 19245024.