우주 비행 중 방사선 피폭으로 인한 중추신경계 영향
Central nervous system effects from radiation exposure during spaceflight이 글에는 여러 가지 문제가 있다. 이 문제를 개선하거나 대화 페이지에서 토의하십시오. (이러한 템플릿 메시지를 제거하는 방법 및 시기 알아보기)
|
지구의 보호 대기권, 자력권, 중력장 밖으로 여행하는 것은 인간의 건강을 해칠 수 있으며, 성공적인 유인 우주 비행을 위해서는 그러한 해악을 이해하는 것이 필수적이다. 중추신경계에 대한 잠재적 영향은 특히 중요하다. 활발한 지상 기반 세포 및 동물 모델 연구 프로그램은 향후 장거리 우주 임무에 대한 우주 방사선 피폭으로 인한 CNS의 위험을 계량화하고 최적화된 대응책 개발을 촉진하는 데 도움이 될 것이다.
은하 우주선(GCR)과 태양 양성자 사건(SPE)에서 CNS에 발생할 수 있는 급성 및 후발 위험은 태양계 인간 탐사에 대한 문서화된 우려사항이다.[1][2][3] 과거에는 저선량에서 중간 선량의 전리방사선(0~2 Gy(회색)(Gy = 100 rad))에 노출된 성인의 CNS에 대한 위험이 주요 고려 대상이 아니었다. 그러나 우주방사선의 중이온 성분은 지상방사선의 형태에 의해 제시되는 물리적 도전과 비교하여 세포와 조직에 뚜렷한 생물물리학적 난제를 나타낸다. 우주 광선이 발견된 직후, CNS 위험에 대한 우려는 망막의 단일 HZE 핵 통과에서 발생하는 빛 섬광 현상의 예측에서 비롯되었다;[4] 이 현상은 1970년과 1973년에 아폴로 우주 비행사들에 의해 확인되었다. HZE 핵은 조직을 통과하는 경로를 따라 심하게 손상된 세포 기둥, 즉 마이크로레시온을 생성할 수 있어 CNS에 심각한 영향을 미칠 수 있다는 우려를 낳고 있다.[5] 최근에는 CNS의 실험모델에서 관찰된 HZE 핵에 의한 신경유전 발견과 그 영향과 함께 다른 우려가 발생하고 있다.
인간 역학은 암, 급성 방사선 위험, 백내장의 위험 추정을 위한 기초로 사용된다. 그러나 이 접근방식은 우주 방사선에 의한 CNS 위험을 추정하는 데는 실행 가능하지 않다. 몇몇 Gy 이상의 선량에서, 해로운 CNS 변화는 암에 대해 방사선 치료(예: 감마선과 양성자)를 받는 인간에게 발생한다. 50 Gy의 치료 선량이 대표적이며, 이는 큰 SPE가 발생하더라도 우주에서의 피폭보다 훨씬 높다. 따라서, 우주 방사선 위험의 네 가지 범주(암, CNS, 퇴행성 및 급성 방사선 증후군) 중 CNS 위험은 증거 기반을 위해 동물과의 실험 데이터에 가장 광범위하게 의존한다. CNS 위험을 이해하고 완화하려면 세포와 동물 모델에서 얻은 기본적 이해와 위험을 추정하는 접근법의 개발 및 우주비행사에 대한 대응책의 잠재적 편익을 이끌어내는 활발한 연구 프로그램이 필요하다.
우주 방사선을 시뮬레이션하는 중이온 빔을 사용하는 여러 실험 연구는 우주 방사선에 의한 CNS 위험에 대한 건설적인 증거를 제공한다. 첫째, 낮은 용량(<50 cGy)에서 HZE 핵에 노출되면 마우스와 랫드의 작동자 반응뿐만 아니라 학습과 행동 변화와 같은 신경인지적 결손을 유의하게 유발한다. 동일하거나 더 높은 저LET 방사선량(예: 감마선 또는 X선)에 대한 피폭은 유사한 영향을 나타내지 않는다. HZE 핵에 대한 노출에 따른 성능결손의 문턱은 선형 에너지 전달(LET)과 같은 입자의 물리적 특성과 노출 시 동물 연령 모두에 따라 달라진다. 성능 적자는 화성 임무에서 발생할 것과 유사한 선량(<0.5 Gy)에서 발생하는 것으로 나타났다. 도파민성 신경계에 의한 신경인지결손은 노화와 유사하며 우주방사선에만 있는 것으로 보인다. 둘째, HZE에 대한 피폭은 낮은 용량(<1 Gy)에서 생쥐의 신경생성을 교란시켜 해마 틀니테이트회(SGZ)의 하위영역(Sub granular zone, SGZ)에서 새로운 뉴런과 올리고덴드로스의 유의한 용량 관련 감소를 보여준다. 셋째, 뉴런 전구세포의 활성산소종(ROS)은 HZE 핵 및 양성자에 저선량 피폭 후 발생하며, 수개월 동안 지속될 수 있다. 항산화제와 항염증제는 이러한 변화를 줄일 수 있다. 넷째, 신경인플레이션은 HZE 핵 및 양성자에 대한 피폭 후 CNS에서 발생한다. 또한, 나이와 관련된 유전적 변화는 방사선에 대한 CNS의 민감도를 증가시킨다.
HZE 핵으로 조사된 동물 모델을 사용한 연구는 CNS에 대한 중요한 변화가 NASA에 관심 있는 선량 수준에 따라 발생한다는 것을 보여주었다. 그러나 이러한 결과가 우주 비행사들에 대한 병적인 정도에 대한 중요성은 설명되지 않았다. 후기 조직 효과의 한 모델은 낮은 선량에서 상당한 영향이 발생하지만 지연 시간이 증가한다는 것을 시사한다. 지금까지 수행된 연구는 비교적 적은 수의 동물([1회 선량 그룹당])로 수행되었으므로, 낮은 선량(< 0.5 Gy)에서 선량 임계값 효과에 대한 시험이 현재 충분히 수행되지 않았다는 점에 유의해야 한다. 동물에서 인간에게 미치는 우주방사선 영향 추론 문제는 우주방사선 연구의 과제가 될 것이기 때문에, 이러한 연구는 동물 연구에 사용되는 인구 규모에 의해 제한될 수 있다. 게다가, 선량 굴절의 역할은 현재까지 연구되지 않았다. 우주비행사의 가능한 인지 변화, 성능 저하 또는 늦은 CNS 효과에 대한 기존 관찰 결과를 추정하는 접근법은 발견되지 않았다. 시스템 생물학의 새로운 접근방식은 이 도전에 대처하기 위한 흥미로운 도구를 제공한다. 최근 CNS 리스크를 투영하기 위해 8개의 간격이 확인되었다. 우주방사선에서 CNS의 위험투영 모델을 개발하는 데 필요한 데이터와 지식을 제공하기 위해 위험평가에 대한 새로운 접근방식에 대한 연구가 필요할 수 있다.
중추신경계(CNS)에 대한 급성 및 후기 방사선 손상은 운동기능 및 행동의 변화나 신경장애로 이어질 수 있다. 다른 우주 비행 인자와 방사선의 방사선 및 시너지 효과는 신경 조직에 영향을 미칠 수 있으며, 이는 기능이나 행동의 변화를 초래할 수 있다. 우주 비행 환경에 특정한 데이터는 이 위험의 크기를 정량화하기 위해 수집되어야 한다. 이것이 충분히 큰 위험으로 식별되는 경우 적절한 보호 전략을 채택해야 한다.
— Human Research Program Requirements Document, HRP-47052, Rev. C, dated Jan 2009.[7]
소개
GCR과 SPE 모두 CNS 리스크가 우려된다. 주요 GCR은 양성자, α 입자 및 HZE 핵 입자로 구성되며, 몇 십에서 10,000 MeV/u 이상의 광범위한 에너지 스펙트럼이 있다. 행성간 공간에서는 GCR 장기 선량과 선량당량이 각각 0.2 Gy 또는 0.6 Sv를 초과할 것으로 예상된다.[8][9] GCR의 높은 에너지는 어떤 물질도 수백 센티미터까지 침투할 수 있게 하므로 CNS의 GCR 위험에 대한 타당한 경감 대책으로서 방사선 차폐를 배제한다. SPE의 경우, 승무원이 얇은 차폐 우주선에 탑승하거나 우주 유영을 수행하는 경우 SPE로부터 1 Gy 이상의 흡수 선량에 대한 가능성이 존재한다.[10] SPE의 에너지는 실질적이긴 하지만(수백 MeV까지 증가) 잠재적 대책으로서 방사선 차폐를 배제하지는 않는다. 그러나 차폐 비용은 가장 큰 사건으로부터 보호하기 위해 높을 수 있다.
충전된 입자가 우주비행사의 뇌에 부딪히는 유량은 과거에 여러 번 추정되었다.[11][12][13] 한 가지 추정치는 (GCR의 1972년 스펙트럼을 가정했을 때) 태양 최소로 화성으로 가는 3년간의 임무 동안, 해마 세포 4300만 개 중 2,000만 개와 시상하부 세포핵 130만 개 중 23만 개가 Z> 15로 하나 이상의 입자에 의해 직접 타격될 것이라는 것이다.[14][15] 이러한 수치에는 HZE 핵 또는 상관관계가 있는 세포 손상의 트랙을 따라 생성되는 정력 전자(델타 광선)에 의한 추가 세포 적중량은 포함되지 않는다.[16][17] GCR로부터의 델타 광선과 상관관계가 있는 세포 손상의 기여는 각각 1차 선로 추정치보다 2배에서 3배 정도 손상된 세포의 수를 증가시키며, 이질적인 손상 부위의 가능성을 제시한다. 그러한 추가 손상의 중요성은 잘 이해되지 않는다.
이 때, GCR의 HZE 구성 요소로부터 우주 비행사의 CNS에 미칠 수 있는 해로운 영향은 아직 밝혀지지 않았다. 이는 위험을 추정할 수 있는 인간 역학 기준이 부족한 점과 동물과 함께 발표된 실험연구가 상대적으로 적은 탓이 크다. RBE 요인은 인간 데이터와 결합하여 저LET 방사선 피폭에 대한 암 위험을 추정한다. CNS 위험에 대해서는 이 접근법이 가능하지 않기 때문에, 위험 추정에 대한 새로운 접근법이 필요할 것이다. 따라서 생물학적 연구는 위험 수준과 위험 예측 모델을 설정하고 위험 수준이 유의하다고 판단될 경우 대응책을 설계하기 위해 필요하다.
NASA의 중추신경계 위험에 대한 설명
우주복사로 인한 급성 및 후기 CNS 위험은 달이나 화성에 대한 탐사 임무의 관심사다. 급성 CNS 위험에는 변화된 인지 기능, 감소된 운동 기능, 그리고 행동 변화가 포함되며, 이 모든 것은 성과와 인간의 건강에 영향을 미칠 수 있다. 늦은 CNS 위험은 알츠하이머병, 치매 또는 조기 노화와 같은 신경학적 장애일 수 있다. 최대 2 Gy의 선량에 대한 양성자, HZE 입자 및 관련 에너지의 중성자의 낮은 선량률(<50 mGy h–1)에 대한 CNS 장기 노출의 영향이 우려된다.
현재 NASA 허용 노출 한도
단기 및 경력 우주비행사의 우주 방사능 노출에 대한 PEL은 NASA 최고 보건의료 책임자에 의해 승인되었다. PELs는 NASA-STD-3001, 1권 에서 권장한 대로 임무 설계와 승무원 선택에 대한 요건과 표준을 정했다. NASA는 1970년부터 BFO, 피부, 렌즈에 대한 암 위험과 비암 위험에 대한 선량 제한을 사용해 왔다. 탐사 임무 계획의 경우 CNS 위험에 대한 예비 선량 한계는 주로 동물 모델에 대한 실험 결과에 기초한다. 그러나 이러한 위험을 검증하고 계량화하고 선량 한계에 대한 값을 세분화하기 위해서는 추가 연구가 필요하다. 해마라고 불리는 뇌의 부위에서 선량에 해당하는 CNS PEL은 30일 또는 1년의 기간 동안, 또는 각각 500, 1,000, 1,500 mGy-Eq의 값을 갖는 경력에 대해 설정된다. 단위 mGy-Eq를 사용하기는 하지만 CNS 효과에 대한 RBE는 대체로 알려져 있지 않기 때문에, 발암 위험 추정치에 대한 품질 인자 함수의 사용을 지지한다. 충전 Z>10이 있는 입자의 경우, 추가 PEL 요건은 1년 동안의 물리적 선량(mGy)을 각각 100 mGy와 250 mGy로 제한한다. NASA는 해마에서 신체의 자기 차폐를 추정하기 위해 컴퓨터화된 해부학적 기하학적 모델을 사용한다.
증거
인적 자료 검토
지상 형태의 전리방사선이 CNS에 미치는 영향에 대한 증거는 방사선 치료 환자로부터 문서화되었지만, 이러한 환자들의 선량은 우주 환경에서 우주비행사들이 경험할 수 있는 것보다 더 높다. 만성피로, 우울증 등 CNS 행동변화는 암 치료를 위해 조사 중인 환자에게서 발생한다.[18] 특히 어린이의 신경인지 효과는 낮은 방사선량에서 관찰된다.[19][20] 뇌종양 치료 후 아이들의 지능과 학업성취도에 대한 최근의 리뷰는 방사선 노출이 낮은 지능지수(IQ) 점수, 언어능력, 수행IQ 등 지능과 학업성취의 하락과 관련이 있다는 것을 보여준다; 독해, 철자, 수학에서의 학업성취도.cs; 그리고 주의 기능.[21] 임신 8~15주 후 적당한 용량(<2 Gy)으로 전전적으로 방사선에 노출된 일본의 원자폭탄 생존자 자녀에게서 정신지체가 관찰되었지만, 임신 초기나 후기에는 관찰되지 않았다.[20]
하는 종양 몇개의 양성자와 다른charged 입자 기둥을 세워 치료의 CNS 대한 방사선 영향을 고려하고. 방사선 방호 측정 심의회 보고서 제153[3]노트"뇌하수체 tumors,[22][23]hormone-responsive 전이성 유방 carcinoma,[24]뇌의 치료와intracran tumors,[25][26]을 입자 사용료 보조 데이터를 제공한다.ial 동정맥 malfo양배추와 다른 뇌혈관 질환."[27][28][29][30][31][32] 이러한 연구에서는 사회적 행동의 변화뿐만 아니라 인지 기능, 언어 습득, 시각적 공간 능력, 기억력과 임원 기능 등의 신경학적 합병증과의 연관성이 발견된다. 화학요법으로 치료를 받은 환자들에게도 이와 유사한 효과가 나타나지 않았다. 이 모든 예에서 환자들은 괴사 기준치를 밑도는 극도의 고선량으로 치료를 받았다.[33][34] 인지 기능과 기억력은 전두엽/전측엽의 대뇌 백색 볼륨과 밀접한 관련이 있으므로 신경생성 결함은 조사 대상 환자의 신경인지 문제에 중요한 역할을 할 수 있다.[3]
우주 비행 문제 검토
우주 방사선이 CNS에 미치는 영향에 관한 첫 번째 제안은 1952년 코넬리우스 토바이어스가 망막의 단일 HZE 핵 통과에 의한 빛 섬광 현상에 대한 그의 설명에서 나왔다.[35] 토바이어스가 설명한 것과 같은 섬광은 아폴로 초기 임무뿐만 아니라 아폴로 임무와 스카이랩 임무에서 수행된 전용 실험에서도 우주 비행사들이 관측했다.[36] 더 최근에는 러시아 미르 우주정거장과 ISS에서 빛 섬광에 대한 연구가 이루어졌다.[37] NAS의 1973년 보고서는 이러한 영향을 상세히 고려했다. 포스페인으로 알려진 이 현상은 깜박이는 빛의 시각적 지각이다. 단순히 안구에 압력을 가하는 것만으로 발생할 수 있어 주관적인 빛의 감각으로 평가된다.[3] 후두피질이나 망막을 통과하는 고충전된 단일 입자의 통과는 빛 섬광을 일으킬 수 있는 것으로 추정되었다. HZE 유도 광 섬광의 가능한 메커니즘에는 망막 내의 방향 이온화와 세렌코프 방사선이 포함된다.[2]
우주비행사들의 빛 섬광 관찰은 HZE 핵이 뇌 기능에 미칠 수 있는 영향에 주목하게 했다. HZE 핵이 뇌의 중요한 영역을 가로지르는 경로를 둘러싸고 있는 손상된 세포 기둥의 영향을 고려했던 마이크로레션 개념은 이때부터 시작되었다.[2][5] 여전히 남아 있는 중요한 과제는 그러한 입자 통과가 CNS 내의 기능 저하에 기여하는지 여부와 그 정도를 결정하는 것이다.
과거 NASA 임무에 참여했던 우주 비행사들에게서 CNS 효과를 관찰할 수 있는 가능성은 여러 가지 이유로 인해 매우 희박하다. 첫째, 과거 임무의 길이는 비교적 짧고 우주비행사의 인구 규모는 작다. 둘째로, 우주비행사들이 LEO를 여행할 때, 그들은 자기장과 지구의 고체체들에 의해 부분적으로 보호되며, 이것은 함께 GCR 선량률을 그것의 자유 공간 값에서 약 3분의 2까지 감소시킨다. 더욱이, LEO의 GCR은 화성이나 달 표면으로 이동할 때 만나게 될 GCR에 비해 낮은 LET 성분을 가지고 있는데, 이는 지구의 자기장이 LET가 더 높은 약 1,000 MeV/u 이하의 에너지를 가진 핵들을 물리치기 때문이다. 이러한 이유로, CNS 위험은 ISS에서의 임무보다 장기간 달 임무나 화성 임무에 더 큰 관심사다.
양성자, 중성자 및 고-Z 고에너지 핵에 대한 중추신경계 위험에 대한 방사선 생물학 연구
GCR과 SPE 모두 우주 비행사의 건강과 성능에 대한 급성 및 늦은 CNS 위험에 기여할 수 있다. 이 절에는 세포, 조직 및 동물 모델에서 우주 방사선의 영향에 대해 수행된 연구가 설명되어 있다.
신경세포와 중추신경계의 영향
신경생식
CNS는 다발성 줄기세포에서 생성되는 뉴런, 아스트로시테스, 올리고덴드로시테스로 구성되어 있다. NCRP 보고서 153번은 CNS의 방사선 연구에 대한 관심 구성과 세포 유형에 대해 다음과 같은 우수하고 짧은 소개를 제공한다:[3] "CNS는 단위 면적당 크기와 수가 현저하게 다른 뉴런으로 구성되어 있다. 촘촘히 채워진 뉴런 세포체(예: 제4 심실 바닥의 호흡기와 심장 중심)로 구성된 핵이나 중심부가 여러 개 있다. 대뇌피질에서는 베츠 세포와 같은 큰 뉴런 세포체가 상당한 거리에 의해 분리된다. 추가로 중요한 것은 아스트로시테스, 올리고덴드로글리아, 미세글로 구성된 지지세포인 신경글리아다. 이 세포들은 CNS의 신경조직에 스며들어 지지하며, 혈관조직도 지탱하는 비계처럼 함께 묶는다. 신경글리아 중 가장 많은 수가 1형 아스트로사이테스로 뇌의 절반 정도를 차지해 뉴런 수를 크게 앞질렀다. 신경글로리아는 뉴런과 대조적으로 세포분열의 능력을 유지하므로, 방사선에 대한 반응은 세포 종류마다 다르다. 뇌에 있는 세 번째 유형의 조직은 몸의 다른 곳에서 발견되는 방사선 손상에 대해 비교할 수 있는 취약성을 보이는 혈관 조직이다.[38] 혈관조직의 과두정맥과 내피세포에 대한 방사선유발성 손상은 저LET 방사선을 많이 투여한 후 발생할 수 있는 뇌손상의 병원생성의 주요 측면을 설명한다. 저LET 방사선을 이용한 연구에 기초하여 CNS는 방사상 조직으로 간주된다. 예를 들어, 방사선 치료에서 성인의 초기 뇌 합병증은 하루 분율이 2 Gy 이하인 경우 총 선량이 최대 50 Gy인 경우 발병하지 않는다.[3] 다른 조직과 마찬가지로 CNS의 허용오차 선량은 조사된 인간의 뇌에서 부피와 특정한 해부학적 위치에 따라 달라진다.[19]
최근 몇 년 동안 줄기세포를 이용한 연구는 기억력이나 학습과 같은 인지 작용이 결정되는 성인 해마에서 신경 유전자가 여전히 발생한다는 것을 밝혀냈다.[39][40] 이 발견은 우주 방사선의 CNS 위험을 기계적으로 이해하기 위한 접근방식을 제공한다. 축적된 데이터는 방사선이 분화된 신경세포뿐만 아니라 뉴런 전구세포와 심지어 성체줄기세포의 증식과 분화에도 영향을 미친다는 것을 나타낸다. 최근의 증거는 뉴런 세포가 방사선에 민감하다는 것을 지적한다.[18][41][42] 저LET 방사선에 관한 연구는 방사선이 뉴런 세포의 생성을 멈출 뿐만 아니라 뉴런과 다른 신경 세포로 분화시키는 것을 멈춘다는 것을 보여준다. NCRP 보고서 153번에는 틀니트회 SGZ의 세포가 X선 조사의 2 Gy 이상의 용량 의존적 사멸을 겪으며, 성인 수컷 생쥐의 새로운 뉴런 생산은 비교적 낮은 (>2 Gy) X선 선량에 의해 현저하게 감소한다고 언급되어 있다. NCRP 보고서 153번도 다음과 같이 언급한다: "이러한 변화는 선량에 따라 달라지는 것으로 관찰된다. 이와는 대조적으로 새로운 아스트로시테스 또는 과두정체의 생산에는 뚜렷한 영향이 없었다. 활성화된 미세 글리아 측정은 신경생물의 변화가 조사 후 2개월이 지나도 상당한 용량 의존적 염증 반응과 관련이 있음을 나타냈다. 이는 오랜 기간 인지된 방사선 유도 인지 손상의 병원체에는 해마의 SGZ에서 나오는 신경 전구세포의 상실과 신경 유전체의 변화가 수반될 수 있음을 시사한다."
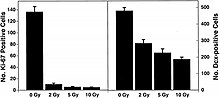
최근의 연구는 CNS에서 HZE 핵의 병원생성에 대한 증거를 제공한다.[43][44][45][46] 이 연구들 중 하나의 저자는 그림 6-1(a)와 같이 HZE 핵으로 신경분석을 제안하는 첫 번째 사람이었다. 이러한 연구는 HZE 방사선이 SGZ 내 뉴런 조제세포의 점진적 상실을 종속적인 방식으로 1~3 Gy의 선량으로 유도했다는 것을 입증한다. NCRP 보고서 153번에는 "Mice는 12C 또는 56Fe-ion의 1~3 Gy로 조사되었고 9개월 후 덴트레이트 SGZ의 세포 증식과 미성숙 뉴런이 정량화되었다. 결과는 이러한 세포의 감소는 선량과 LET에 의존한다는 것을 보여주었다. 전구세포의 상실은 또한 그림 6-1(a)와 6-1(b)에 나타난 바와 같이 변화된 신경생성 및 강력한 염증반응과 관련이 있었다. 이러한 결과는 고LET 방사선이 세포 손실과 미세 환경 변화를 수반하는 해마의 신경 유전체 모집단에 유의하고 오래 지속되는 영향을 미친다는 것을 나타낸다. 그 일은 다른 연구에 의해 확인되었다.[43][44] 이 조사관들은 이러한 변화가 노화과목에서 발견되는 것과 일관된다는 점에 주목해 중입자 조사가 노화 연구에 가능한 모델임을 시사했다.
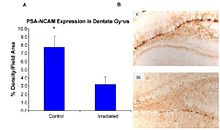
산화손상
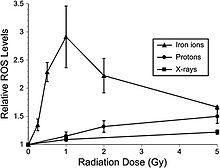
최근의 연구는 해마의 성체 쥐 신경 전구세포가 ROS의 증가를 동반한 급성 용량 의존적 세포 반응을 보인다는 것을 보여준다.[47] Low-LET 양자는 또한 많은 용량에서 메가볼루즈 X 광선에 상대적인 1.1의 RBE에서 임상 양성자 빔 방사선 치료에도 사용된다. NCRP 보고서 153번에는 다음과 같이 언급되어 있다: "상대적 ROS 수준은 비방사성 대조군에 비하여 비방사성 대조군(6~24시간) 시간에 Bragg-peak 250 MeV 양성자의 거의 모든 용량(1~10 Gy)에서 증가되었다.[48] 양성자 조사 후 ROS의 증가 속도는 X선으로 관측된 것보다 더 빨랐고 6시간과 24시간에서 선량 반응이 잘 나타나 Gy 당 3%의 비율로 대조군에 비해 약 10배 증가했다. 그러나 방사선이 발생한 후 48시간이 지나자 ROS 수치가 통제 아래로 떨어졌고 미토콘드리아 함량의 경미한 감소와 일치했다. 항산화 알파-리포산(조사 전 또는 조사 후)의 사용은 방사선으로 인한 ROS 수치의 상승을 제거하는 것으로 나타났다. 이러한 결과는 X선을 이용한 이전의 연구를 확증하고 상승된 ROS가 신경 전구세포의 방사선에 필수적이라는 추가적인 증거를 제공한다." 또한 고LET 방사선은 저선량(≤1 Gy)에서 저선량(≤1 Gy)에서 저선량(X선, 양성자)에 비해 해마 전구세포의 산화응력 수준이 상당히 높게 나타났다(그림 6-2). 항산화 리포산을 사용하면 56Fe-ion 조사 전후에 추가했을 때 ROS 수치를 배경 수준 이하로 줄일 수 있었다. 이러한 결과는 56Fe-ion의 낮은 선량이 낮은 선량으로 신경 전구세포에서 상당한 수준의 산화 스트레스를 유발할 수 있다는 것을 결정적으로 보여준다.
신경인플레이션
뇌손상에 대한 근본적인 반응인 신경인플레이션은 레지던트 마이크로글리아와 아스트로사이테스가 활성화되고 광범위한 염증 매개체의 국소적 표현이 특징이다. HZE 노출 이후 마우스 뇌에서 급성 및 만성 신경 팽창이 연구되었다. HZE의 급성 영향은 6 Gy와 9 Gy에서 검출할 수 있다. 낮은 용량에서는 어떤 연구도 이용할 수 없다. 골수 세포 모집은 노출 후 6개월이 지나면 나타난다. 급성 신경염증 반응을 유도하기 위한 HZE 조사의 추정 RBE 값은 감마 조사의 RBE 값과 비교하여 3이다.[46] COX-2 경로는 저LET 방사선에 의해 발생하는 신경염증 과정에 관여한다. 조사된 미세글리아 세포의 COX-2 상향 조절은 프로스타글란딘 E2 생산으로 이어지며, 이는 방사선에 의한 교감증(CNS의 손상된 부위에서 아스트로사이테의 과대확산)의 원인이 되는 것으로 보인다.[50][51][52]
행동 효과
행동 효과는 계량화하기 어렵기 때문에 결과적으로 우주 방사선 위험 중 가장 불확실한 것 중 하나이다. NCRP 보고서 153번은 다음과 같이 언급한다: "행동신경과학 문헌은 사용되는 동물 종, 변형률 또는 측정 방법에 따라 행동 결과의 주요한 차이점들의 예들로 가득 차 있다. 예를 들어, 비방사능 대조군에 비해 X-방사능 생쥐는 반즈 미로에서는 해마에 의존하는 공간 학습과 기억력 장애를 보이지만, 모리스 물 미로에서는 그렇지 않아 쥐의 결손을 입증하는 데 사용될 수 있다.[54][55] 행동에 대한 입자 방사선 연구는 쥐와 생쥐를 사용하여 수행되었지만 측정된 엔드포인트에 따라 결과에 약간의 차이가 있다."
다음의 연구는 우주 방사선이 다소 선량하고 LET 의존적인 방식으로 동물의 CNS 행동에 영향을 미친다는 증거를 제공한다.
센서리모터 효과
56Fe-ion의 저선량에 노출된 랫드에서 센서리모터 결손과 신경화학적 변화가 관찰되었다.[56][57] 1 Gy 미만의 선량은 와이어 서스펜션 테스트에 의해 시험한 대로 성능을 감소시킨다. 행동 변화는 방사선 피폭 후 3일 이내에 관찰되었고 최대 8개월까지 지속되었다. 생화학적 연구는 K+로 유발된 도파민의 방출이 신경 신호 경로의 변화와 함께 조사 그룹에서 현저하게 감소했다는 것을 보여주었다.[58] Pecaut 외 연구진은 암컷 C57/BL6 생쥐가 오픈 필드, 로토드 또는 음향 시작 습관화로 측정한 결과, 0, 0.1, 0.5 또는 2 Gy에 피폭된 후 2~8주 동안 아무런 행동 효과도 나타나지 않았다고 보고했다.[59]
조건부 맛 혐오의 방사선에 의한 변화
조건부 미각 기피증(CTA)의 결손은 중이온의 저선량에 의해 유발된다는 증거가 있다.[60][61][62][63][64] CTA 테스트는 일반적으로 허용되는 식품의 섭취가 질병과 관련되었을 때 발생하는 회피 행동을 평가하는 고전적 조건화 패러다임이다. 이것은 약물 독성의 표준 행동 테스트로 여겨진다.[65] NCRP 보고서 제153호는 "CTA의 방사선 유발 변화에서 도파민계통의 역할은 도파민계통에 의존하는 암페타민 유도 CTA는 방사선에 의해 영향을 받는 반면, 도파민계통이 관여하지 않는 염화수소 유도 CTA는 방사선의 영향을 받지 않는다는 사실에 의해 제안된다"고 언급하고 있다. 방사선에 의한 CTA의 정도는 LET 의존도([그림 6-3]])이며, 56Fe-ion이 시험한 다양한 LET 저·고방사선 유형 중에서 가장 효과적이라는 것이 확인되었다.[61][62] 56Fe-ion의 ~0.2 Gy의 낮은 선량은 CTA에 영향을 미치는 것으로 보인다."
CNS 기능과 인지/행동 성능에 대한 다양한 유형의 중입자의 RBE는 스프래그-다울리 랫드에서 연구되었다.[66] 암페타민 유도 CTA 학습의 HZE 입자 유발 교란에 대한 임계값 사이의 관계는 그림 6-4에 나타나 있으며, 작업자 응답 교란에 대한 관계는 그림 6-5에 나와 있다. 이러한 수치는 CTA 학습과 운영자 응답 모두에 56Fe 또는 28Si 입자에 대한 노출의 파괴적 효과에 대한 유사한 응답 패턴을 보여준다. 이러한 결과는 신경행동장애에 대한 다른 입자의 RBE를 특정 입자의 LET에 근거하여만 예측할 수 없음을 시사한다.



작동자 상태 조절에 대한 방사선 효과
작동자 조건화는 자발적 행동을 수정하기 위해 몇 가지 결과를 사용한다. 라빈 외 연구진의 최근 연구.[67] 상승 고정 비율(FR) 일람표를 사용하여 식품 보강을 얻기 위해 작업자 명령을 수행하는 쥐의 능력을 검사했다. 그들은 2 Gy 이상의 Fe-ion 선량이 증가하는 작업 요구사항에 대한 쥐의 적절한 반응에 영향을 미친다는 것을 발견했다. NCRP 보고서 153호는 "쥐의 작동자 반응 장애는 노출 후 5~8개월 후에 검사했지만 블루베리가 아닌 딸기를 함유한 식단에서 쥐를 유지한 것이 발열을 예방하는 것으로 나타났다"고 지적했다.[68] 조사 후 13개월과 18개월 후 시험했을 때, 대조군으로 유지된 조사 쥐, 딸기 또는 블루베리 식단 사이에 성능 차이는 없었다. 이러한 관찰 결과 항산화 식단의 유익한 효과는 연령에 따라 달라질 수 있다는 것을 알 수 있다.
공간학습과 기억력
HZE 핵에 대한 노출이 공간 학습, 기억 행동, 뉴런 신호에 미치는 영향을 시험했으며, 그러한 영향에 대한 문턱 선량도 고려되었다. 결과를 다른 선량 체계, 입자 유형, 그리고 결국 우주 비행사들에게 추정하기 위해 이러한 결손에 관련된 메커니즘을 이해하는 것이 중요할 것이다. 쥐에 대한 연구는 1.5 GeV/u Feion의 1.5 Gy로 전신 조사 후 1개월 후에 Morris water maze 테스트를 사용하여 수행되었다. 조사된 쥐는 나이가 든 쥐에서 볼 수 있는 것과 유사한 인지 장애를 보였다. 이는 ROS의 양 증대가 방사선 및 연령 관련 인지결손 유도의 원인이 될 수 있는 가능성으로 이어진다.[55]
NCRP 보고서 153번은 다음과 같이 언급한다: "Denisova et al. 랫드를 1.5 Gy의 1 GeV/u56Feion에 노출시키고 8-팔 방사형 미로에서 공간 메모리를 시험했다. 방사선 피폭은 방사형 미로에서 쥐를 제어하는 것보다 더 많은 오류를 범했고 미로를 해결하기 위한 공간 전략을 채택할 수 없었기 때문에 쥐의 인지 행동을 손상시켰다.[69] 이러한 발견이 산화 스트레스, 염증 또는 뉴런 가소성에 대한 민감도의 뇌 영역별 변이와 관련이 있는지를 판단하기 위해 행동과 연계된 선조체, 해마, 전두피질 등 뇌의 세 부위가 격리되어 대조군과 비교되었다. 조사 대상자는 디클로로플루오르세신, 열충격 및 시냅스 단백질(예: 시냅토브레빈, 시냅토피신)의 수준을 통해 반사되어 부정적인 영향을 받았다. 이러한 요인의 변화는 결과적으로 세포 신호를 변화시켰다(예: 칼슘 의존성 단백질 키나아제 C와 단백질 키나제 A). 이러한 뇌 반응의 변화는 방사형 미로에서의 작업 기억 오류와 상당히 관련이 있다. 결과는 56Fe 조사([그림 6-6])에 의해 유도된 뇌 영역별 감도를 보여준다. 이러한 발견은 노령 쥐에서 볼 수 있는 것과 유사하며, 산화 스트레스와 염증 증가가 방사선 및 노령 관련 인지결손 유도의 원인이 될 수 있음을 시사한다."

급성 중추신경계 위험
위에서 설명한 비행 중 성능 및 모터 기술 변화 가능성 외에도 즉각적인 CNS 효과(즉, 저LET 방사선에 노출된 후 24시간 이내)는 거식증과 구역질이다.[70] 이러한 프로드롬 위험은 선량에 의존하며, 따라서 피폭 선량의 지표를 제공할 수 있다. 추정치는 거식증의 경우 ED50 = 1.08 Gy, 메스꺼움의 경우 ED50 = 1.58 Gy, 그리고 ED50 = 2이다.에메시스의 경우 40 Gy. 에메시스를 생성하는 데 있어 다른 방사선 유형의 상대적 효과성은 페렛에서 연구되었고 그림 6-7에 설명되어 있다. 0.5 Gy 미만의 선량에서 고LET 방사선은 저LET 방사선에 비해 상대적으로 생물학적 효과가 크다.[63] CNS에 대한 급성 영향은 사이토카인과 케모카인의 증가와 관련이 있으며, 줄기세포 증식에 지장을 주거나 다른 퇴행성 질환의 원인이 될 수 있는 기억력 상실로 이어질 수 있다.
중추신경계 위험의 컴퓨터 모델 및 시스템 생물학적 분석
우주 방사선에 의한 CNS 위험에 대한 인간 역학 및 실험 데이터는 제한적이기 때문에 포유류 모델은 인간 위험의 불확실성을 이해하는 데 필수적인 도구다. 세포, 조직, 유전자 동물 모델은 시뮬레이션 우주 방사선을 이용한 CNS의 생물학적 연구에 이용되어 왔다. 3차원 세포배양, 마이크로레이, 프로테오믹스, 뇌영상화 등의 신기술이 서로 다른 방사선 유형의 CNS 위험에 대한 체계적인 연구에 사용된다. 생물학적 데이터에 따르면, 수학적 모델을 사용하여 우주 방사선의 위험을 추정할 수 있다.
CNS 질병 진화에 중요한 생화학적 경로를 고려하는 알츠하이머병에 대한 시스템 생물학적 접근법은 NASA 외부에서 자금을 지원한 연구에 의해 개발되었다. 그림 6-8은 알츠하이머병 발병에 중요한 생화학 경로의 도식을 보여주고 있다. 이러한 경로 내에서 공간 방사선의 상호작용에 대한 설명은 공간 방사선 위험에 대한 예측 모델을 개발하는 하나의 접근방식이 될 것이다. 예를 들어, 동물 모델에서 연구된 경로가 알츠하이머병을 앓고 있는 인간의 연구와 상관관계가 있을 수 있다면, 생화학적 자유도를 이용하는 위험을 기술하는 접근법이 추진될 수 있을 것이다. 에델슈타인-케셰트와 스피로스는 알츠하이머병과 관련된 노인성 플라크의 실리코 모델을 개발했다. 이 모델에서 TNF, IL-1B, IL-6 사이의 생화학적 상호작용은 아스트로사이테스, 마이크로글리아, 뉴런을 포함한 몇 가지 중요한 세포군 내에서 설명된다. 또한 이 모델에서는 수용성 아밀로이드가 미세글라스 화학작용을 일으켜 IL-1B 분비를 활성화한다. 그림 6-9는 에델슈타인-케셰트와 스피로스 모델의 플라그 형성과 뉴런 사망을 시뮬레이션한 결과를 보여준다. 우주 방사선에 의해 유발된 변화와 우주 방사선에 의해 발생하는 알츠하이머병의 실리코 모델을 개발하기 위해 이 접근방식에 설명된 변화들 사이의 연관성을 확립하는 것이 추구될 수 있다.
그림 6-8.알츠하이머병에 중요한 분자 경로. 교토 유전자와 게놈 백과사전으로부터. 저작권이 있는 이미지 http://www.genome.jp/kegg/pathway/hsa/hsa05010.html

방사선 유도 퇴행성 CNS 변화 규제에 중요할 수 있는 다른 흥미로운 후보 경로는 Cdk5에 의해 규제되는 신호 전달 경로다. Cdk5는 신경 발달에 중요한 역할을 하는 키나아제로서, 그것의 이상 발현과 활성화는 알츠하이머병을 포함한 신경퇴행성 과정과 관련이 있다.[72][73] 이 키나아제는 전리방사선 피폭 후 신경세포에서 상향조절된다.[74]
탐색 임무 운영 시나리오와 관련된 위험
우주 임무에 대한 투영
우주 임무에 대한 CNS 위험의 신뢰할 수 있는 투영은 이용 가능한 데이터로부터 이루어질 수 없다. 동물 행동 연구에 따르면 고HZE 방사선은 RBE가 높지만 데이터는 일관성이 없다. 기타 불확실성에는 노출 연령, 방사선 품질 및 선량률 영향과 더불어 우주 방사선 피폭에 따른 CNS 위험에 대한 유전적 민감성에 관한 문제가 포함된다. CNS 위험을 추정하기 전에 더 많은 연구가 필요하다.
생물학적 대책 가능성
우주 방사선 연구의 목적은 위험 예측 모델의 불확실성을 추정 및 감소시키고, 필요한 경우 라로 인한 급성 또는 늦은 CNS 영향을 포함하여 단기 및 경력 피폭에 대해 우주 방사선과 관련된 인간 보건 및 성과에 대한 부정적인 결과를 모니터링하고 치료할 수 있는 대응책과 기술을 개발하는 것이다.분뇨 노출 CNS 위험에 대한 대응책의 개발의 필요성은 CNS 위험, 특히 가능한 선량 임계값과 관련된 문제, 그리고 만약 그렇다면 NASA의 임무가 임계 선량을 초과할 가능성이 높은 문제에 대한 추가적인 이해에 달려 있다. 동물실험연구의 결과 항산화 및 항인플레이션은 우주방사선에 의한 CNS 위험에 대한 효과적인 대책이 될 것으로 기대된다.[68] 블루베리와 딸기의 다이어트는 중이온 노출 후 CNS 위험을 줄이는 것으로 나타났다. 식이요법과 영양보충제의 효과를 추정하는 것은 CNS의 대응방안에 대한 연구의 주요 목표가 될 것이다.
과일과 채소가 풍부한 식단은 여러 질병의 위험을 현저하게 감소시킨다. 레티노이드와 비타민 A, C, E는 아마도 가장 잘 알려져 있고 연구되고 있는 천연방사능보호제일 것이지만, 식물 추출물(녹차, 십자가채소 포함)에서 나오는 호르몬(예: 멜라토닌), 글루타티온, 과산화디푸타아제, 그리고 식물 추출물(특히 셀레늄, 아연, 구리염)도 연구되고 있다. 방사능에 과도하게 노출되어 있는 우주 비행사를 포함한 개인들을 위한 건강 보조 [75]식품들 높은 LET에서 자유방사선 매개 간접방사선 손상보다 직접적인 영향이 더 중요하기 때문에 항산화제는 HZE 핵과 같은 고밀도 전리방사선의 초기 피해에 대해 감소하거나 전혀 보호하지 않아야 한다. 다만 염증 및 면역반응과 관련된 지속적인 산화손상에 대해서는 일부 혜택이 발생해야 한다는 기대도 있다.[76] 최근 일부 실험에서는 적어도 급성 고선량 조사의 경우 고LET 방사선에 노출되는 경우에도 건강보조식품에 의한 효율적인 방사선방제를 달성할 수 있다고 제안한다. 비록 증거 때문에 생물학적 효과의 메커니즘 그 급 조사에 비해 낮은 dose-rates에서 다르다 식이 산화 방지제(특히 딸기)HZE particles,[68]의 많은 양의 유해한 영향에서 CNS를 보호할 수 있고 오래 노출을 위한 새로운 연구는 이해하는 데 필요할 것이다.실내 변기생물학적 대책의 잠재적 이익
항산화제의 잠재적인 해로운 영향에 대한 우려는 최근 한 메타 연구로 정상 피험자의 식단에서 항산화제 보충제의 효과에 대해 제기되었다.[77] 이 연구의 저자들은 항산화 보충제가 사망률에 이로운 영향을 미친다는 통계적으로 유의미한 증거를 발견하지 못했다. 반대로, 그들은 β-카로틴, 비타민 A, 비타민 E가 사망 위험을 증가시키는 것처럼 보인다고 결론지었다. 이 산화 방지제는 DNA에 대한 방사선 손상에 따른 유전자 변형이나 변형된 유전체 메틸화 패턴을 여전히 유지하는 세포를 구조할 수 있어 유전체 불안정을 초래할 수 있다는 우려다. 사멸을 위해 손상된 세포를 대상으로 하는 접근방식은 만성적인 GCR 피폭에 유리할 수 있다.
개별위험요인
잠재적으로 중요한 개별적 요인은 유전적 요인, 사전 방사선 피폭 및 뇌진탕과 같은 이전의 머리 부상이다. Apolipoprotein E(ApoE)는 CNS 반응에서 중요하고 일반적인 요인으로 나타났다. ApoE는 세포들 사이의 지질 재분배를 조절하며 뇌에서 높은 수준으로 표현된다.[78] 새로운 연구에서는 구별되는 알레르기로 인코딩되는 아포E의 주요 등소형(form2, ε3, ε4)에 대한 우주방사선의 영향을 고려하고 있다. 이소 형태인 ApoE 44는 인지장애의 위험을 증가시키고 알츠하이머병 발생 연령을 낮추는 것으로 나타났다. 고LET 방사선과 저LET 방사선의 경우 방사선 민감도 또는 다른 개별 위험 요인의 상호작용이 동일한지 여부는 알려져 있지 않다. ApoE의 다른 등소형태는 다른 질병에 더 높은 위험을 준다. ApoE ε4 알레르기를 적어도 한 부 이상 소지한 사람들은 아테롬성 동맥경화증 위험이 증가하는데, 이 또한 방사선에 의해 증가된 위험으로 의심된다. ApoE ε2 알레르기를 두 장 소지한 사람은 고지혈증 타입 III로 알려진 질환에 걸릴 위험이 있다. 따라서 다중화-위험 패러다임에서 유전적 요인을 고려하는 것은 매우 어려울 것이다.
결론
우주 방사선 피폭으로 인한 CNS 위험에 대한 신뢰할 수 있는 예측은 피험자에 대한 데이터의 빈도 때문에 현재로서는 할 수 없다. 기존의 동물과 세포 데이터는 우주 방사선이 신경학적 및 행동적 영향을 미칠 수 있음을 시사한다. 따라서, 임무 수행에 영향을 미칠 가능성이 있다. 그러나 이러한 결과가 우주비행사에 대한 질병성에 미치는 중요성은 설명되지 않았다. 현재까지 비교적 적은 수의 동물(<10개 선량 그룹)로 연구가 수행되었다는 점에 유의해야 한다. 이는 낮은 선량(<0.5 Gy)에서 선량 임계값 효과에 대한 시험이 아직 충분히 수행되지 않았다는 것을 의미한다. 동물에서 인간에게 미치는 우주방사선 영향 추론 문제는 우주방사선 연구의 난제가 될 것이기 때문에, 이러한 연구는 동물 연구에서 일반적으로 사용되는 개체 수에 의해 제한될 수 있다. 게다가, 선량 굴절의 역할은 현재까지 연구되지 않았다. 우주비행사의 가능한 인지 변화, 성능 저하 또는 늦은 CNS 효과에 대한 기존 관찰 결과를 추정하는 접근법은 발견되지 않았다. 우주방사선에서 CNS의 위험투영 모델을 개발하는 데 필요한 데이터와 지식을 제공하기 위해 위험평가에 대한 새로운 접근방식에 대한 연구가 필요할 수 있다. 이러한 문제를 해결하기 위해 필요한 활발한 연구 프로그램은 이 영역에 유용한 인간 전파학 데이터가 없기 때문에 위험 평가 및 대책 검증에 새로운 접근방식에 의존해야 한다.
참고 항목
참조
- ^ NAS/NRC, Task Group on the Biological Effects of Space Radiation, Space Science Board (1996). Radiation hazards to crews on interplanetary missions. Washington, DC: National Academy Press. doi:10.17226/5540. ISBN 978-0-309-05698-4.
- ^ a b c NAS (1973). HZE-particles in manned space flight. Washington, DC: NAS.
- ^ a b c d e f g h i j k l m n NCRP, NCRP Report No 153 (2006). Information needed to make radiation protection recommendations for space missions beyond low-Earth orbit. Bethesda, Md: NCRP. Archived from the original on 2015-06-10.
- ^ Tobias, CA (August 1952). "Radiation hazards in high altitude aviation". The Journal of Aviation Medicine. 23 (4): 345–72. PMID 12980897.
- ^ a b Todd, P (1989). "Stochiastics of HZE-induced microlesions". Adv. Space Res. 9 (10): 31–34. Bibcode:1989AdSpR...9...31T. doi:10.1016/0273-1177(89)90420-1. PMID 11537310.
- ^ Rubin, P; Casarett, GW (1968). Clinical radiation pathology, Vol. II. Philadelphia, Pa: WB Saunders. ISBN 978-0721677903.
- ^ Paloski, W. "Human Research Program Requirements Document" (PDF). NASA. Archived from the original (PDF) on 2009.
- ^ Cucinotta, FA; Wu, H; Shavers, MR; George, K (June 2003). "Radiation dosimetry and biophysical models of space radiation effects". Gravitational and Space Biology Bulletin : Publication of the American Society for Gravitational and Space Biology. 16 (2): 11–8. PMID 12959127.
- ^ Cucinotta, FA; Durante, M (May 2006). "Cancer risk from exposure to galactic cosmic rays: implications for space exploration by human beings". The Lancet Oncology. 7 (5): 431–5. doi:10.1016/S1470-2045(06)70695-7. PMID 16648048.
- ^ Kim, MH; Cucinotta, FA; Wilson, JW (June 2007). "A temporal forecast of radiation environments for future space exploration missions". Radiation and Environmental Biophysics. 46 (2): 95–100. doi:10.1007/s00411-006-0080-1. PMID 17165049. S2CID 40723431.
- ^ Craven, PA; Rycroft, MJ (October 1994). "Fluxes of galactic iron nuclei and associated HZE secondaries, and resulting radiation doses, in the brain of an astronaut". Advances in Space Research. 14 (10): 873–8. Bibcode:1994AdSpR..14..873C. doi:10.1016/0273-1177(94)90552-5. PMID 11540033.
- ^ Curtis, SB; Letaw, JR; Silerberg, R (1989). "Galactic cosmic rays and cell-hit frequencies outside the magnetosphere". Advances in Space Research. 9 (10): 293–8. Bibcode:1989AdSpR...9..293C. doi:10.1016/0273-1177(89)90452-3. PMID 11537306.
- ^ a b Cucinotta, FA; Nikjoo, H; Goodhead, DT (July 1998). "The effects of delta rays on the number of particle-track traversals per cell in laboratory and space exposures". Radiation Research. 150 (1): 115–9. Bibcode:1998RadR..150..115C. doi:10.2307/3579651. JSTOR 3579651. PMID 9650608.
- ^ Curtis, SB; Vazquez, ME; Wilson, JW; Atwell, W; Kim, M; Capala, J (1998). "Cosmic ray hit frequencies in critical sites in the central nervous system". Advances in Space Research. 22 (2): 197–207. Bibcode:1998AdSpR..22..197C. doi:10.1016/S0273-1177(98)80011-2. PMID 11541397.
- ^ Curtis, SB; Vazquez, ME; Wilson, JW; Atwell, W; Kim, MH (2000). "Cosmic ray hits in the central nervous system at solar maximum". Advances in Space Research. 25 (10): 2035–40. Bibcode:2000AdSpR..25.2035C. doi:10.1016/s0273-1177(99)01015-7. hdl:2060/20040110269. PMID 11542854.
- ^ Cucinotta, FA; Nikjoo, H; Goodhead, DT (July 1999). "Applications of amorphous track models in radiation biology". Radiation and Environmental Biophysics. 38 (2): 81–92. doi:10.1007/s004110050142. PMID 10461753. S2CID 9148453.
- ^ Ponomarev A, Cucinotta FA (2006). "Nuclear fragmentation and the number of particle tracks in tissue". Radiat. Protect. Dosimetry. 122 (104): 354–361. doi:10.1093/rpd/ncl465. PMID 17261538.
- ^ a b Tofilon, PJ; Fike, JR (April 2000). "The radioresponse of the central nervous system: a dynamic process". Radiation Research. 153 (4): 357–70. Bibcode:2000RadR..153..357T. doi:10.1667/0033-7587(2000)153[0357:trotcn]2.0.co;2. PMID 10798963.
- ^ a b Schultheiss, TE; Kun, LE; Ang, KK; Stephens, LC (30 March 1995). "Radiation response of the central nervous system". International Journal of Radiation Oncology, Biology, Physics. 31 (5): 1093–112. doi:10.1016/0360-3016(94)00655-5. PMID 7677836.
- ^ a b BEIR-V, National Research Council (1990). Health effects of exposure to low levels of ionizing radiation. Washington, DC: National Academy Press. doi:10.17226/1224. ISBN 978-0-309-03995-6. PMID 25032334.
- ^ Butler, RW; Haser, JK (2006). "Neurocognitive effects of treatment for childhood cancer". Mental Retardation and Developmental Disabilities Research Reviews. 12 (3): 184–91. doi:10.1002/mrdd.20110. PMID 17061287.
- ^ Kjellberg, RN; Kliman, B (1979). "Life-time effectiveness: a system of therapy for pituitary adenomas, emphasizing Bragg peak proton hypophysectomy". In Linfoot, JA (ed.). Recent advances in the diagnosis and treatment of pituitary tumors. NY: Raven Press. pp. 269–288.
- ^ Linfoot, JA (1979). "Heavy ion therapy: alpha particle therapy of pituitary tumors". Recent advances in the diagnosis and treatment of pituitary tumors. NY: Raven Press. pp. 245–267.
- ^ Tobias, CA (1979). "Pituitary radiation: radiation physics and biology". In Linfoot, JA (ed.). Recent advances in the diagnosis and treatment of pituitary tumors. NY: Raven Press. pp. 221–243.
- ^ Castro, JR; Chen, GT; Blakely, EA (1985). "Current considerations in heavy charged-particle radiotherapy: a clinical research trial of the University of California Lawrence Berkeley Laboratory, Northern California Oncology Group, and Radiation Therapy Oncology Group". Radiation Research. Supplement. 8: S263–71. doi:10.2307/3583536. JSTOR 3583536. PMID 3937173.
- ^ Suit, H; Goitein, M; Munzenrider, J; Verhey, L; Blitzer, P; Gragoudas, E; Koehler, AM; Urie, M; Gentry, R; Shipley, W; Urano, M; Duttenhaver, J; Wagner, M (December 1982). "Evaluation of the clinical applicability of proton beams in definitive fractionated radiation therapy". International Journal of Radiation Oncology, Biology, Physics. 8 (12): 2199–205. doi:10.1016/0360-3016(82)90570-3. PMID 6298160.
- ^ Fabrikant, JL; Frankel, KA; Phillips, MH; Lyman, JT; Levy, RP (1989). "Stereotactic heavy-charged-particle BRagg peak radiosurgery for the treatment of intracranial arteriovenous malformations". In Edwards, MSB; Hoffman, HJ (eds.). Cerebral vascular diseases of childhood and adolescence. Baltimore, Md: Williams and Wilkins. pp. 389–409.
- ^ Fabrikant, JI; Lyman, JT; Frankel, KA (1985). "Heavy charged-particle Bragg peak radiosurgery for intracranial vascular disorders". Radiation Research. 8 (Suppl): S244–S258. Bibcode:1985RadR..104S.244F. doi:10.2307/3576654. JSTOR 3576654. PMID 3937172.
- ^ Fabrikant, JI; Lyman, JT; Hosobuchi, Y (June 1984). "Stereotactic heavy-ion Bragg peak radiosurgery for intra-cranial vascular disorders: method for treatment of deep arteriovenous malformations". The British Journal of Radiology. 57 (678): 479–90. doi:10.1259/0007-1285-57-678-479. PMID 6426570.
- ^ Kjellberg, RN; Hanamura, T; Davis, KR; Lyons, SL; Adams, RD (4 August 1983). "Bragg-peak proton-beam therapy for arteriovenous malformations of the brain". The New England Journal of Medicine. 309 (5): 269–74. doi:10.1056/NEJM198308043090503. PMID 6306463.
- ^ Levy, RP; Fabrikant, JI; Frankel, KA; Phillips, MH; Lyman, JT (June 1989). "Stereotactic heavy-charged-particle Bragg peak radiosurgery for the treatment of intracranial arteriovenous malformations in childhood and adolescence". Neurosurgery. 24 (6): 841–52. doi:10.1097/00006123-198906000-00009. PMID 2664546.
- ^ Steinberg, Gary K.; Fabrikant, Jacob I.; Marks, Michael P.; Levy, Richard P.; Frankel, Kenneth A.; Phillips, Mark H.; Shuer, Lawrence M.; Silverberg, Gerald D. (12 July 1990). "Stereotactic Heavy-Charged-Particle Bragg-Peak Radiation for Intracranial Arteriovenous Malformations". New England Journal of Medicine. 323 (2): 96–101. doi:10.1056/NEJM199007123230205. PMID 2359429.
- ^ Goldberg, ID; Bloomer, WD; Dawson, DM (12 March 1982). "Nervous system toxic effects of cancer therapy". JAMA: The Journal of the American Medical Association. 247 (10): 1437–41. doi:10.1001/jama.1982.03320350041026. PMID 7057532.
- ^ Keime-Guibert, F; Napolitano, M; Delattre, JY (November 1998). "Neurological complications of radiotherapy and chemotherapy". Journal of Neurology. 245 (11): 695–708. doi:10.1007/s004150050271. PMID 9808237. S2CID 3027021.
- ^ TOBIAS, CA; ANGER, HO; LAWRENCE, JH (January 1952). "Radiological use of high energy deuterons and alpha particles". The American Journal of Roentgenology, Radium Therapy, and Nuclear Medicine. 67 (1): 1–27. PMID 14903252.
- ^ Pinsky, L. S.; Osborne, W. Z.; Bailey, J. V.; Benson, R. E.; Thompson, L. F. (8 March 1974). "Light Flashes Observed by Astronauts on Apollo 11 through Apollo 17". Science. 183 (4128): 957–959. Bibcode:1974Sci...183..957P. doi:10.1126/science.183.4128.957. PMID 17756755. S2CID 43917453.
- ^ Sannita, WG; Acquaviva, M; Ball, SL; Belli, F; Bisti, S; Bidoli, V; Carozzo, S; Casolino, M; Cucinotta, F; De Pascale, MP; Di Fino, L; Di Marco, S; Maccarone, R; Martello, C; Miller, J; Narici, L; Peachey, NS; Picozza, P; Rinaldi, A; Ruggieri, D; Saturno, M; Schardt, D; Vazquez, M (2004). "Effects of heavy ions on visual function and electrophysiology of rodents: the ALTEA-MICE project". Advances in Space Research. 33 (8): 1347–51. Bibcode:2004AdSpR..33.1347S. doi:10.1016/j.asr.2003.11.007. PMID 15803626.
- ^ Reinhold, H. S.; Hopewell, J. W. (1 July 1980). "Late changes in the architecture of blood vessels of the rat brain after irradiation". British Journal of Radiology. 53 (631): 693–696. doi:10.1259/0007-1285-53-631-693. PMID 7426892.
- ^ Squire, LR (April 1992). "Memory and the hippocampus: a synthesis from findings with rats, monkeys, and humans". Psychological Review. 99 (2): 195–231. doi:10.1037/0033-295X.99.2.195. PMID 1594723. S2CID 14104324.
- ^ Eisch, AJ (2002). "Adult neurogenesis: implications for psychiatry". Plasticity in the Adult Brain: From Genes to Neurotherapy. Progress in Brain Research. Vol. 216. pp. 301–326. CiteSeerX 10.1.1.459.6669. doi:10.1016/S0079-6123(02)38085-3. ISBN 9780444509819. PMID 12432777.
- ^ a b Mizumatsu, S; Monje, ML; Morhardt, DR; Rola, R; Palmer, TD; Fike, JR (15 July 2003). "Extreme sensitivity of adult neurogenesis to low doses of X-irradiation". Cancer Research. 63 (14): 4021–7. PMID 12874001.
- ^ Monje, ML; Mizumatsu, S; Fike, JR; Palmer, TD (September 2002). "Irradiation induces neural precursor-cell dysfunction". Nature Medicine. 8 (9): 955–62. doi:10.1038/nm749. PMID 12161748. S2CID 10347561.
- ^ a b Casadesus, G; Shukitt-Hale, B; Cantuti-Castelvetri, I; Rabin, BM; Joseph, JA (2004). "The effects of heavy particle irradiation on exploration and response to environmental change". Advances in Space Research. 33 (8): 1340–6. Bibcode:2004AdSpR..33.1340C. doi:10.1016/j.asr.2003.12.011. PMID 15803625.
- ^ a b c d Casadesus, G; Shukitt-Hale, B; Stellwagen, HM; Smith, MA; Rabin, BM; Joseph, JA (March 2005). "Hippocampal neurogenesis and PSA-NCAM expression following exposure to 56Fe particles mimics that seen during aging in rats". Experimental Gerontology. 40 (3): 249–54. doi:10.1016/j.exger.2004.09.007. PMID 15763403. S2CID 12158885.
- ^ Rola, R; Otsuka, S; Obenaus, A; Nelson, GA; Limoli, CL; VandenBerg, SR; Fike, JR (October 2004). "Indicators of hippocampal neurogenesis are altered by 56Fe-particle irradiation in a dose-dependent manner". Radiation Research. 162 (4): 442–6. Bibcode:2004RadR..162..442R. doi:10.1667/RR3234. PMID 15447038. S2CID 28785536.
- ^ a b Rola, R; Sarkissian, V; Obenaus, A; Nelson, GA; Otsuka, S; Limoli, CL; Fike, JR (October 2005). "High-LET radiation induces inflammation and persistent changes in markers of hippocampal neurogenesis". Radiation Research. 164 (4 Pt 2): 556–60. Bibcode:2005RadR..164..556R. doi:10.1667/RR3412.1. PMID 16187787. S2CID 25220084.
- ^ Limoli, CL; Giedzinski, E; Rola, R; Otsuka, S; Palmer, TD; Fike, JR (January 2004). "Radiation response of neural precursor cells: linking cellular sensitivity to cell cycle checkpoints, apoptosis and oxidative stress". Radiation Research. 161 (1): 17–27. Bibcode:2004RadR..161...17L. doi:10.1667/RR3112. PMID 14680400. S2CID 5720838.
- ^ Giedzinski, E; Rola, R; Fike, JR; Limoli, CL (October 2005). "Efficient production of reactive oxygen species in neural precursor cells after exposure to 250 MeV protons". Radiation Research. 164 (4 Pt 2): 540–4. Bibcode:2005RadR..164..540G. doi:10.1667/rr3369.1. PMID 16187784. S2CID 25794276.
- ^ Limoli, CL; Giedzinski, E; Baure, J; Rola, R; Fike, JR (June 2007). "Redox changes induced in hippocampal precursor cells by heavy ion irradiation". Radiation and Environmental Biophysics. 46 (2): 167–72. doi:10.1007/s00411-006-0077-9. PMID 17103219. S2CID 9727094.
- ^ Kyrkanides, S; Moore, AH; Olschowka, JA; Daeschner, JC; Williams, JP; Hansen, JT; Kerry O'Banion, M (15 August 2002). "Cyclooxygenase-2 modulates brain inflammation-related gene expression in central nervous system radiation injury". Brain Research. Molecular Brain Research. 104 (2): 159–69. doi:10.1016/S0169-328X(02)00353-4. PMID 12225870.
- ^ Moore, AH; Olschowka, JA; Williams, JP; Okunieff, P; O'Banion, MK (1 May 2005). "Regulation of prostaglandin E2 synthesis after brain irradiation". International Journal of Radiation Oncology, Biology, Physics. 62 (1): 267–72. doi:10.1016/j.ijrobp.2005.01.035. PMID 15850932.
- ^ Hwang, SY; Jung, JS; Kim, TH; Lim, SJ; Oh, ES; Kim, JY; Ji, KA; Joe, EH; Cho, KH; Han, IO (March 2006). "Ionizing radiation induces astrocyte gliosis through microglia activation". Neurobiology of Disease. 21 (3): 457–67. doi:10.1016/j.nbd.2005.08.006. PMID 16202616. S2CID 31123469.
- ^ Raber, J; Rola, R; LeFevour, A; Morhardt, D; Curley, J; Mizumatsu, S; VandenBerg, SR; Fike, JR (July 2004). "Radiation-induced cognitive impairments are associated with changes in indicators of hippocampal neurogenesis". Radiation Research. 162 (1): 39–47. Bibcode:2004RadR..162...39R. doi:10.1667/RR3206. PMID 15222778. S2CID 25568036.
- ^ Shukitt-Hale, B; Casadesus, G; Cantuti-Castelvetri, I; Rabin, BM; Joseph, JA (2003). "Cognitive deficits induced by 56Fe radiation exposure". Advances in Space Research. 31 (1): 119–26. Bibcode:2003AdSpR..31..119S. doi:10.1016/s0273-1177(02)00878-5. PMID 12577981.
- ^ a b Shukitt-Hale, B; Casadesus, G; McEwen, JJ; Rabin, BM; Joseph, JA (July 2000). "Spatial learning and memory deficits induced by exposure to iron-56-particle radiation". Radiation Research. 154 (1): 28–33. Bibcode:2000RadR..154...28S. doi:10.1667/0033-7587(2000)154[0028:SLAMDI]2.0.CO;2. PMID 10856962.
- ^ Joseph, JA; Hunt, WA; Rabin, BM; Dalton, TK (April 1992). "Possible "accelerated striatal aging" induced by 56Fe heavy-particle irradiation: implications for manned space flights". Radiation Research. 130 (1): 88–93. Bibcode:1992RadR..130...88J. doi:10.2307/3578484. JSTOR 3578484. PMID 1561322.
- ^ Joseph, JA; Hunt, WA; Rabin, BM; Dalton, TK; Harris, AH (August 1993). "Deficits in the sensitivity of striatal muscarinic receptors induced by 56Fe heavy-particle irradiation: further "age-radiation" parallels" (PDF). Radiation Research. 135 (2): 257–61. Bibcode:1993RadR..135..257J. doi:10.2307/3578303. JSTOR 3578303. PMID 8367598.
- ^ Joseph, JA; Cutler, RC (17 November 1994). "The role of oxidative stress in signal transduction changes and cell loss in senescence". Annals of the New York Academy of Sciences. 738 (1): 37–43. Bibcode:1994NYASA.738...37J. doi:10.1111/j.1749-6632.1994.tb21787.x. PMID 7832444. S2CID 31028011.
- ^ Pecaut, MJ; Haerich, P; Miller, CN; Smith, AL; Zendejas, ED; Nelson, GA (August 2004). "The effects of low-dose, high-LET radiation exposure on three models of behavior in C57BL/6 mice". Radiation Research. 162 (2): 148–56. Bibcode:2004RadR..162..148P. doi:10.1667/rr3205. PMID 15387142. S2CID 26525020.
- ^ Hunt, WA; Joseph, JA; Rabin, BM (1989). "Behavioral and neurochemical abnormalities after exposure to low doses of high-energy iron particles". Advances in Space Research. 9 (10): 333–6. Bibcode:1989AdSpR...9..333H. doi:10.1016/0273-1177(89)90456-0. PMID 11537313.
- ^ a b Rabin, BM; Hunt, WA; Joseph, JA (July 1989). "An assessment of the behavioral toxicity of high-energy iron particles compared to other qualities of radiation". Radiation Research. 119 (1): 113–22. Bibcode:1989RadR..119..113R. doi:10.2307/3577371. JSTOR 3577371. PMID 2756102.
- ^ a b c Rabin, BM; Hunt, WA; Joseph, JA; Dalton, TK; Kandasamy, SB (November 1991). "Relationship between linear energy transfer and behavioral toxicity in rats following exposure to protons and heavy particles". Radiation Research. 128 (2): 216–21. Bibcode:1991RadR..128..216R. doi:10.2307/3578141. JSTOR 3578141. PMID 1658847.
- ^ a b Rabin, BM; Joseph, JA; Hunt, WA; Dalton, TB; Kandasamy, SB; Harris, AH; Ludewigt, B (October 1994). "Behavioral endpoints for radiation injury". Advances in Space Research. 14 (10): 457–66. Bibcode:1994AdSpR..14..457R. doi:10.1016/0273-1177(94)90500-2. PMID 11539983.
- ^ Rabin, BM; Joseph, JA; Shukitt-Hale, B; McEwen, J (2000). "Effects of exposure to heavy particles on a behavior mediated by the dopaminergic system". Advances in Space Research. 25 (10): 2065–74. Bibcode:2000AdSpR..25.2065R. doi:10.1016/s0273-1177(99)01014-5. PMID 11542858.
- ^ RILEY, ANTHONY L.; TUCK, DIANE L. (1 June 1985). "Conditioned Taste Aversions: A Behavioral Index of Toxicity". Annals of the New York Academy of Sciences. 443 (1 Experimental): 272–292. Bibcode:1985NYASA.443..272R. doi:10.1111/j.1749-6632.1985.tb27079.x. PMID 2990284. S2CID 33754020.
- ^ a b c Rabin, BM; Shukitt-Hale, B; Joseph, JA; Carrihill-Knoll, KL; Carey, AN; Cheng, V (June 2007). "Relative effectiveness of different particles and energies in disrupting behavioral performance". Radiation and Environmental Biophysics. 46 (2): 173–7. doi:10.1007/s00411-006-0071-2. PMID 17058092. S2CID 21525732.
- ^ Rabin, BM; Joseph, JA; Shukitt-Hale, B (2003). "Long-term changes in amphetamine-induced reinforcement and aversion in rats following exposure to 56Fe particle". Advances in Space Research. 31 (1): 127–33. Bibcode:2003AdSpR..31..127R. doi:10.1016/s0273-1177(02)00879-7. PMID 12577984.
- ^ a b c Rabin, BM; Joseph, JA; Shukitt-Hale, B (2 March 2005). "Effects of age and diet on the heavy particle-induced disruption of operant responding produced by a ground-based model for exposure to cosmic rays". Brain Research. 1036 (1–2): 122–9. doi:10.1016/j.brainres.2004.12.041. PMID 15725409. S2CID 24700643.
- ^ a b Denisova, NA; Shukitt-Hale, B; Rabin, BM; Joseph, JA (December 2002). "Brain signaling and behavioral responses induced by exposure to (56)Fe-particle radiation". Radiation Research. 158 (6): 725–34. doi:10.1667/0033-7587(2002)158[0725:bsabri]2.0.co;2. JSTOR 3580733. PMID 12452775.
- ^ Fajaro, LF; Berthong, M; Anderson, RE (2001). Radiation pathology. New York: Oxford University Press. ISBN 978-0195110234.
- ^ a b Edelstein-keshet, L; Spiros, A (7 June 2002). "Exploring the formation of Alzheimer's disease senile plaques in silico" (PDF). Journal of Theoretical Biology. 216 (3): 301–26. Bibcode:2002JThBi.216..301E. doi:10.1006/jtbi.2002.2540. PMID 12183120.
- ^ Catania, A; Urban, S; Yan, E; Hao, C; Barron, G; Allalunis-Turner, J (April 2001). "Expression and localization of cyclin-dependent kinase 5 in apoptotic human glioma cells". Neuro-Oncology. 3 (2): 89–98. doi:10.1215/15228517-3-2-89. PMC 1920606. PMID 11296485.
- ^ Muyllaert, D; Terwel, D; Kremer, A; Sennvik, K; Borghgraef, P; Devijver, H; Dewachter, I; Van Leuven, F (February 2008). "Neurodegeneration and neuroinflammation in cdk5/p25-inducible mice: a model for hippocampal sclerosis and neocortical degeneration". The American Journal of Pathology. 172 (2): 470–85. doi:10.2353/ajpath.2008.070693. PMC 2312368. PMID 18202185.
- ^ Cruz, JC; Tseng, HC; Goldman, JA; Shih, H; Tsai, LH (30 October 2003). "Aberrant Cdk5 activation by p25 triggers pathological events leading to neurodegeneration and neurofibrillary tangles". Neuron. 40 (3): 471–83. doi:10.1016/s0896-6273(03)00627-5. PMID 14642273. S2CID 10549030.
- ^ Durante, M; Cucinotta, FA (June 2008). "Heavy ion carcinogenesis and human space exploration". Nature Reviews Cancer. 8 (6): 465–72. doi:10.1038/nrc2391. hdl:2060/20080012531. PMID 18451812. S2CID 8394210.
- ^ Barcellos-Hoff, MH; Park, C; Wright, EG (November 2005). "Radiation and the microenvironment - tumorigenesis and therapy". Nature Reviews Cancer. 5 (11): 867–75. doi:10.1038/nrc1735. PMID 16327765. S2CID 27710571.
- ^ Bjelakovic, G; Nikolova, D; Gluud, LL; Simonetti, RG; Gluud, C (28 February 2007). "Mortality in randomized trials of antioxidant supplements for primary and secondary prevention: systematic review and meta-analysis". JAMA: The Journal of the American Medical Association. 297 (8): 842–57. doi:10.1001/jama.297.8.842. PMID 17327526.
- ^ Raber, J; Wong, D; Buttini, M; Orth, M; Bellosta, S; Pitas, RE; Mahley, RW; Mucke, L (1 September 1998). "Isoform-specific effects of human apolipoprotein E on brain function revealed in ApoE knockout mice: increased susceptibility of females". Proceedings of the National Academy of Sciences of the United States of America. 95 (18): 10914–9. Bibcode:1998PNAS...9510914R. doi:10.1073/pnas.95.18.10914. PMC 27995. PMID 9724804.
외부 링크
![]() 이 문서는 미국 항공우주국(NASA SP-2009-3405) 문서의 공용 도메인 자료를 통합한다.
이 문서는 미국 항공우주국(NASA SP-2009-3405) 문서의 공용 도메인 자료를 통합한다.



