각도 분해 저준수 간섭계
Angle-resolved low-coherence interferometry각이 분해된 저공해성 간섭계(a/LCI)는 산란 빛의 특성을 이용해 세포핵을 포함한 세포구조의 평균 크기를 측정하는 신흥[when?] 바이오메디컬 영상 기술이다. 이 기술은 불연성 또는 사전 예방적 조직의 상황 탐지를 위한 임상 도구로서 가능성을 보여준다.
소개
A/LCI는 저밀도 간섭계 및 각도 분해 산란을 결합하여 원거리장 회절 패턴을 기반으로 산란기 기하학을 결정하는 역문제를 해결한다. 광학 정합성 영역 반사측정(OCDR) 및 광학 정합성 단층촬영(OCT)과 유사하게 a/LCI는 광원의 정합성 길이로 설정된 깊이 분해능으로 광 구획을 달성하기 위해 중간 계량 체계에서 광대역 광원을 사용한다. 각이 분해한 산란 측정은 산란 각도의 함수로 빛을 포착하고, 산란 구체의 크기를 바탕으로 각도를 예측하는 미에 이론과 같은 계산적 광 산란 모델을 통해 산란 개체의 평균 크기를 추론하기 위해 각도를 반전시킨다. 이러한 기법을 결합하면 조직 샘플 내의 다양한 깊이에서 평균 산포 크기를 측정할 수 있는 시스템을 구축할 수 있다.
현재 이 기술의 가장 중요한 의학적 적용은 평균 세포핵 크기의 측정을 기반으로 조직 건강 상태를 결정하는 것이다. 조직이 정상에서 암으로 변화함에 따라 평균 세포핵 크기가 증가하는 것으로 밝혀졌다.[1] 최근 여러 연구결과에 따르면 a/LCI는 세포핵 측정을 통해 91%의 민감도로 저급 및 고급 이형성화의 존재를 감지하고 97%의 특이성으로 정상과 이형성을 구별할 수 있다.
역사
2000년 이후, 빛 산란 시스템은 세포 형태학의[3] 연구와 이형성증 진단과 같은 생물의학 용도에 사용되어 왔다.[4] 각이나 파장의 함수로서 산란 분포의 변화는 세포의 크기와 핵이나 오르가넬과 같은 세포 이하의 물체에 관한 정보를 추론하는데 사용되었다. 이러한 크기 측정은 신소성 변화(암으로 이어지는 변화)를 포함한 조직 변화를 진단적으로 감지하는 데 사용될 수 있다.
빛 산란 분광법은 인간 환자의 대장, 방광, 자궁경부, 식도 등에서 이형성(異形性)을 검출하는 데 이용되어 왔다.[2] 빛 산란도 배럿의 식도를 감지하는 데 사용돼 왔는데, 이형성증으로 이어질 가능성이 높은 메타폴라스틱 조건이다.[5]
그러나, a/LCI와 대조적으로, 이러한 기법들은 모두 조직 내 깊이의 함수로 결과를 제공하는 능력이 부족한 총 강도 기반 측정에 의존한다.
초기 a/LCI 모델
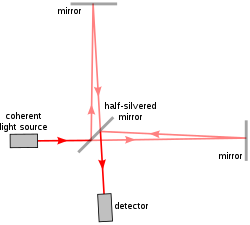
a/LCI의[6] 첫 번째 구현에서는 유명한 Michelson-Morley 실험에서 사용된 것과 동일한 모델인 Michelson 간섭계를 사용했다. Michelson 간섭계는 한 빔의 광선을 두 개의 경로, 즉 하나의 기준 경로와 하나의 샘플링 경로로 분할한 후 다시 결합하여 간섭에 의한 파형을 생성한다. 따라서 기준 빔과 샘플링 빔의 차이는 빛을 산란하는 방식으로 표본의 특성을 나타낸다.
초기 a/LCI 장치는 연구자들이 수집된 백스크래트 빛에서 발생하는 기준 빔의 다른 각도와 깊이를 복제할 수 있도록 기준 암의 이동 가능한 미러와 렌즈를 사용했다. 이를 통해 표본의 다양한 반사 깊이에서 백스캐터된 빛을 분리할 수 있었다. 데이터를 세포 구조의 측정으로 변환하기 위해, 각 산란 분포는 광 산란 패턴에 상대적인 구의 크기를 계산하는 미에 이론의 예측과 비교된다.
a/LCI 기법은 크기가 알려져 있고 상대적으로 균일했던 폴리스티렌 마이크로스피어 연구에서 처음으로 검증되었다.[6] 이후 연구는 세포핵의 비구질적이고 비이종적인 성질을 보상하기 위해 신호처리 방법을 확장했다.[7]
이 초기 시스템은 표본의 1mm² 지점에 대한 데이터를 획득하는 데 최대 40분이 필요했지만 아이디어의 실현 가능성을 입증했다.
푸리에 도메인 구현
A/LCI의 초기 구현은 OPL(Optical Path Length)을 물리적으로 변경하여 데이터를 획득하는 샘플의 깊이를 제어하는 데 의존했다. 그러나 단일 데이터 수집에서 깊이 있는 해결을 위해 푸리에 도메인 구현을 사용할 수 있다는 것이 증명되었다[8]. 광대역 광원은 파장의 스펙트럼을 한 번에 생성하기 위해 사용되며, 백스케이티드 광섬유는 반환 경로에서 일관성 있는 광섬유에 의해 수집되어 서로 다른 산란 각도를 동시에 포착한다.[9] 그런 다음 분광계를 통해 강도를 측정한다. 분광계의 단일 프레임은 파장과 각도의 함수로서 산란 강도를 포함한다. 마지막으로 데이터는 OPL과 각도의 함수로 산란 강도를 생성하기 위해 라인별로 변환된 푸리에다. 결과 영상에서 x축은 OPL을 나타내고 y축은 반사 각도를 나타내며, 따라서 반사 강도의 2D 지도가 산출된다.
이 방법을 사용하면 분광계의 적분 시간에 의해서만 획득 속도가 제한되며 20 ms로 짧을 수 있다. 처음에 획득하는 데 수십 분이 필요했던 동일한 데이터를 최대 10배5 더 빠르게 획득할 수 있다.[9]
개략도 설명
a/LCI 시스템의 Fourier-domain 버전은 광원으로 섬유 결합 출력이 있는 SLD(Superluminscurent Diode)를 사용한다. 광섬유 스플리터는 신호 경로를 90% 강도로, 기준 경로를 10%로 분리한다.
SLD의 빛은 광학 아이솔레이터를 통과하여 양극화 제어기를 통과한다. 광신호를 극대화하고 각 산란과 미에 산란 모델을 비교하기 위해서는 빛 양극화 제어가 중요한 것으로 나타났다.[10] 양극화 유지 섬유가 조명을 표본으로 운반하는 데 사용된다. 두 번째 양극화 제어기는 기준 경로를 통과하는 빛의 양극화를 제어하는 데 유사하게 사용된다.
오른쪽 섬유 출력은 렌즈 L1을 이용해 시준하고 조직을 비춘다. 그러나 전달 섬유가 렌즈의 광학축으로부터 상쇄되기 때문에 빔은 비스듬히 샘플로 전달된다. 백스캐터된 빛은 같은 렌즈에 의해 시준되고 섬유 묶음으로 채집된다. 섬유는 렌즈로부터 하나의 초점 길이, 표본은 다른 쪽의 초점 길이다. 이 구성은 각도의 최대 범위에서 빛을 포착하고, 반사광으로 인한 빛 노이즈를 최소화한다.
섬유 다발의 원위부 끝에서 각 섬유에서 나오는 빛이 분광계에 이미징된다. 샘플과 기준 암에서 나오는 빛은 빔플리팅 큐브(BS)에 의해 혼합되며 영상 분광기의 입구 슬릿에 입사한다. 영상 분광계의 데이터는 신호 처리 및 결과 표시를 위해 범용 직렬 버스 인터페이스를 통해 컴퓨터로 전송된다. 이 컴퓨터는 또한 영상 분광계를 제어한다.
임상 장치 프로토타입
a/LCI 시스템은 최근 핸드헬드 막대를 추가하여 임상 환경에서 작동이 가능하도록 개선되었다. 새 시스템은 양극화 유지 섬유와 인라인 폴라라이저를 이용해 배달섬유의 양극화를 세심하게 제어함으로써 양방향 효과로 인한 신호 저하 없이 핸드헬드 지팡이를 조작할 수 있다. 또한, 새로운 시스템은 프로브 팁에 반반사 코팅 볼 렌즈를 적용하여 시스템의 깊이 범위를 제한하는 반사를 감소시켰다.
휴대용 시스템은 2ftx2ft 광학 브레드보드를 베이스로 사용하며, 소스, 광섬유 부품, 렌즈, 빔플리터, 영상 분광계를 브레드보드에 탑재한다. 알루미늄 커버는 광학 장치를 보호한다. 핸드헬드 프로브가 있는 섬유 프로브는 테스트를 위해 조직 샘플에 쉽게 접근할 수 있도록 한다. 왼쪽에는 하얀색 샘플 플랫폼이 자리 잡고 있으며, 이 플랫폼에는 테스트용 티슈가 놓여 있다. 핸드헬드 프로브는 운영자가 a/LCI 판독값이 획득되는 조직의 특정 부위를 선택하기 위해 사용한다.
참고 항목
참조
- ^ Pyhtila, J; Chalut, K; Boyer, J; Keener, J; Damico, T; Gottfried, M; Gress, F; Wax, A (2007). "In situ detection of nuclear atypia in Barrett's esophagus by using angle-resolved low-coherence interferometry". Gastrointestinal Endoscopy. 65 (3): 487–91. doi:10.1016/j.gie.2006.10.016. PMID 17321252.
- ^ a b Wax, Adam; Pyhtila, John W.; Graf, Robert N.; Nines, Ronald; Boone, Charles W.; Dasari, Ramachandra R.; Feld, Michael S.; Steele, Vernon E.; Stoner, Gary D. (2005). "Prospective grading of neoplastic change in rat esophagus epithelium using angle-resolved low-coherence interferometry". Journal of Biomedical Optics. 10 (5): 051604. Bibcode:2005JBO....10e1604W. doi:10.1117/1.2102767. hdl:1721.1/87657. PMID 16292952.
- ^ Backman, V.; Gopal, V.; Kalashnikov, M.; Badizadegan, K.; Gurjar, R.; Wax, A.; Georgakoudi, I.; Mueller, M.; et al. (2001). "Measuring cellular structure at submicrometer scale with light scattering spectroscopy". IEEE Journal of Selected Topics in Quantum Electronics. 7 (6): 887–893. Bibcode:2001IJSTQ...7..887B. doi:10.1109/2944.983289.
- ^ Wallace, M; Perelman, LT; Backman, V; Crawford, JM; Fitzmaurice, M; Seiler, M; Badizadegan, K; Shields, SJ; et al. (2000). "Endoscopic Detection of Dysplasia in Patients with Barrett's Esophagus Using Light-Scattering Spectroscopy". Gastroenterology. 119 (3): 677–82. doi:10.1053/gast.2000.16511. PMID 10982761.
- ^ Lovat, Laurence B.; Pickard, David; Novelli, Marco; Ripley, Paul M.; Francis, Helen; Bigio, Irving J.; Bown, Stephen G. (2000-04-01). "4919 A novel optical biopsy technique using elastic scattering spectroscopy for dysplasia and cancer in Barrett's esophagus". Gastrointestinal Endoscopy. 51 (4): AB227. doi:10.1016/S0016-5107(00)14616-4. ISSN 0016-5107.
- ^ a b Wax, A; Yang, C; Backman, V; Kalashnikov, M; Dasari, RR; Feld, MS (2002). "Determination of particle size by using the angular distribution of backscattered light as measured with low-coherence interferometry" (PDF). Journal of the Optical Society of America A. 19 (4): 737–44. Bibcode:2002JOSAA..19..737W. doi:10.1364/JOSAA.19.000737. PMID 11934166.
- ^ Wax, A; Yang, C; Backman, V; Badizadegan, K; Boone, CW; Dasari, RR; Feld, MS (2002). "Cellular organization and substructure measured using angle-resolved low-coherence interferometry". Biophysical Journal. 82 (4): 2256–64. Bibcode:2002BpJ....82.2256W. doi:10.1016/S0006-3495(02)75571-9. PMC 1302018. PMID 11916880.
- ^ Choma, M; Sarunic, M; Yang, C; Izatt, J (2003). "Sensitivity advantage of swept source and Fourier domain optical coherence tomography" (PDF). Optics Express. 11 (18): 2183–9. Bibcode:2003OExpr..11.2183C. doi:10.1364/OE.11.002183. PMID 19466106.
- ^ a b Pyhtila, John W.; Boyer, Jeffrey D.; Chalut, Kevin J.; Wax, Adam (2006). "Fourier-domain angle-resolved low coherence interferometry through an endoscopic fiber bundle for light-scattering spectroscopy". Optics Letters. 31 (6): 772–4. Bibcode:2006OptL...31..772P. doi:10.1364/OL.31.000772. PMID 16544619.
- ^ Pyhtila, John W.; Wax, Adam (2007). "Polarization effects on scatterer sizing accuracy analyzed with frequency-domain angle-resolved low-coherence interferometry". Applied Optics. 46 (10): 1735–41. Bibcode:2007ApOpt..46.1735P. doi:10.1364/AO.46.001735. PMID 17356616.




