알파-만노시스증
Alpha-mannosidosis| 알파-만노시스증 | |
|---|---|
 | |
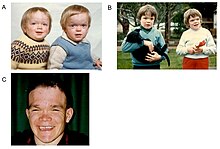
| 알파-만성증에는 자가 열성 유전 패턴이 있다. 그림 1 | |
| 전문 | 내분비학 |
알파맨노시디스는 라이소솜 저장 장애로 1967년 스웨덴 의사 오커먼이 처음 설명했다.[1][2]인간에게는 19번 염색체에 위치한 유전자 MAN2B1의 자기 열성 유전 돌연변이가 알파-D-만노시다아제 효소 생성에 영향을 미쳐 결핍을 초래하는 것으로 알려져 있다.[2][3][4]따라서 양부모가 모두 보균자인 경우 임신 때마다 양부모의 결함이 있는 유전자가 유전될 확률이 25%에 달하며, 아이는 이 질환을 앓게 된다.영향을 받지 않는 형제자매가 매개자가 될 가능성은 3분의 2이다(그림 1).[4]가축에서 알파-만노시드는 로크리드로부터 온 스와인소닌을 사용한 만성 중독에 의해 발생한다.
증상
알파만뇨증은 수십년에 걸쳐 신경근육과 골격의 악화가 나타나는 평생의 다체계적 진행성 질환이다.[2]증상이 나타나는 시기는 병의 중증도와 관련이 있다.가장 심각한 형태의 질병의 발병은 생후 1개월 이내에 발생하며 골격 이상과 지적 장애를 수반하며, 1차 중추신경계 개입이나 근병증에서 사망에 이르는 급속한 진행을 한다.[2]그러나 라이소솜 저장 장애를 가진 대부분의 신생아는 증상이 없고 심각한 영향을 받는 경우가 거의 없다.[1][5]이것은 특히 가벼운 형태의 질병이 소아나 청소년기에 점진적으로 진행되는 가벼운 지적 장애에서 중간 정도의 지적 장애만을 수반하기 때문에 진단이 지연된다.[6]
생애 첫 10년은 청각 장애, 정신 이상 지연, 재발 감염, 특히 상기도 감염, 폐 감염, 급성/중증 이염 미디어 감염의 발달로 특징지어진다.[7]이마 돌출, 비강 다리 평평하게 펴짐, 작은 코, 넓은 입, 그리고 넓은 간격의 치아와 같은 많은 얼굴 생김새에 상당한 변화가 일어날 수 있다.[2]근육에 저장재가 쌓여서 근육의 약점이나 척추 이상이 발생할 수 있다.[2]
병리학
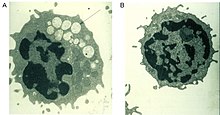
일반적으로 리소솜에서 당단백질에서 파생된 복합당분 분해에 도움을 주는 결함이 있는 알파-만노시디아제 효소는 모든 조직에서 마노스가 풍부한 올리고당류의 점진적인 리소솜 축적을 유발하여 세포기능 저하와 세포사멸을 초래한다(그림 2).[2][8]이 효소의 완전한 기능 부재는 중추신경계의 악화로 유아기에 사망에 이른다.[8]잔류 활성도가 낮은 효소는 청력 저하, 인지장애, 세균감염에 대한 민감성, 골격기형 등의 증상이 나타나면서 가벼운 질환으로 이어진다.그 병의 경과는 진행형이다.[2][8]
알파만뇨증은 질병의 중증도에 따라 발병 연령을 기준으로 3가지 제안 아형으로 분류돼 왔다.[2]
- 유형 1: 골격 이상 유무, 근육 문제(근병증), 느린 진행으로 10세 이후에 인식되는 가벼운 형태
- 유형 2: 골격 이상, 근병증, 느린 진행 등이 있는, 10세 이전에 인식된 온건한 형태.이것이 가장 흔한 형태다.
- 유형 3: 심각한 형태, 진행성 중추신경계 개입으로 조기 사망
그러나 기록된 돌연변이의 다양성과 증상의 범위와 심각성을 고려할 때, 이 병은 임상적으로 연속체로서 간주된다.[8][7]
진단
알파 만노시디스는 진행성 질환으로 인지장애, 골격 변화(예: 관절이 붓고, 척추 구부러짐), 청력 손실 및 재발 감염 환자에서 그 존재를 의심해야 한다.이 질환을 가진 아이들은 겉보기에는 정상으로 태어나는 경우가 많지만, 나이가 들수록 병세가 악화된다.알파-만성증은 독립적으로 살거나, 사회화하거나, 직장을 구하는 능력을 포함하여, 환자의 삶의 질에 많은 영향을 미칠 수 있다.[2][7]
일반적으로 알파-만성증 환자의 표현형은 명확하게 구별할 수 없어 개별 환자가 도전하는 임상 과정을 예측한다.[2]환자는 의사, 간호사 또는 건강 방문자에게 각기 다른 진행 단계에서 다른 임시 증상을 보일 수 있으며, 따라서 알파-만뇨증의 진단을 의심하는 연결 고리를 만들 수 있다.[2]주요 증상은 점막다당증과 같은 다른 라이소솜 저장 장애와도 공유될 수 있다.[2]
병의 진행적 특성을 감안할 때 정확한 진단이 빨리 이루어질수록 좋다.[2]소아과 전문의, 정형외과, 안과 의사, 이과 의사, 신경과 의사, 면역학자, 신경외과 의사, 신경외과 의사, 신경외과 의사, 물리치료사 등이 참여하는 다학제 접근법을 사용하여 진단하고 치료하는 경우가 많다.[7]
알파-만뇨증의 진단은 다증상 제시의 특성 소견, 철저한 임상 평가, 상세한 환자 이력 및 아래에 기술된 진단 테스트의 결과를 토대로 의심된다.
A. 소변 속의 올리고당
소변에서 마노스가 풍부한 올리고당 농도를 측정하기 위해 예비 조사를 실시할 수 있다.마노스가 풍부한 과두당류의 높은 소변 배설이 시사하는 바는 있지만 질병에 대한 진단은 아니다.[2]
B. 산성 알파-만노시다아제 활동
백혈구 또는 기타 핵세포의 잔류 알파-만노시다제 활성을 형광학적 측정을 통해 측정함으로써 진단이 확인된다.[2]이것은 유전자 검사와 함께 가장 믿을 수 있는 진단법이다.
C. 유전자 검사
질병을 유발하는 돌연변이의 식별은 말초혈구 세포의 DNA를 사용하여, 24개의 MAN2B1 엑손 모두를 중합효소 연쇄반응(PCR) 증폭시킨 다음, DNA 염기서열 분석을 통해 달성된다.[2]
치료
선천성 알파-만성증에는 치료법이 없으며, 일반적으로 새로운 합병증을 예방하기 위한 목적으로 경영에 대한 접근은 사전 예방적이다.완전한 신체검사 후, 의사들은 수두증, 이염, 청력 상실, 치아 카리에, 관절 증상, 척추콜리증, 정신 상태와 같은 알려진 알파-만성증의 합병증에 초점을 맞춰야 한다.[2]예를 들어 발작을 조절하는 약, 청력 상실을 개선하기 위한 보청기, 근육통 및 허약에 도움을 주는 일상적인 물리치료 등으로 치료는 증세를 줄이거나 조절하는 데 국한되는 경우가 많다.[2]어떤 경우에는 근육이나 척추 장애가 영향을 받은 개인을 움직이지 못하게 하는 경우에 휠체어가 적합할 수 있다.
조혈모세포이식(HSCT)은 일부 환자에게 치료 옵션이 될 수 있지만, 위험-효익 프로파일이 젊은 환자들에게 더 유리하므로 조기 진단이 실행 가능한 옵션이 되려면 매우 중요하다.[2]그 근거는 효소를 생성하는 기증자 세포가 숙주 조직을 재복제하고 효소를 인근 효소 결핍 숙주세포로 옮겨간다는 것이다.[2]반대로 초기 보고에도 불구하고 HSCT의 가능한 편익은 질병과 사망률과 관련된 절차의 전반적인 위험과 비교되어야 한다.[9][10][2]합병증이 발생하기 전 젊은 환자일수록 편익이 크고, 이식 관련 합병증도 고령 환자일수록 빈번하고 심각하다.
효소대체요법(ERT)은 다수의 라이소솜 저장 질병의 치료 대안이다.[2][7]ERT의 전반적인 원리는 부족한 효소의 재조합된 버전이 혈류로 유입되어 세포에 의해 내장이 되고 만노세-6인산 수용체 매개 흡수에 의해 리소솜에 도달하여 누락된 내생 효소를 대체하는 것이다.[7]ERT는 유럽 연합에서 사용하도록 승인되었다.[11]
예후
그 상태에 대한 장기적 전망은 좋지 않다.[2]일반적으로 신경근과 뼈의 변화는 수십 년에 걸쳐 서서히 진행되고 있다.행동상의 문제 또는 정신 질환도 있을 수 있다.[2][7]알파-만성증에서의 기대수명은 매우 다양하다.초기에 심각한 질병을 가진 사람들은 종종 유년기를 넘어서 살아남지 못하는 반면, 가벼운 장애를 가진 사람들은 성인의 삶에서 잘 살아남을 수 있다.
자립생활은 어려워질 것이고 알파만노시스증 환자는 사회적으로 고립될 수 있으며, 질병 후기 중에는 더 이상 도움 없이 걸을 수 없어 휠체어 구속이 될 수도 있다.[2]이는 간병인과 가족의 삶의 질에 부정적인 영향을 미칠 가능성이 높다.[2][7]
역학
전세계적으로 알파-만능증의 발병률은 정확히 알려져 있지 않다.하지만, 다른 나라들로부터 온 많은 보고들은 그것이 전세계에서 태어난 백만 명 중 한 명꼴로 발생한다고 추정한다.[8]만노시데스는 유럽, 미국, 아프리카, 아시아의 모든 인종 집단에서 발견된다.[2]
참조
- ^ a b Roces DP, Lüllmann-Rauch R, Peng J, et al. (2004). "Efficacy of enzyme replacement therapy in alpha-mannosidosis mice: a preclinical animal study". Hum. Mol. Genet. 13 (18): 1979–88. doi:10.1093/hmg/ddh220. PMID 15269179.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab Malm D, Nilssen O(2008)."알파-만노시스"Opiaet J Large Diss. 3 (1): 21. doi:10.11886/1750-1172-3-21. PMC 2515294. PMID 18651971.
- ^ Gotoda Y, Wakamatsu N, Kawai H, Nishida Y, Matsumoto T (October 1998). "Missense and nonsense mutations in the lysosomal alpha-mannosidase gene (MANB) in severe and mild forms of alpha-mannosidosis". American Journal of Human Genetics. 63 (4): 1015–24. doi:10.1086/302048. PMC 1377481. PMID 9758606.
- ^ a b 알파-만노시스 돌연변이 데이터베이스.트롬쇠 대학교.https://apex.jupiter.no/apex/f?p=101:1에서 이용 가능.
- ^ 알파 만노시데스증.국립 희귀병 기구(NORD) 팩트시트 2015.https://rarediseases.org/rare-diseases/alpha-mannosidosis/
- ^ 남성다움을 이해하도록 안내한다.무코폴리사당질병학회.http://www.mpssociety.org.uk/wp-content/uploads/2016/07/guide-alphamannosidosis-2013.pdf
- ^ a b c d e f g h 보그워트 L, 룬드 AM, 달리 CI(2014년)알파-만노시스 – 유전자, 임상 결과 및 치료 옵션의 검토.소아과.엔도크리놀.12차 개정판 1:185-91.
- ^ a b c d e Beck M Olsen KJ, Writh JE et al.알파-만노시도의 자연사: 종적 연구.2013년 8시 88분, 디아페트 J 레어 디스.
- ^ 윌 에이 외 (1987)"Alpha-mannosidosis 치료에 골수이식"유년기의 질병. 62(10): 1044–1049. doi:10.1136/adc.62.10.1044.
- ^ 그루갈 SS, 샤피로 EG, 크리빗 W 등.(2004).동종유전자 조혈모세포이식에 의한 알파만뇨증의 효과적인 치료.J 소아과, 144:569-573
- ^ http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/003922/human_med_002231.jsp&mid=WC0b01ac058001d124
추가 읽기
- GeneReviews/NCBI/NIH/UW 입력(알파-만노시드증)
- 알파-만노시도에 대한 OMIM 항목
- NIH 희귀병 사무소의 알파-만노시데스증 타입 1형
- NIH 희귀병 사무소의 알파-만노시데스증 타입 2