3D 세포배양
3D cell culture3D 세포 배양은 생물 세포가 3차원 모두에서 성장하거나 주변과 상호 작용할 수 있도록 인위적으로 만들어진 환경입니다. 2D 환경(예: Petri dish)과 달리, 3D 세포 배양은 생체 내에서 세포가 성장하는 것과 유사하게 모든 방향으로 성장하도록 합니다.[1] 이러한 3차원 배양은 일반적으로 세포가 스페로이드 또는 3D 세포 집락으로 성장할 수 있는 작은 캡슐인 생물 반응기에서 성장합니다. 보통 생물 반응기당 약 300개의 스페로이드가 배양됩니다.[1]
배경
3D 세포 배양은 수십 년 동안 연구에 사용되었습니다.[2] 그들의 개발을 위한 최초의 기록된 접근법 중 하나는 20세기 초에 Alexis Carrel의 노력으로 장기간의 시험관내 조직 배양을 위한 방법을 개발했습니다.[3] 로렌스 버클리 국립 연구소의 미나 비셀(Mina Bisell)이 이끄는 80년대 초기 연구에서는 정확한 체외 배양 모델을 만들기 위한 3D 기술의 중요성을 강조했습니다. 이 연구는 세포외 기질의 중요성과 건강하고 암성인 유방 조직 모델의 시나르 구조와 같은 생리학적으로 관련된 다세포 구조를 생산하기 위한 인공 3D 매트릭스의 배양 능력에 초점을 맞추었습니다. 이러한 기술은 제약 화합물에 대한 세포 반응을 평가하는 데 사용되는 시험관 내 질병 모델에 적용되었습니다.[4]
에릭 사이먼(Eric Simon)은 1988년 NIH SBIR 보조금 보고서에서 전기방사를 사용하여 나노 및 서브미크론 규모의 폴리스티렌 및 폴리카보네이트 섬유 매트(현재 스캐폴드로 알려져 있음)를 시험관 내 세포 기질로 사용할 수 있음을 보여주었습니다. 세포 배양 및 조직 공학을 위한 전기방사 섬유 격자의 이러한 초기 사용은 인간 포피 섬유아세포(HFF), 형질전환 인간 암종(HEP-2) 및 밍크 폐 상피(MLE)를 포함한 다양한 세포 유형이 섬유에 부착되고 증식한다는 것을 보여주었습니다. 일반적으로 2D 배양에서 볼 수 있는 평평한 형태와 대조적으로, 전기 방사 섬유에서 성장한 세포는 생체 내에서 일반적으로 관찰되는 더 조직형 둥근 3차원 형태를 나타냄에 주목했습니다.[5]
특성.
살아있는 조직에서 세포는 복잡한 세포-세포 및 세포-기질 상호작용과 영양소 및 세포에 대한 복잡한 수송 역학을 가진 3D 미세 환경에 존재합니다.[6][7][8][9][10][11][12][13][14] 표준 2D, 즉 단층 세포 배양은 이러한 환경을 제대로 표현하지 못하기 때문에 생체 내 약물 효능과 독성에 대한 신뢰할 수 없는 예측 변수가 되기도 합니다.[15][12] 3D 스페로이드는 세포 내 조직과 세포 통신 및 세포 외 기질 발달 측면에서 더 유사합니다.[1] 이러한 매트릭스는 세포가 살아있는 조직에서 이동하는 방식과 유사하게 구형 내에서 이동할 수 있도록 도와줍니다.[8] 따라서 스페로이드는 세포 이동, 분화, 생존 및 성장에 대한 개선된 모델입니다.[13] 또한 3D 세포 배양은 2D에서 세포가 부분적으로만 편광될 수 있기 때문에 세포 편광을 보다 정확하게 묘사합니다.[8] 게다가 3D로 성장한 세포는 2D로 성장한 세포와 다른 유전자 발현을 보입니다.[8]
세포 성장의 세 번째 차원은 기계적 입력과 세포 부착을 위한 더 많은 접촉 공간을 제공하며, 이는 통합, 세포 수축 및 심지어 세포 내 신호 전달에 필요합니다.[16][17] 정상적인 용질 확산 및 이펙터 단백질(성장 인자 및 효소)에 대한 결합도 3D 세포 매트릭스에 의존하므로 조직 스케일 용질 농도 구배의[18][19] 확립에 중요합니다.
약물 독성학 스크리닝의 목적을 위해서는 3D 스페로이드의 유전자 발현이 생체 내 유전자 발현과 더 유사할 것이기 때문에 2D보다 3D에서 성장한 시험관 내 세포의 유전자 발현을 테스트하는 것이 훨씬 더 유용합니다. 마지막으로, 3D 세포 배양은 2D 세포 배양보다 더 큰 안정성과 더 긴 수명을 가지고 있습니다.[20] 이것은 장기적인 연구와 약물의 장기적인 효과를 입증하는 데 더 적합하다는 것을 의미합니다. 3D 환경은 또한 세포가 방해받지 않고 자랄 수 있도록 합니다. 2D에서 세포들은 정상적인 세포 성장을 위해 충분한 영양분을 제공하기 위해 정기적인 트립신 처리를 거쳐야 합니다.[21] 3D 스페로이드는 여전히 건강하고 암이 없는 성장을 유지하면서 최대 302일 동안 실험실 환경에서 배양되었습니다.[20]
생물학과 항공 우주의 학제 간 연구에서, 3D 인쇄된 스캐폴드는 발사 중 중력의 영향으로부터 세포를 보호하는 데에도 사용되고 있습니다.[22]
3차원 배양방법의 분류
3D 세포 배양의 장점을 제공한다고 주장하는 많은 상업적으로 이용 가능한 배양 도구가 있습니다. 일반적으로 플랫폼은 두 가지 유형의 3D 배양 방법으로 분류할 수 있습니다: 스캐폴드 기법과 스캐폴드 프리 기법.
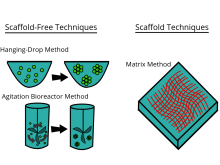
비계기법
스캐폴드 기술에는 고체 스캐폴드, 하이드로겔 및 기타 재료 사용이 포함됩니다. 최근 인간 CD34+ 줄기세포에 대한 연구에서 골 골 골화 과정을 이해하기 위해 in vitro agarose gel 3D 모델을 생성하여 탐색했습니다.[23] 스캐폴드는 종양 기질 상호작용을 모방하여 종양 세포 외부에서 섬유아세포를 배양하여 미세조직 3D 모델을 생성하는 데 사용될 수 있습니다.[24]
특히 조직 공학에서 다양한 응용 분야에서 스캐폴드의 효율성은 기공 분포, 노출된 표면적 및 공극률과 같은 요인에 의해 크게 영향을 받습니다. 이러한 요소의 양과 배열은 세포가 스캐폴드 부피에 침투하는 깊이와 속도, 생성된 세포외 기질의 구조, 그리고 궁극적으로 재생 과정의 성공에 모두 영향을 미칩니다.[25] 스캐폴드는 제조 방법에 따라 다양한 구조로 제작할 수 있어 무작위 또는 정밀하게 설계된 기공 분포로 이어집니다.[26] 최근에는 컴퓨터로 제어되는 신속한 프로토타이핑 기술을 이용하여 기하학적 구조가 잘 정리된 스캐폴드를 제작하고 있습니다.[27]
하이드로겔
천연 세포외 기질(ECM)이 세포의 생존, 증식, 분화 및 이동에 중요하기 때문에 천연 ECM 구조를 모방하는 다양한 하이드로겔 매트릭스가 생체 내 세포 배양과 같은 잠재적인 접근법으로 간주됩니다.[28][29][30] 하이드로겔은 수분 보유율이 높은 상호 연결된 기공으로 구성되어 있어 영양소와 가스를 효율적으로 운반할 수 있습니다. 동물 ECM 추출물 하이드로겔, 단백질 하이드로겔, 펩티드 하이드로겔, 고분자 하이드로겔 및 목재 기반 나노셀룰로오스 하이드로겔과 같은 천연 및 합성 물질의 여러 가지 유형의 하이드로겔이 3D 세포 배양에 사용 가능합니다.
스캐폴드 프리 기법
스캐폴드 프리 기법은 사용 스캐폴드와 독립적인 또 다른 접근 방식을 사용합니다. 스캐폴드가 없는 방법에는 부착력이 낮은 플레이트 사용, 낙하 플레이트 매달기, 미세 패턴 표면, 회전하는 생물반응기 사용, 자기 부상 및 자기 3D 바이오 프린팅이 포함됩니다.
스페로이드

스페로이드는 2차원 세포 모델에 비해 살아있는 세포의 환경 조건을 더 잘 모사하는 3차원 세포 모델링의 한 유형으로, 특히 세포 간의 반응과 세포와 기질 간의 반응을 더 잘 모사합니다.[32] 스페로이드는 세포의 생리적 특성 변화,[33] 건강한 세포와 종양 세포의 구조 차이, 종양을 형성할 때 세포가 겪는 변화 등을 연구하는 데 유용합니다.[34] 종양 및 건강한 세포와 공동 배양된 스페로이드를 사용하여 암세포가 정상 세포와 어떻게 상호 작용하는지 시뮬레이션했습니다.[35] 스페로이드는 또한 종양-기질 상호작용을 모방하기 위해 섬유아세포와 공동 배양될 수 있습니다.[36] 스페로이드는 몇 가지 다른 방법으로 재배할 수 있습니다. 하나의 일반적인 방법은 낮은 세포 부착 플레이트(일반적으로 96 웰 플레이트)를 사용하여 세포 플레이트의 둥근 바닥에 응집체가 형성되는 스페로이드 배양체를 대량 생산하는 것입니다.[31][37] 스페로이드는 세포판 표면에 매달린 방울에 세포 응집체를 형성하는 매달린 방울 방법을[38] 사용하여 배양할 수도 있습니다.[32] 조사 중인 다른 방법에는 회전하는 벽 용기 생물 반응기를 사용하는 것이 포함됩니다. 세포가 지속적으로 자유 낙하할 때 회전하고 배양하여 층으로[39] 응집체를 형성합니다. 최근에는 균일하고 신뢰할 수 있는 스페로이드를 생산하기 위해 일부 프로토콜이 표준화되었습니다.[40] 연구원들은 또한 3D 세포 배양을 위한 표준화되고 경제적이며 재현 가능한 방법을 탐구했습니다.[41] 회전 타원체 실험에서 재현성과 투명성을 향상시키기 위해 국제 컨소시엄은 MISpheroID(회전 타원체 ID의 최소 정보)를 개발했습니다.[42]
클러스테로이드
클러스터로이드는 스페로이드와 유사한 3차원 세포 모델링의 한 종류이지만 생성 방법에 의해 구별됩니다; 계면 장력과 삼투 수축을 사용하여 수중 피커링 에멀젼의 수성 2상 시스템에서 세포 클러스터로 성장하여 세포를 조밀한 클러스터로 포장한 다음 하이드로겔에서 배양됩니다. 조직이나 오가노이드로.[43][44]
혈관이 없는 경우 괴사 핵 형성 동안 산소 투과성이 손상되어 3D 세포 배양의 생체 외 사용을 방해합니다. 이 문제를 극복할 수 있는 에멀젼 템플릿이 있습니다. 이 접근법을 통해 연구자들은 공동 배양된 클러스테로이드 내에서 다양한 혈관신생 단백질 마커의 합성을 촉진하기 위한 이상적인 조건을 달성하기 위해 세포 구성을 조정할 수 있었습니다.[45] HUVEC 세포는 혈관 내피 성장 인자(VEGF) 또는 혈관 신생을 유도하는 다른 제제의 외부 도입 없이 Matrigel에서 내피 세포 새싹을 생성함으로써 Hep-G2 세포 및 그 유도체의 존재에 대한 반응을 나타냅니다.[46][47] 이 배양 기술의 복제는 다양한 세포 공동 배양 스페로이드를 생성하기에 간단합니다.[48] 피커링 에멀젼 템플릿은 3D 공동 배양 모델을 구성하는 데 크게 도움이 되어 약물 테스트 및 조직 공학에 적용할 수 있는 상당한 잠재력을 제공합니다.[49]
생물반응기
3D 세포 배양에 사용되는 생물 반응기는 세포를 3차원으로 성장시키기 위해 특별히 설계된 작은 플라스틱 원통형 챔버입니다. 생물 반응기는 폴리에틸렌 테레프탈레이트 막과 같은 생체 활성 합성 물질을 사용하여 높은 수준의 영양소를 유지하는 환경에서 회전 타원체 세포를 둘러싸고 있습니다.[50][51] 열고 닫을 수 있어 세포 스페로이드를 테스트를 위해 제거할 수 있지만 챔버는 내내 100% 습도를 유지할 수 있습니다.[1] 이 습도는 최대 세포 성장과 기능을 달성하는 데 중요합니다. 생물 반응기 챔버는 3차원에 걸쳐 각 방향에서 균등한 세포 성장을 보장하도록 회전하는 더 큰 장치의 일부입니다.[1]
MC2 바이오텍은 세포실 내에서 높은 산소 수준을 유지하기 위해 가스 교환을 사용하는 원시 조직을 배양하기 위한 생물 반응기를 개발했습니다.[52] 이것은 산소 수준이 높을수록 세포가 성장하고 정상적인 세포 호흡을 할 수 있기 때문에 이전의 생물 반응기보다 개선된 것입니다.[13]
미세유체학
인체의 다양한 세포 구조를 혈관으로 만들어 영양분과 가스 교환을 공급받아야 생존할 수 있습니다. 유사하게, 시험관 내 3D 세포 배양은 특정 수준의 유체 순환을 필요로 하며, 이는 세포가 모두 영양소에 적절하게 노출되지 않을 수 있는 조밀한 3D 배양에서 문제가 될 수 있습니다. 간은 고도로 혈관화된 기관이기 때문에 간세포 배양에서 특히 중요합니다. 한 연구에서는 미세유체 채널 사이의 콜라겐 겔 스캐폴드에서 간세포와 혈관세포를 함께 배양하고 정적인 환경과 유동적인 환경에서 세포의 성장을 비교한 결과 조직과 미세혈관 네트워크가 있는 모델의 필요성을 보여줬습니다.[53] 또 다른 연구는 매달린 방울 기반 회전 타원체 공동 배양 장치가 유용할 수 있다는 것을 보여주었고, 미세유체 매달린 방울 장치의 인접 채널에서 두 개의 서로 다른 세포 회전 타원체를 생성하고, 병합된 방울과 회전 타원체를 공동 배양하여 종양 유발 혈관신생을 모니터링할 수 있다는 것을 보여주었습니다.[54]
고처리량 스크리닝
고밀도 포맷에서 고처리량 스크리닝을 위한 3D 모델의 고도화된 개발은 최근 마이크로플레이트 밀도 증가와 관련된 기술적 성과로 인해 가능합니다. 이들은 세포 기피성, 비용 효율적이며 완전 자동화된 스크리닝 플랫폼에 적합한 384 및 1536웰 형식에서 찾을 수 있습니다.[55] 1536웰 포맷을 제공하는 두 [57][58]가지 옵션은 M3D 마그네틱 3D 바이오[56] 프린팅과 초저 부착 표면 코팅을 포함하는 Corning Life Sciences를 사용하여 3D 모델을 만들 수 있습니다. 3D 스크리닝을 위해 개발된 신속하고 저렴한 방법과 기술로 인해 야생형에 비해 종양 유전자 관련 돌연변이의 동종 쌍을 테스트하기 위한 병렬 고처리량 스크리닝 접근법이 가능해졌습니다.[59]
약리학과 독성학
시험관 내에서 3D 스캐폴드 및 3D 세포 스페로이드로 세포를 성장시키는 주요 목적은 전임상 시험에서 약물 및 나노 물질의 약동학 및 약력학적 효과를 테스트하는 것입니다.[13][60][61][62][63] 독성학 연구에 따르면 3D 세포 배양은 약물 화합물의 독성을 테스트하기 위한 생체 내 연구와 거의 유사한 것으로 나타났습니다. 아세트아미노펜, 아미오다론, 디클로페낙, 메트포르민, 펜포르민, 발프로산의 6가지 일반적인 약물에 대한 LD50 값을 비교했을 때, 3D 스페로이드 값은 생체 내 연구의 값과 직접적인 상관관계가 있었습니다.[64] 2D 세포 배양은 이전에 생체 내 연구와 함께 독성을 테스트하는 데 사용되었지만 3D 스페로이드는 수명이 더 길기 때문에 만성 노출 독성 테스트에 더 적합합니다.[65] 3D Spheroids의 매트릭스는 세포가 액틴 필라멘트를 유지하도록 하며 인간 세포의 세포골격 조직과 세포 극성 및 모양에 생리학적으로 더 관련이 있습니다.[66] 3차원 배열을 통해 배양체는 동물 실험 대상을 사용하지 않고 생체 내에서 인체 조직과 더 정확하게 유사한 모델을 제공할 수 있습니다.[67]
안전성과 효능을 평가하는 동안 이러한 모델은 다양한 질병 상태를 모델링할 수 있도록 잘 갖춰져 있습니다. 이러한 모델은 각각 모델 개발과 데이터 해석이 필요한 장점과 한계가 있습니다. 이 분야의 연구를 발전시키고 활성화하기 위해서는 민관 파트너십이 중요합니다.
비평
확장성, 재현성, 감도, HTS(High Throughput Screening) 기기와의 호환성 등 기존의 3D 방식에도 한계가 없는 것은 아닙니다. 세포 기반 HTS는 용량 의존적 세포 생존율, 세포-세포/기질 상호작용 및/또는 세포 이동과 같은 약물 상호작용에 대한 세포 반응의 신속한 결정에 의존하지만, 사용 가능한 분석은 3D 세포 배양에 최적화되지 않습니다. 3D 세포 배양이 직면한 또 다른 과제는 이러한 3D 환경에서 약물 상호 작용, 세포 분화 및 세포 신호 전달의 메커니즘 및 상관 관계를 다루는 제한된 양의 데이터 및 출판물입니다. 약물 개발 과정을 포함하여 대규모로 2D 배양을 대체하는 3D 방법은 아직 없습니다. 3D 세포 배양 출판물의 수가 빠르게 증가하고 있지만, 현재 3D 조직의 제한된 생화학적 특성은 새로운 방법의 채택을 감소시킵니다.
스페로이드를 암 조직의 모델로 사용하는 문제도 있습니다. 비록 3D 조직 배양에 유익하지만, 종양 스페로이드는 Ratmir 등이 탐구한 조직 기반 생물학적 검정을 위한 종이 지원 3D 세포 배양과 달리 "[3D 스페로이드] 구조에서 가용성 분자의 구배를 조작하고 이러한 복잡한 구배에서 세포를 특성화하는 것"이 어렵거나 불가능하다는 비판을 받아 왔습니다.[51] 복잡한 3D 세포 배양 기술과 관련된 추가 과제는 큰 스캐폴드 크기와 많은 형광 현미경과의 비호환성으로 인한 이미징, 스페로이드를 단일 세포 현탁액으로 해리해야 하기 때문에 유세포 분석 및 액체 취급의 자동화를 포함합니다.[69]
2D 모델은 셀-셀 및 셀-매트릭스 상호작용을 연구할 수 없습니다. 2D 배양과 관련된 전임상 모델이 부족하기 때문에 3D 배양은 병태생리적 미세 환경을 제공하고 암 약물 발견에 역할을 할 가능성이 있습니다.[70][71][72][73][74][75][76][77]
조직 공학에는 3D 세포 스캐폴드가 필요합니다. 생체 재료로 다양한 천연 및 합성 고분자 하이드로겔이 과학자들에 의해 3D 스캐폴드 설계에 사용되어 왔습니다. 이 장벽은 자연적인 ECM 미세 환경을 모방한 구조이기 때문에 합성 스캐폴드는 특정 종양 발생 단계를 연구하는 데 더 유용할 수 있습니다.[78] 마지막으로, 구체적인 대상에 따라 가장 적합한 입체 모형을 신중하게 선택해야 한다고 제안합니다.[77]
참고 항목
참고문헌
- ^ a b c d e Fey S, Wrzesinski K (2013). "Determination of Acute Lethal and Chronic Lethal Thresholds of Valproic Acid Using 3D Spheroids Constructed From the Immortal Human Hepatocyte Cell Line HEPG2/C3A" (PDF). In Boucher A (ed.). Valproic Acid. Nova Science Publishers, Inc. pp. 141–165. ISBN 978-1-62417-952-5. Archived from the original (PDF) on 2 December 2013.
- ^ Mapanao AK, Voliani V (June 2020). "Three-dimensional tumor models: Promoting breakthroughs in nanotheranostics translational research". Applied Materials Today. 19: 100552. doi:10.1016/j.apmt.2019.100552. S2CID 213634060.
- ^ Carrel A (May 1912). "On the Permannet Life of Tissues Outside of the Organisms". The Journal of Experimental Medicine. 15 (5): 516–28. doi:10.1084/jem.15.5.516. PMC 2124948. PMID 19867545.
- ^ 공로상 수상자: 미나 J. 비셀 박사(N.D.). 2016년 6월 16일 http://www.cancer.gov/research/nci-role/spotlight/merit/Bissell 에서 검색, 2020년 9월 17일 Wayback Machine에서 아카이브됨
- ^ Simon, Eric M. (1988). "NIH Phase I Final Report: Fibrous Substrates for Cell Culture (R3RR03544A) (PDF Download Available)". ResearchGate. Retrieved 22 May 2017.
- ^ Marx, Vivien (11 April 2013). "A Better Brew" (PDF). Nature. Retrieved 9 July 2013.
- ^ Souza GR, Molina JR, Raphael RM, Ozawa MG, Stark DJ, Levin CS, et al. (April 2010). "Three-dimensional tissue culture based on magnetic cell levitation". Nature Nanotechnology. 5 (4): 291–6. Bibcode:2010NatNa...5..291S. doi:10.1038/nnano.2010.23. PMC 4487889. PMID 20228788.
- ^ a b c d Pampaloni F, Reynaud EG, Stelzer EH (October 2007). "The third dimension bridges the gap between cell culture and live tissue". Nature Reviews Molecular Cell Biology. 8 (10): 839–45. doi:10.1038/nrm2236. PMID 17684528. S2CID 23837249.
- ^ Chun TH, Hotary KB, Sabeh F, Saltiel AR, Allen ED, Weiss SJ (May 2006). "A pericellular collagenase directs the 3-dimensional development of white adipose tissue". Cell. 125 (3): 577–91. doi:10.1016/j.cell.2006.02.050. PMID 16678100. S2CID 15822397.
- ^ Yamada KM, Cukierman E (August 2007). "Modeling tissue morphogenesis and cancer in 3D". Cell. 130 (4): 601–10. doi:10.1016/j.cell.2007.08.006. PMID 17719539. S2CID 9233152.
- ^ Friedrich J, Seidel C, Ebner R, Kunz-Schughart LA (12 February 2009). "Spheroid-based drug screen: considerations and practical approach". Nature Protocols. 4 (3): 309–24. doi:10.1038/nprot.2008.226. PMID 19214182. S2CID 21783074.
- ^ a b Prestwich GD (August 2007). "Simplifying the extracellular matrix for 3-D cell culture and tissue engineering: a pragmatic approach". Journal of Cellular Biochemistry. 101 (6): 1370–83. doi:10.1002/jcb.21386. PMID 17492655. S2CID 45152239.
- ^ a b c d Griffith LG, Swartz MA (March 2006). "Capturing complex 3D tissue physiology in vitro". Nature Reviews Molecular Cell Biology. 7 (3): 211–24. doi:10.1038/nrm1858. PMID 16496023. S2CID 34783641.
- ^ Lee J, Cuddihy MJ, Kotov NA (March 2008). "Three-dimensional cell culture matrices: state of the art" (PDF). Tissue Engineering. Part B, Reviews. 14 (1): 61–86. doi:10.1089/teb.2007.0150. hdl:2027.42/63369. PMID 18454635.
- ^ Haycock JW (2011). "3D Cell Culture: A Review of Current Approaches and Techniques". 3D Cell Culture. Methods in Molecular Biology. Vol. 695. pp. 1–15. doi:10.1007/978-1-60761-984-0_1. ISBN 978-1-60761-983-3. PMID 21042962.
- ^ Suuronen EJ, Sheardown H, Newman KD, McLaughlin CR, Griffith M (2005). "Building in vitro models of organs". A Survey of Cell Biology. International Review of Cytology. Vol. 244. pp. 137–73. doi:10.1016/s0074-7696(05)44004-8. ISBN 9780123646484. PMID 16157180.
- ^ Louekari K (October 2004). "Status and prospects of in vitro tests in risk assessment". Alternatives to Laboratory Animals. 32 (4): 431–5. doi:10.1177/026119290403200416. PMID 15651929. S2CID 25708371.
- ^ Knight B, Laukaitis C, Akhtar N, Hotchin NA, Edlund M, Horwitz AR (May 2000). "Visualizing muscle cell migration in situ". Current Biology. 10 (10): 576–85. doi:10.1016/s0960-9822(00)00486-3. PMID 10837222. S2CID 5830501.
- ^ Roskelley CD, Desprez PY, Bissell MJ (December 1994). "Extracellular matrix-dependent tissue-specific gene expression in mammary epithelial cells requires both physical and biochemical signal transduction". Proceedings of the National Academy of Sciences of the United States of America. 91 (26): 12378–82. Bibcode:1994PNAS...9112378R. doi:10.1073/pnas.91.26.12378. PMC 45441. PMID 7528920.
- ^ a b Wrzesinski K, Magnone MC, Hansen LV, Kruse ME, Bergauer T, Bobadilla M, Gubler M, Mizrahi J, Zhang K, Andreasen CM, Joensen KE (2013). "HepG2/C3A spheroids exhibit stable physiological functionality for at least 24 days after recovering from trypsinisation". Toxicol. Res. 2 (3): 163–172. doi:10.1039/C3TX20086H.
- ^ "After trypsinisation, 3D spheroids of C3A hepatocytes need 18 days to re-establish similar levels of key physiological functions to those seen in the liver" (PDF). Archived from the original (PDF) on 2 April 2015. Retrieved 25 November 2013.
- ^ Han, Y; Zeger, L; Tripathi, R; Egli, M; Ille, F; Lockowandt, C; Florin, G; Atic, E; Redwan, IN; Fredriksson, R; Kozlova, EN (October 2021). "Molecular genetic analysis of neural stem cells after space flight and simulated microgravity on earth". Biotechnology and Bioengineering. 118 (10): 3832–3846. doi:10.1002/bit.27858. PMID 34125436. S2CID 235425528.
- ^ Srikanth L, Sunitha MM, Kumar PS, Chandrasekhar C, Vengamma B, Sarma PV (November 2016). "+ stem cells". Molecular Biology Reports. 43 (11): 1233–1242. doi:10.1007/s11033-016-4053-4. PMID 27497820. S2CID 13230517.
- ^ Pednekar, Kunal P.; Heinrich, Marcel A.; van Baarlen, Joop; Prakash, Jai (6 October 2021). "Novel 3D µtissues Mimicking the Fibrotic Stroma in Pancreatic Cancer to Study Cellular Interactions and Stroma-Modulating Therapeutics". Cancers. 13 (19): 5006. doi:10.3390/cancers13195006. ISSN 2072-6694. PMC 8508009. PMID 34638490.
- ^ Wang H, van Bliterswijk CA. 지방 기질 세포에 의한 결합 조직 형성의 균일성에 대한 3차원 고분자 스캐폴드 구성의 역할 생체 재료. 2010년 5월;31(15):4322-9.doi:10.1016/j.biomaterials.2010.02.008. Epub 2010년 3월 2일 PMID: 20199809
- ^ Melchels FP, Barradas AM, van Bliterswijk CA, de Boer J, Feijen J, Grijpma DW. 조직 공학 스캐폴드의 구조가 세포 파종 및 배양에 미치는 영향 Acta Biomater. 2010 Nov;6(11):4208-17. doi: 10.1016/j.actbio.2010.06.012. Epub 2010년 6월 16일 PMID: 20561602
- ^ 칼레티 E, 모타 A, 밀리아레지 C. 조직 공학 및 3D 세포 배양을 위한 스캐폴드. Methods Mol Biol. 2011;695:17-39. doi: 10.1007/978-1-60761-984-0_2. PMID: 21042963.
- ^ Sadat-Shojai M (2018). "Controlled pattern of cell growth in modulated protein nanocomplexes: Regulating cells spreading in three dimensions". Materials Today. 21 (6): 686–688. doi:10.1016/j.mattod.2018.06.003. S2CID 139837561.
- ^ Tibbitt MW, Anseth KS (July 2009). "Hydrogels as extracellular matrix mimics for 3D cell culture". Biotechnology and Bioengineering. 103 (4): 655–63. doi:10.1002/bit.22361. PMC 2997742. PMID 19472329.
- ^ Geckil H, Xu F, Zhang X, Moon S, Demirci U (April 2010). "Engineering hydrogels as extracellular matrix mimics". Nanomedicine. London, England. 5 (3): 469–84. doi:10.2217/nnm.10.12. PMC 2892416. PMID 20394538.
- ^ a b Xiang X, Phung Y, Feng M, Nagashima K, Zhang J, Broaddus VC, et al. (January 2011). "The development and characterization of a human mesothelioma in vitro 3D model to investigate immunotoxin therapy". PLOS ONE. 6 (1): e14640. Bibcode:2011PLoSO...614640X. doi:10.1371/journal.pone.0014640. PMC 3031536. PMID 21305058.
- ^ a b Fennema E, Rivron N, Rouwkema J, van Blitterswijk C, de Boer J (February 2013). "Spheroid culture as a tool for creating 3D complex tissues" (PDF). Trends in Biotechnology. 31 (2): 108–15. doi:10.1016/j.tibtech.2012.12.003. PMID 23336996.
- ^ Jiang Y, Pjesivac-Grbovic J, Cantrell C, Freyer JP (December 2005). "A multiscale model for avascular tumor growth". Biophysical Journal. 89 (6): 3884–94. Bibcode:2005BpJ....89.3884J. doi:10.1529/biophysj.105.060640. PMC 1366955. PMID 16199495.
- ^ Guttilla IK, Phoenix KN, Hong X, Tirnauer JS, Claffey KP, White BA (February 2012). "Prolonged mammosphere culture of MCF-7 cells induces an EMT and repression of the estrogen receptor by microRNAs". Breast Cancer Research and Treatment. 132 (1): 75–85. doi:10.1007/s10549-011-1534-y. PMID 21553120. S2CID 6930899.
- ^ Kunz-Schughart LA, Heyder P, Schroeder J, Knuechel R (May 2001). "A heterologous 3-D coculture model of breast tumor cells and fibroblasts to study tumor-associated fibroblast differentiation". Experimental Cell Research. 266 (1): 74–86. doi:10.1006/excr.2001.5210. PMID 11339826.
- ^ Priwitaningrum, Dwi L.; Blondé, Jean-Baptiste G.; Sridhar, Adithya; van Baarlen, Joop; Hennink, Wim E.; Storm, Gert; Le Gac, Séverine; Prakash, Jai (December 2016). "Tumor stroma-containing 3D spheroid arrays: A tool to study nanoparticle penetration". Journal of Controlled Release. 244 (Pt B): 257–268. doi:10.1016/j.jconrel.2016.09.004. PMID 27616660.
- ^ Phung YT, Barbone D, Broaddus VC, Ho M (2011). "Rapid generation of in vitro multicellular spheroids for the study of monoclonal antibody therapy". Journal of Cancer. 2: 507–14. doi:10.7150/jca.2.507. PMC 3204399. PMID 22043235.
- ^ Tung YC, Hsiao AY, Allen SG, Torisawa YS, Ho M, Takayama S (February 2011). "High-throughput 3D spheroid culture and drug testing using a 384 hanging drop array". The Analyst. 136 (3): 473–8. Bibcode:2011Ana...136..473T. doi:10.1039/c0an00609b. PMC 7454010. PMID 20967331.
- ^ Xu X, Farach-Carson MC, Jia X (November 2014). "Three-dimensional in vitro tumor models for cancer research and drug evaluation". Biotechnology Advances. 32 (7): 1256–1268. doi:10.1016/j.biotechadv.2014.07.009. PMC 4171250. PMID 25116894.
- ^ Santi, Melissa; Mapanao, Ana Katrina; Cappello, Valentina; Voliani, Valerio (1 July 2020). "Production of 3D tumor models of head and neck squamous cell carcinomas for nanotheranostics assessment". ACS Biomaterials Science & Engineering. 6 (9): 4862–4869. doi:10.1021/acsbiomaterials.0c00617. ISSN 2373-9878. PMC 7735655. PMID 33395269.
- ^ Tan, Loh Teng Hern; Low, Liang Ee; Tang, Siah Ying; Yap, Wei Hsum; Chuah, Lay Hong; Chan, Chim Kei; Lee, Learn Han; Goh, Bey Hing (2019). "A reliable and affordable 3D tumor spheroid model for natural product drug discovery: A case study of curcumin". Progress in Drug Discovery & Biomedical Science. 2. doi:10.36877/pddbs.a0000017.
- ^ Peirsman, Arne; Blondeel, Eva; Ahmed, Tasdiq; Anckaert, Jasper; Audenaert, Dominique; Boterberg, Tom; Buzas, Krisztina; Carragher, Neil; Castellani, Gastone; Castro, Flávia; Dangles-Marie, Virginie (1 November 2021). "MISpheroID: a knowledgebase and transparency tool for minimum information in spheroid identity". Nature Methods. 18 (11): 1294–1303. doi:10.1038/s41592-021-01291-4. ISSN 1548-7105. PMC 8566242. PMID 34725485.
- ^ Celik; Dominici; Filby; Das; Madden; Paunov (11 July 2019). "Fabrication of Human Keratinocyte Cell Clusters for Skin Graft Applications by Templating Water-in-Water Pickering Emulsions". Biomimetics. 4 (3): 50. doi:10.3390/biomimetics4030050. ISSN 2313-7673. PMC 6784416. PMID 31336810.
- ^ Wang, Anheng; Madden, Leigh A.; Paunov, Vesselin N. (2020). "High-throughput fabrication of hepatic cell clusteroids with enhanced growth and functionality for tissue engineering applications". Materials Advances. 1 (8): 3022–3032. doi:10.1039/D0MA00635A. ISSN 2633-5409. S2CID 229265148.
- ^ Wang, A., Madden, L.A., Paunov, V.N. 조직 공학 응용을 위한 향상된 성장 및 기능성을 갖는 간세포 클러스터로이드의 고처리량 제조. 마터. Adv. 2020, 1, 3022–3032.
- ^ Chiew, G.G.Y.; Fu, A.; Perng Low, K.; Qian Luo, K. HepG2-HUVEC 공동 배양 모델에서 내피 세포의 분화 및 리모델링을 위해서는 간암 세포의 물리적 지지가 필수적입니다. 과학부 2015, 5, 10801
- ^ 라슬리, 김, H.-J., 리, K., 서먼드, C.-A.E., 고디, M., 반다루, P., 선, W., 장, S., 장, N., 아하디안, S. 외 비알코올성 지방간 질환 모델링을 위한 인간 간 온 어 칩 플랫폼입니다. Adv. Bioscyst. 2019, 3, e 1900 104.
- ^ Wang, A., Weldrick, P.J., Madden, L.A., Paunov, V.N. Biofilm에 감염된 인간 클러스테로이드 3차원 공동 배양 플랫폼은 항균 나노기술을 테스트하는 데 있어 동물 모델을 대체합니다. ACS Appl. 마터. 인터페이스 2021, 13, 22182–22194.
- ^ 왕아, 매든 LA, 파우노프 VN. 수성 2상 피커링 에멀젼 기반의 1차 내피 및 Hep-G2 세포의 혈관화된 공동 배양 클러스토이드. 생명공학(바젤). 2022년 3월 21일;9(3):126 도이: 10.3390/생명공학 9030126 PMID: 35324815; PMCID: PMC8945860.
- ^ Du Y, Han R, Wen F, Ng San San S, Xia L, Wohland T, et al. (January 2008). "Synthetic sandwich culture of 3D hepatocyte monolayer". Biomaterials. 29 (3): 290–301. doi:10.1016/j.biomaterials.2007.09.016. PMID 17964646.
- ^ a b Derda R, Laromaine A, Mammoto A, Tang SK, Mammoto T, Ingber DE, Whitesides GM (November 2009). "Paper-supported 3D cell culture for tissue-based bioassays". Proceedings of the National Academy of Sciences of the United States of America. 106 (44): 18457–62. Bibcode:2009PNAS..10618457D. doi:10.1073/pnas.0910666106. PMC 2773961. PMID 19846768.
- ^ 페이, 스티븐 J. "WO2012022351" 유럽 특허 등록부.
- ^ Sudo R, Chung S, Zervantonakis IK, Vickerman V, Toshimitsu Y, Griffith LG, Kamm RD (July 2009). "Transport-mediated angiogenesis in 3D epithelial coculture". FASEB Journal. 23 (7): 2155–64. doi:10.1096/fj.08-122820. PMC 2718841. PMID 19246488.
- ^ Rodoplu, Didem; Matahum, Jefunnie Sierra; Hsu, Chia-Hsien (29 March 2022). "A microfluidic hanging drop-based spheroid co-culture platform for probing tumor angiogenesis". Lab on a Chip. 22 (7): 1275–1285. doi:10.1039/D1LC01177D. ISSN 1473-0189. PMID 35191460. S2CID 247024765.
- ^ Baillargeon, P; Shumate, J; Hou, S; Fernandez-Vega, V; Marques, N; Souza, G; et al. (2019). "Automating a Magnetic 3D Spheroid Model Technology for High-Throughput Screening". SLAS Technol. 24 (4): 420–428. doi:10.1177/2472630319854337. PMC 7704036. PMID 31225974.
- ^ Hou, S; Tiriac, H; Sridharan, BP; Scampavia, L; Madoux, F; Seldin, J; et al. (2018). "Advanced Development of Primary Pancreatic Organoid Tumor Models for High-Throughput Phenotypic Drug Screening". SLAS Discov. 23 (6): 574–584. doi:10.1177/2472555218766842. PMC 6013403. PMID 29673279.
- ^ Madoux, F; Tanner, A; Vessels, M; Willetts, L; Hou, S; Scampavia, L; et al. (2017). "A 1536-Well 3D Viability Assay to Assess the Cytotoxic Effect of Drugs on Spheroids". SLAS Discov. 22 (5): 516–524. doi:10.1177/2472555216686308. PMID 28346088.
- ^ Quereda, V; Hou, S; Madoux, F; Scampavia, L; Spicer, TP; Duckett, D (2018). "A Cytotoxic Three-Dimensional-Spheroid, High-Throughput Assay Using Patient-Derived Glioma Stem Cells". SLAS Discov. 23 (8): 842–849. doi:10.1177/2472555218775055. PMC 6102052. PMID 29750582.
- ^ Kota, S; Hou, S; Guerrant, W; Madoux, F; Troutman, S; Fernandez-Vega, V; et al. (2018). "A novel three-dimensional high-throughput screening approach identifies inducers of a mutant KRAS selective lethal phenotype". Oncogene. 37 (32): 4372–4384. doi:10.1038/s41388-018-0257-5. PMC 6138545. PMID 29743592.
- ^ Cassano D, Santi M, D'Autilia F, Mapanao AK, Luin S, Voliani V (2019). "Photothermal effect by NIR-responsive excretable ultrasmall-in-nano architectures". Materials Horizons. 6 (3): 531–537. doi:10.1039/C9MH00096H. ISSN 2051-6347.
- ^ Mapanao AK, Santi M, Faraci P, Cappello V, Cassano D, Voliani V (September 2018). "Endogenously Triggerable Ultrasmall-in-Nano Architectures: Targeting Assessment on 3D Pancreatic Carcinoma Spheroids". ACS Omega. 3 (9): 11796–11801. doi:10.1021/acsomega.8b01719. PMC 6173554. PMID 30320273.
- ^ Zustiak, Silviya Petrova; Dadhwal, Smritee; Medina, Carlos; Steczina, Sonette; Chehreghanianzabi, Yasaman; Ashraf, Anisa; Asuri, Prashanth (February 2016). "Three-dimensional matrix stiffness and adhesive ligands affect cancer cell response to toxins". Biotechnology and Bioengineering. 113 (2): 443–452. doi:10.1002/bit.25709. ISSN 1097-0290. PMID 26184715. S2CID 38031281.
- ^ Otieno, Monicah A.; Gan, Jinping; Proctor, William (2018), Chen, Minjun; Will, Yvonne (eds.), "Status and Future of 3D Cell Culture in Toxicity Testing", Drug-Induced Liver Toxicity, Methods in Pharmacology and Toxicology, New York, NY: Springer, pp. 249–261, doi:10.1007/978-1-4939-7677-5_12, ISBN 978-1-4939-7677-5
- ^ Fey SJ, Wrzesinski K (June 2012). "Determination of drug toxicity using 3D spheroids constructed from an immortal human hepatocyte cell line". Toxicological Sciences. 127 (2): 403–11. doi:10.1093/toxsci/kfs122. PMC 3355318. PMID 22454432.
- ^ Messner S, Agarkova I, Moritz W, Kelm JM (January 2013). "Multi-cell type human liver microtissues for hepatotoxicity testing". Archives of Toxicology. 87 (1): 209–13. doi:10.1007/s00204-012-0968-2. PMC 3535351. PMID 23143619.
- ^ Jensen J, Hyllner J, Björquist P (June 2009). "Human embryonic stem cell technologies and drug discovery". Journal of Cellular Physiology. 219 (3): 513–9. doi:10.1002/jcp.21732. PMID 19277978. S2CID 36354049.
- ^ Alexander F, Eggert S, Wiest J (February 2018). "A novel lab-on-a-chip platform for spheroid metabolism monitoring". Cytotechnology. 70 (1): 375–386. doi:10.1007/s10616-017-0152-x. PMC 5809666. PMID 29032507.
- ^ Wang H, Brown PC, Chow ECY, Ewart L, Ferguson SS, Fitzpatrick S, Freedman BS, Guo GL, Hedrich W, Heyward S, Hickman J, Isoherranen N, Li AP, Liu Q, Mumenthaler SM, Polli J, Proctor WR, Ribeiro A, Wang JY, Wang RL, Huang SM. 3D 세포 배양 모델: 약물 약동학, 안전성 평가 및 규제 고려. Clin Trans Sci. 2021년 9월 14(5):1659-1680. doi:10.1111/cts.13066. Epub 2021 Jun 16. PMID: 33982436; PMCID: PMC8504835
- ^ Jensen C, Teng Y (2020). "Is It Time to Start Transitioning From 2D to 3D Cell Culture?". Frontiers in Molecular Biosciences. 7: 33. doi:10.3389/fmolb.2020.00033. PMC 7067892. PMID 32211418.
- ^ Szot, C.S., Buchanan, C.F., Freeman, J.W., Rylander, M.N. 3D in vitro biodenged Tumors Based Collagen I Hydrogels. 생체 재료 2011, 32, 7905–7912.
- ^ K.M. Yamada; Cukuerman, E. 모델링 조직 형태 형성 및 3D 암. 셀 2007, 130, 601–610,26]
- ^ [], 김, J.B. 암 생물학의 3차원 조직 배양 모델. 암생물학 세미나에서; 학술출판: 캠브리지, MA, 2005; 15권, 365-377쪽
- ^ 호닝, J.L., Sahoo, S.K., Vijayaraghavalu, S., Dimitrijevic, S., Vasir, J.K., J., J., J.K., Jain, T.K., Panda, A.K., Labhasetwar, V.3-D Tumor Model for in vitro in vitro actival drugs. Mol. Pharm. 2008, 5, 849–862 Horning, J.L., Sahoo, S.K., Vijayaraghavalu, S., Dimitrijevic, S., Vasir, J.K., J.K., Jain, T.K., Panda, A.K., Labhasetwar, V. in vitro 평가용 3-D 종양 모델. Mol. Pharm. 2008, 5, 849–862
- ^ Soares, C.P.; Midlej, V.; de Oliveira, M.E.W.; Benchimol, M.; Costa, M.L.; Mermelstein, C. 2D 및 3D 조직 심장 세포는 세포 형태, 접착 접합부, Myofibril의 존재 및 단백질 발현의 차이를 보여줍니다. PLoS ONE 2012, 7, e38147
- ^ Lei, Y; Schaffer, D.V. 인간 만능 줄기세포 확장 및 분화를 위한 완전 정의되고 확장 가능한 3D 배양 시스템. 프록. Natl. 카드. Sci. USA 2013, 110, E5039–E5048.
- ^ 2. 초프라 주, 딘 주, TV 주, 해니건 주, E.V. 인간 자궁경부암의 3차원 내피-종양 상피세포 상호작용. 체외 세포. Dev. Biol.-애니. 1997, 33, 432–442.
- ^ a b 하반자르, O., Diab-Assaf, M., Caldefie-Chezet, F., & Delort, L. (2021) 3D 세포 배양 시스템: 종양 적용, 장점 및 단점. 국제 분자 과학 저널, 22(22), 12200. https://doi.org/10.3390/ijms222212200 이 문서에는 CC BY 4.0 라이센스에 따라 사용 가능한 텍스트가 포함되어 있습니다.
- ^ Tibbit MW, Anseth KS. 세포외 기질로서의 하이드로겔은 3D 세포 배양을 모방합니다. 바이오테크놀 바이오엥. 2009 Jul 1;103(4):655-63. doi: 10.1002/bit.22361. PMID: 19472329; PMCID: PMC2997742.
