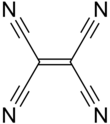
테트라사이아노에틸렌
Tetracyanoethylene
| |||
 | |||
| 이름 | |||
|---|---|---|---|
| 기본 IUPAC 이름 에틸렌트라카르보니트릴 | |||
| 기타 이름 TCNE | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 켐스파이더 | |||
| ECHA 인포카드 | 100.010.527 | ||
펍켐 CID | |||
| 유니 | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| C2(CN)4 | |||
| 몰 질량 | 128.094 g·mol−1 | ||
| 밀도 | 1.35g/cm3 | ||
| 녹는점 | 199 °C(390 °F; 472 K) | ||
| 끓는점 | 130 ~ 140 °C(266 ~ 284 °F, 403 ~ 413 K) 0.1 mmHg(자막)[1] | ||
달리 명시된 경우를 제외하고 표준 상태(25 °C [77 °F], 100 kPa)의 재료에 대한 데이터가 제공됩니다. | |||
테트라사이아노에틸렌(TCNE)은 화학식이2 C(CN)4인 유기 화합물입니다.이것은 무색의 고체이지만 샘플은 종종 오프화이트입니다.그것은 시안화탄소의 중요한 구성원입니다.
합성 및 반응
TCNE은 말로니트릴을 브로마이드 칼륨 존재 하에서 브롬화하여 KBr 복합체를 생성하고 구리로 [1]탈할로겐화함으로써 준비됩니다.
과산화수소로 TCNE을 산화시키면 해당 에폭시드가 생성되며, 이는 특이한 [2]특성을 갖습니다.
염기가 있을 때 TCNE는 말로노니트릴과 반응하여 펜타시아노프로페니드의 [3]염을 생성합니다.
- C2(CN)4 + CH2(CN)2 → [(NC)2 C=C(CN)-C(CN)]2− + CN− + 2 H+
레독스 화학
TCNE는 전자 수용체입니다.시아노 그룹은 낮은 에너지 γ* 궤도를 가지며, 중심 C=C 이중 결합에 대한 γ계(가속)를 가진 네 개의 그러한 그룹의 존재는 친전자적 알켄을 생성합니다.TCNE는 페로센/페로세늄 [4]대비 -0.27V에서 감소합니다.
- C2(CN)4 + e− → [C2(CN)]4−
전자를 받아들이는 능력 때문에 TCNE는 수많은 전하 이동 [5]염을 준비하는 데 사용되었습니다.
TCNE의 중심 C=C 거리는 [6]오후 135입니다.환원 시,[7] 이 결합은 카운터온에 따라 141-145pm까지 연장됩니다.
안전.
TCNE는 습한 공기 중에서 가수분해하여 시안화수소를 생성하므로 이에 [1]따라 처리해야 합니다.
레퍼런스
- ^ a b c Carboni, R. A. (1959). "Tetracyanoethylene". Organic Syntheses. 39: 64. doi:10.15227/orgsyn.039.0064.
- ^ Linn, W. J. (1969). "Tetracyanoethylene Oxide". Organic Syntheses. 49: 103. doi:10.15227/orgsyn.049.0103.
- ^ Middleton, W. J.; Wiley, D. W. (1961). "Tetramethylammonium 1,1,2,3,3-Pentacyanopropenide". Org. Synth. 41: 99. doi:10.15227/orgsyn.041.0099.
- ^ Connelly, N. G.; Geiger, W. E. (1996). "Chemical Redox Agents for Organometallic Chemistry". Chemical Reviews. 96 (2): 877–910. doi:10.1021/cr940053x. PMID 11848774.
- ^ Chittipeddi, Sailesh; Cromack, K. R.; Miller, Joel S.; Epstein, A. J. (1987-06-22). "Ferromagnetism in Molecular Decamethylferrocenium Tetracyanoethenide (DMeFc TCNE)". Physical Review Letters. 58 (25): 2695–2698. Bibcode:1987PhRvL..58.2695C. doi:10.1103/physrevlett.58.2695. ISSN 0031-9007. PMID 10034821.
- ^ Becker, P.; Coppens, P.; Ross, F. K. (1973). "Valence electron distribution in cubic tetracyanoethylene by the combined use of x-ray and neutron diffraction". Journal of the American Chemical Society. 95 (23): 7604–7609. doi:10.1021/ja00804a010.
- ^ Bock, H.; Ruppert, K. (1992). "Structures of charge-perturbed or sterically overcrowded molecules. 16. The cesium tetracyanoethylenide radical salt". Inorganic Chemistry. 31 (24): 5094–5099. doi:10.1021/ic00050a032.